姜黄素对放射性脑损伤大鼠行为学与血脑屏障保护作用的研究
胡乃霞 石岩 徐诚 张谦 尚红记 王安营 李兰华 刘运林
1泰安市中心医院(山东泰安271000);2泰安市第一人民医院(山东泰安271000);3泰山医学院附属医院(山东泰安271000)
放射性脑损伤(radiation injured brain,RIB)是脑组织受到射线辐射后产生的直接或继发性损伤,多见于鼻咽癌放疗后[1],目前仍缺乏有效的治疗手段。本课题组以往的研究显示:射线可对RIB大鼠造成行为学及脑组织改变,射线也能诱发血管内皮细胞的凋亡、坏死。姜黄素对放射性内皮细胞损伤具有保护作用,为探讨姜黄素对射线损伤的脑组织是否具有保护作用,故进行了本次实验研究。本实验应用姜黄素治疗RIB大鼠,观察各组大鼠行为学及组织病理学改变,有望阐明姜黄素对RIB大鼠的保护作用及机制,为临床治疗提供理论依据。
1 材料与方法
1.1 材料成年健康雄性SD大鼠120只,体质量(180±10)g,由济宁鲁抗实验中心提供(动物合格证编号3700920004220)。主食为颗粒型普通大鼠饲料,室温为20~23℃,昼夜节律以灯光控制,明暗交替12 h/12 h,实验过程中大鼠摄食饮水过程由大鼠自行控制,不加人工干预,采用随机数字表法将大鼠分为对照组、辐射组、治疗组。
1.2 方法
1.2.1 动物分组及模型制作将120只SD雄性大鼠随机分为3组,每组40只,分为对照组、辐射组、治疗组。所有大鼠给予10%水合氯醛3.5 mL/kg腹腔注射,麻醉成功后,对照组仅摆体位,不给予射线照射,仅给予同剂量的药物溶解介质。其余2组,在铅模保护下,采用直线加速器进行垂直单次照射大鼠全脑,电子束6 Mev,剂量率300 cGy/min,照射源与大鼠体表距离30 cm。治疗组建模成功后给予姜黄素腹腔注射,从建模第1天给予姜黄素100 mg/(kg·d)腹腔注射,第30天后应用Morris水迷宫实验和逃避跳台实验测试各组大鼠的学习记忆能力。经放射线照射后辐射组及对照组,腹腔注射相同体积的姜黄素溶剂MDSO作为安慰剂,各组分别在完成Morris水迷宫测试后各取10只处死行血脑屏障通透性检测。其余大鼠取脑组织固定,石蜡切片,进行组织病理及免疫组化染色。
1.2.2 行为学检测跳台逃避实验中,记录每只大鼠5 min内错误次数及逃避潜伏期作为学习记忆能力的评价指标。Morris水迷宫实验包括定位航行实验和空间探索实验,通过记录原平台象限停留时间、总路径长度、逃避潜伏期、错误次数评价各组大鼠学习记忆能力改变。
1.2.3 血脑屏障通透性检测每只大鼠经左心室生理盐水灌注、取脑、离心、取上清,采用分光光度计检测吸光度,对比标准曲线查出大鼠脑组织伊文氏蓝(Evans blue,EB)浓度,按公式计算脑组织EB含量(μg/g),EB含量=EB 浓度(μg/mL)×3 mL(甲酰胺体积)/脑组织质量(g)。
1.2.4 组织病理学检查方法采用多聚甲醛经左心室灌注外固定鼠脑,每组在相应时间点取20只,10只进行海马区石蜡切片测定胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP),另10只进行石蜡切片免疫组化染色测定环核苷酸-3′磷酸水解酶(cyclic nucleotide 3′phosphohydrolase,CNPase)。
1.3 统计学方法使用SPSS 20.0软件包进行处理,多组间的比较应用单因素方差分析,两两比较可用SNK检验,两组间比较采用t检验,结果以均数±标准差来表示,以P<0.05为差异有统计学意义。
2 结果
2.1 照射后大鼠一般情况对照组大鼠精神状态正常,进食及饮水情况良好,动作灵活,对刺激反应迅速。辐射组大鼠表现为精神差,进食饮水较对照组显著减少,动作迟缓,对刺激反应较迟钝,性格改变,凶悍、烦躁、相互攻击,出现头部照射区毛发脱落、稀疏,个别大鼠表现为呼吸急促,皮肤温度下降。治疗组在建模后3 d内,出现精神差、行动迟缓、饮食减少等表现,3~4 d后逐渐好转,10 d左右恢复正常。
2.2 大鼠行为学检测结果
2.2.1 跳台逃避实验造模后第30天,各组大鼠均行跳台逃避试验,实验第1天大鼠错误次数代表大鼠学习能力,实验第2天中,大鼠错误次数及逃避潜伏期代表大鼠记忆能力。第1天实验中,辐射组较对照组错误次数明显增多,治疗组较辐射组错误次数明显减少,差异均有统计学意义(P<0.05)。第2天实验中,辐射组大鼠逃避潜伏期较对照组显著缩短,错误次数明显增加(P<0.05)。治疗组与辐射组比较,逃避潜伏期明显延长(P<0.05),错误次数明显减少(P<0.05)。见表1。
表1 跳台逃避实验结果Tab.1 Platform escape test result ±s
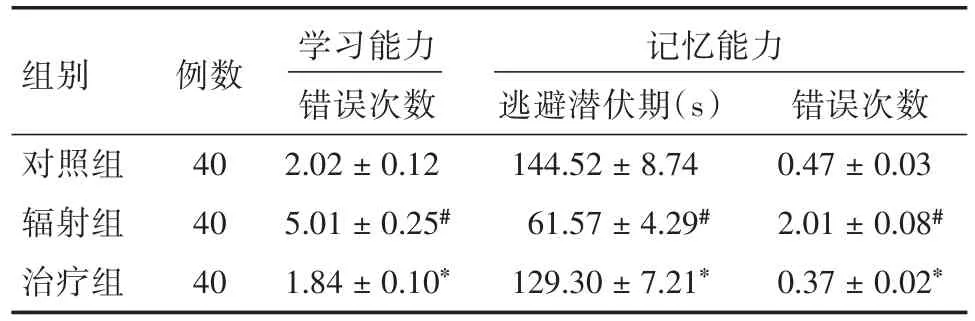
表1 跳台逃避实验结果Tab.1 Platform escape test result ±s
注:与对照组比较,#P<0.05;与辐射组比较,*P<0.05
2.2.2 Morris水迷宫实验辐射组大鼠学习记忆能力较对照组明显下降(P<0.05),治疗组较辐射组显著提高(P<0.05),说明射线对各组大鼠学习记忆能力有损害,而姜黄素可改善射线照射后大鼠的学习记忆能力(表2)。
表2 Morris水迷宫实验结果Tab.2 Morris water maze test result ±s
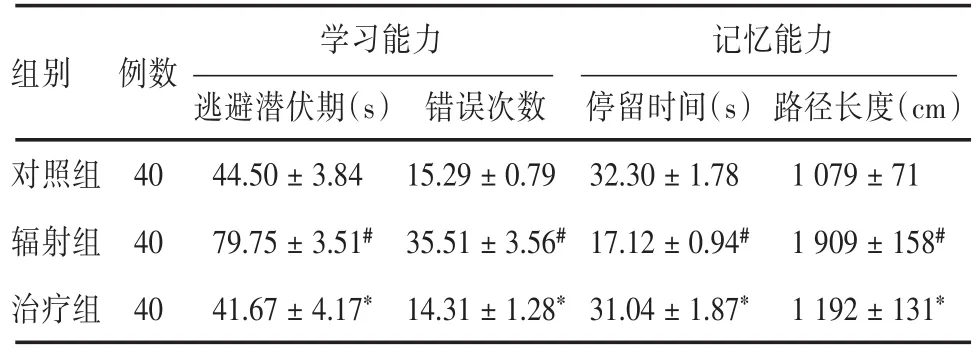
表2 Morris水迷宫实验结果Tab.2 Morris water maze test result ±s
注:与对照组比较,#P<0.05;与辐射组比较,*P<0.05
组别 例数对照组辐射组治疗组路径长度(cm)1 079±71 1 909±158#1 192±131*40 40 40学习能力逃避潜伏期(s)44.50±3.84 79.75±3.51#41.67±4.17*错误次数15.29±0.79 35.51±3.56#14.31±1.28*记忆能力停留时间(s)32.30±1.78 17.12±0.94#31.04±1.87*
2.3 血脑屏障通透性实验辐射组大鼠脑组织EB含量较对照组显著增多(P<0.05),治疗组较辐射组EB含量显著减少(P<0.05),提示射线能够损伤大鼠血脑屏障使其通透性增加,姜黄素对射线引起的RIB大鼠血脑屏障损伤有保护作用(表3)。
表3 各组大鼠脑组织EB含量Tab.3 EB content of brain tissue in each group ±s,μg/g

表3 各组大鼠脑组织EB含量Tab.3 EB content of brain tissue in each group ±s,μg/g
注:与对照组比较,#P<0.05;与辐射组比较,*P<0.05
2.4 大鼠海马区HE染色对照组无明显病理改变。辐射组可见不同程度的海马及大脑皮层神经元的变性,细胞核内染色质浓集,胞浆红染,胞体萎缩,细胞内可见空泡变性;可见白质区组织结构梳松、血管扩张和血管周围间隙扩大等表现。姜黄素组细胞形状规则,有层次感,未查见炎性细胞浸润,无结缔组织增生,与对照组比较差异不大。见图1。
2.5 各组大鼠病理学变化
2.5.1 GFAP免疫组化染色结果在海马区域中,星形胶质细胞的细胞浆和细胞膜呈棕褐色,为阳性细胞。星形胶质细胞密度高,胞体圆而饱满,轮廓清晰,突起粗、长,均匀深染(图2)。在200倍显微镜视野下,计数各组大鼠海马区域内的GFAP阳性细胞数。治疗组与辐射组比较差异有统计学意义(P<0.05),辐射组与对照组比较差异有统计学意义(P<0.05)。见表4。
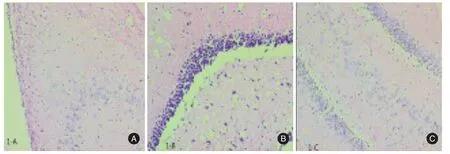
图1 大鼠脑组织HE染色Fig.1 HE staining of rats brain tissue(× 200)

图2 GFAP免疫组化染色Fig.2 Immunnohistochemical staining of GFAP cells(×200)
2.5.2 大鼠海马区CNPase免疫组化染色在200倍显微镜视野下,阳性细胞胞浆呈黄褐色,圆形或卵圆形,少数有短的、突起的胞体,细胞较密集,细胞界限不清(图3);在白质区域表达强阳性,治疗组与辐射组差异有统计学意义(P<0.05),辐射组与对照组差异有统计学意义(P<0.05)。见表5。

图3 CNPase免疫组化染色Fig.3 Immunnohistochemical staining of CNPase cells(×200)
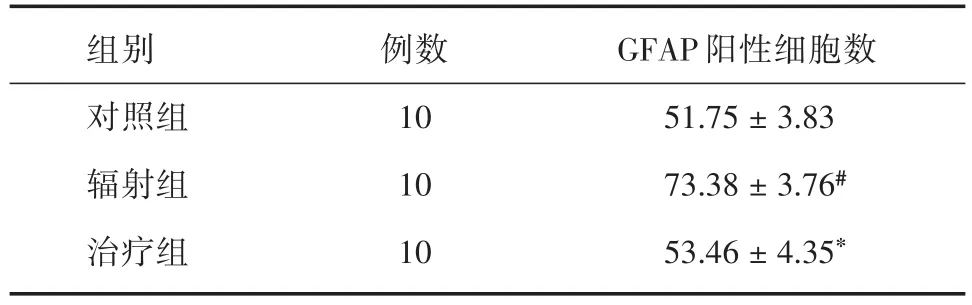
表4 GFAP阳性细胞个数Tab.4 Number of GFAP cells x s,个
表5 CNPase阳性灰度值Tab.5 Grave value of positive CNPase cells ±s
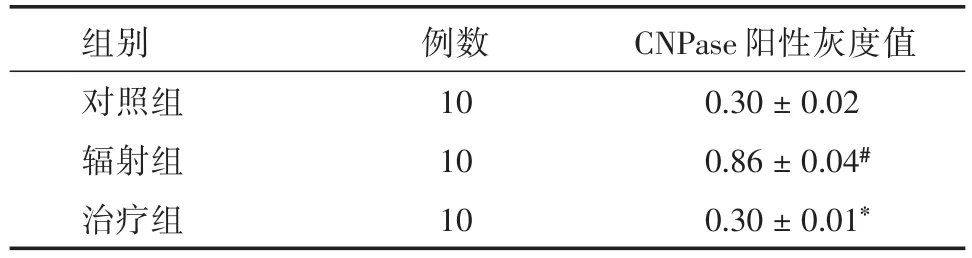
表5 CNPase阳性灰度值Tab.5 Grave value of positive CNPase cells ±s
注:与辐射组比较,*P<0.05;与对照组比较,#P<0.05
CNPase阳性灰度值0.30±0.02 0.86±0.04#0.30±0.01*组别对照组辐射组治疗组例数10 10 10
3 讨论
在我国,RIB成为放射治疗后的严重远期并发症之一,发病率可达3/10万,病死率高达0.7/10万,局部高发地区如广东省高于世界平均水平40倍[2]。其发病机制尚不明确,目前主要在血管损伤、神经元及神经干细胞损伤、免疫效应等方面进行探讨[3]。本课题组早期实验研究及本次实验结果均提示辐射可引起大鼠学习记忆能力的降低,这和国外研究[4]结果一致。
本课题组既往研究证实了姜黄素对血管内皮细胞辐射后损伤有保护作用,且与Merk1/2信号系统有关[5],预实验结果也证实姜黄素对离体神经干细胞放射性损伤也有保护作用。但在中枢神经系统,有关姜黄素作用机制的研究非常缺乏[6]。姜黄素为姜黄的主要成分,具有抗炎、抗氧化、清除自由基等多种功能,对神经系统、心血管系统、消化系统等都具有药理作用[7]。本次实验观察到早期予以姜黄素治疗后可显著提高模型鼠的学习记忆能力,治疗组大鼠脑组织中EB含量明显降低,证明姜黄素对促进、改善模型鼠学习记忆功能、改善血脑屏障损伤的作用确实有效。内皮细胞破坏是血脑屏障破坏的启动环节,脑损伤产生后释放的炎症因子可以增加其血脑屏障的通透性,血脑屏障通透性的增加使血液中白细胞在损伤脑组织中的聚集进一步增加,从而加重炎症反应[8]。研究[9]显示,姜黄素治疗缺血性脑损伤的作用机制包括减轻氧化应激引起的损伤、促进受损伤血脑屏障的恢复。姜黄素保护血脑屏障的机制是否与之相同,还需进一步研究。
实验可观察到辐射组大鼠脑组织GFAP表达明显增加,GFAP是星形胶质细胞的重要成分,在细胞活化时可大量表达,能够维持中枢神经系统正常的结构和功能,并在中枢神经系统受损害时反应活跃[10]。既往研究[11]显示在脑组织接受射线的初期,活化的星形胶质细胞可在损伤区域周围产生胶质界膜,有利于损伤的恢复,但星形胶质细胞过度胶质化时,可形成机械屏障,阻碍神经组织的结构修复以及功能的恢复。本实验结果提示射线可引起GFAP表达增加,与前人研究结果一致。星形胶质细胞的反应性增生现象并不能完全发挥星形胶质细胞的正常生理功能[12],这可能是RIB大鼠血脑屏障破坏及学习记忆能力差的原因之一。经姜黄素治疗后GFAP表达明显降低,推测姜黄素可通过下调GFAP的表达来减少星形胶质细胞的增生,从而改善大鼠学习记忆能力。
实验中辐射组大鼠海马区CNPase阳性灰度值较对照组明显降低。CNPase为髓鞘的构成成分,在形成髓鞘的早期即可出现,其在少突胶质细胞中含量大约占髓鞘的一半,在少突胶质细胞的损伤中起关键作用[13]。在中枢神经系统放射性损伤前期研究中证实,血管及少突胶质细胞受损伤在该病的发生与发展过程中起了主要作用,少突胶质细胞为中枢神经系统成髓鞘胶质细胞,能够合成髓磷脂包绕于神经纤维的轴突从而形成髓鞘,损伤晚期较为典型的病理学特征是脱髓鞘改变以及蛋白质凝固性坏死。本次实验结果提示射线可引起大鼠脑组织CNPase的表达降低,该结果与前人研究一致[14],符合少突胶质细胞的放射性损伤效应[15]。本实验观察到姜黄素组CNPase阳性灰度值较辐射组明显增高,提示姜黄素可上调CNPase的表达,推测姜黄素通过上调CNPase的表达减轻少突胶质细胞的脱髓鞘,从而起到对放射性损伤的保护作用。
综上所述,姜黄素对RIB大鼠血脑屏障有保护作用,并下调GFAP、上调CNPase的表达,可能是姜黄素改善RIB大鼠学习记忆能力的途径之一,为RIB的治疗提供更多思路。但是,本实验未能阐明姜黄素通过何种机制调节GFAP、CNPase的表达,这将有待进一步研究。
[1]尚红记,刘运林.Notch信号通路参与外源性碱性成纤维细胞生长因子对神经干细胞辐射损伤保护作用的实验研究[J].中华行为医学与脑科学杂志,2014,23(1):12-14.
[2]XIE Y,ZHAO Q Y,LI H Y,et al.Curcumin ameliorates cognitive deficits heavy ion irradiation induced learning and memory deficits through enhancing of Nrf2 antioxidant signaling pathways[J].Pharmacol Biochem Behav,2014,126(11):181-186.
[3]HAO D J,LIU C,ZHANG L,et al.Lipopolysaccharide and curcumin costimulation potentiates olfactory ensheathing cell phagocytosis via enhancing their activation[J].Neurotherapeutics,2017,14(2):502-518.
[4]BHUTANI M K,BISHNOI M,KULKARNI S K,et al.Antidepressant like effect of curcumin and its combination with piperine in unpredictable chronic stressinduced behavioral,biochemical and neuro chemical changes[J].Pharmacol Biochem Behav,2009,92(1):39-43.
[5]杨福柏,严秀丽,刘运林.姜黄素抗辐射诱导内皮细胞凋亡信号的转导机制[J].中华劳动卫生职业病杂志,2012,30(5):373-374.
[6]肖颖,刘永亮.葡萄籽原花青素对放射性脑损伤大鼠学习能力和E2K1/2活性的影响[J].西安交通大学学报,2016,37(5):739-742.
[7]LYUBIMOVA N,HOPEWELLl J W.Experimental evidence to support the hypothesis that damage to vascular endothelium plays the primary role in the development of late radiation induced CNS injury[J].Br J Radiol,2004,77(918):488-492.
[8]陈柏霖,孙熠,梁滨,等.大鼠放射性脑损伤所致血脑屏障通透性改变与EBA及VEGF表达的相关性研究[J].天津医药,2016,44(6):691-693.
[9]张谦,刘运林.丁苯酞对放射性脑损伤大鼠学习记忆能力及海马MMP-9表达的影响[J].中华神经医学杂志,2012,21(4):318-320.
[10]VAGNER T,DVORZHAK A ,WOJTOWICZ A M,et al.Systemic application of AAV vectors targeting GFAP-expressing astrocytes in Z-Q175-KI Huntington′s disease mice[J].Mol Cell Neurosci,2016,77(11):76-86.
[11]OKONKWO D O,YUE J K,PUCCIO A M,et al.GFAP-BDP as an acute diagnostic marker in traumatic brain injury:results from the prospective transforming research and clinical knowledge in traumatic brain injury study[J].J Neurotrauma,2013,30(17):1490-1497.
[12]OMIDI A,AKBARI M,MORTEZAEE K,et al.Prenatal transplantation of epidermal neural crest stem cells in malformation of cortical development mouse model[J].Microsc Res Tech,2017,80(4):394-405.
[13]IMAMURA O,ARAI M,DATEKI M,et al.Donepezil promotes differentiation of neural stem cells into mature oligodendrocytes at the expense of astrogenesis[J].J Neurochem,2017,140(2):231-244.
[14]DESENNA P N,BAGATINI P B,GALLAND F.Physical exercise reverses spatial memory deficit and induces hippocampal astrocyte plasticity in diabetic rats[J].Brain Res,2017,15(1655):242-251.
[15]刘运林.碱性成纤维细胞生长因子转基因治疗对放射性脑损伤大鼠星形胶质细胞相关蛋白表达的影响[J].中华行为医学与脑科学杂志,2013,22(2):107-109.

