H2+Br2光化反应的温度系数
高 志 崇
(泰山学院 化学化工学院 山东 泰安 271000)
整体而言,光化反应与热化学相比存在两方面的特点.热力学方面,热反应是伴随着自由能的降低,但许多光化反应却会使体系的自由能增加.另外,不能用一般化学反应的平衡常数来衡量光化平衡和平衡组成,光化反应的平衡组成与所用光的波长和强度有关[1].作者通过将光子的能量引入热力学很好地解决了这方面的问题.动力学方面,光化反应的温度系数较小,不像热反应温度升高10K,速率增加2~4倍,它只增加0.1~1倍[1].通常认为,这是由于光化学的初级反应与吸收光的强度有关,而次级反应中又常涉及到自由基的反应,这些反应的活化能不大,所以温度对反应速率的影响不大[2].然而,上述解释仅是一个定性解释,并没有定量的解释上述动力学方面的问题.作者曾经通过HI光解反应温度系数的计算对上述问题予以探讨[3],下面对H2+Br2光化反应的温度系数进行分析,进一步对上述问题进行探讨.
1 H2+Br2光化反应的机理
1906年,波登斯坦(Bodenstein)通过实验测定了反应 H2+Br2+hv→2HBr的速率方程.13年后,克里斯琴森(Christiansen)等人提出了如下的连锁反应机理[4].


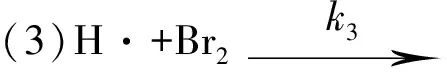
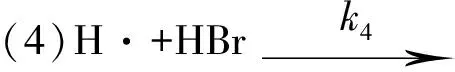
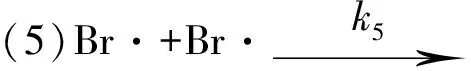

2 H2+Br2光化反应的速率常数k与温度T、活化能Ea之间的关系
2.1 活化能的确定
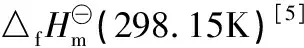
表1 某些物质的

对于反应(3),该反应的焓变为:
=(-36.93+111.76-221.7-0)kJ·mol-1=-146.87kJ·mol-1
反应(3)逆向反应的活化能为E-3=176 kJ·mol-1[4].假设反应于恒压条件下进行,活化能大小与温度无关,则反应(3)的活化能为:
E3=△H3+E-3=(-146.86+176)kJ·mol-1=29.14kJ·mol-1
反应(4)为反应(2)的逆反应.反应(2)的焓变为:
=(221.7-36.93-111.76-0)kJ·mol-1=73.01kJ·mol-1
所以,反应(4)的活化能为:
E4=E2-△H2=(74-73.01)kJ·mol-1=0.99kJ·mol-1


图1 H2+Br2光化反应的活化能示意图
由图1可以看出,次级反应的活化能Esec为:
Esec=E2-E4+E3=(74-0.99+29.14)kJ·mol-1=102.15kJ·mol-1
2.2 温度系数
反应H2+Br2+hv→2HBr在25℃时量子产量很小,在200℃时量子产率为2[4],因而取T1=473K,T2=483K进行计算.将Esec=102.15kJ·mol-1代入公式得:

即H2+Br2光化反应的温度系数为1.71,即温度上升10K,反应速率增加0.71倍.
3 小结

[参考文献]
[1]金世勋.物理化学[M].北京:高等教育出版社,1989.
[2]傅献彩,沈文霞,姚天扬,等.物理化学(第五版)(下册)[M].北京:高等教育出版社,2006.
[3]高志崇.HI光解反应的温度系数[J].泰山学院学报,2017,39(3):85-87.
[4]天津大学物理化学教研室.物理化学(第五版)(下册)[M].北京:高等教育出版社,2009.
[5]廖雨郊,黄汉平,蔡福安.物理化学[M].北京:高等教育出版社,1994.

