雅津蛋白桑多糖的分离纯化及生物活性研究
王羚佳WANG Ling-jia 舒晓梦 - 辛 文 张驰松 - 陈祥贵 - 杨 潇
(1. 西华大学食品与生物工程学院,四川 成都 610039;2. 成都市农林科学院,四川 成都 611130)
桑叶为桑科(Moraceae)植物桑(MorusalbaL.)的叶,目前已被卫生部认定为药食两用植物[1]。已有的研究表明,桑叶多糖具有调节人体代谢和清除自由基的功能[2];其机制涉及抑制糖代谢相关酶类及抗氧化[3]。 雅津蛋白桑又称饲料桑,是中国培育的新型桑树品种,具有区域适应性和抗逆性强、蛋白质含量高、产量高等的优点,已在中国多个地区大力推广,开发前景十分广阔[4]。
目前对桑叶多糖的研究主要集中于提取方法、多糖成分表征、单一多糖成分的纯化和生物活性鉴定[5]。在多种植物多糖提取方法中酶解法操作条件相对温和,对提取物的生物活性损伤小,提取效率高,有较大的实用价值[6]。在多糖生物活性研究中也发现不同分子量的桑叶多糖成分表现出了不同的生物活性[3,7-8]。但从雅津蛋白桑叶中提取多糖作为功能性食品原料使用时,考虑到生产成本,通常采用总多糖为原料,而对雅津蛋白桑叶总多糖的酶法提取与纯化及其生物活性方面的研究却无相关报道。本研究利用正交试验优化了纤维素酶法提取雅津蛋白桑叶多糖的工艺条件,再采用Sephadex G-100 型葡聚糖凝胶对多糖进行纯化,并比较纯化前后多糖的生物活性,为以雅津蛋白桑叶为原料的桑叶多糖在食品领域的进一步开发和利用提供理论依据。
1 材料与方法
1.1 材料与设备
雅津蛋白桑桑叶:成都市农林科学院;
浓硫酸、苯酚、无水乙醇、三氯乙酸、葡萄糖、抗坏血酸、铁氰化钾、三氯化铁、硫酸亚铁、磷酸二氢钠、水杨酸、磷酸氢二钠、H2O2(30%)、无水碳酸钠、蔗糖:分析纯,成都市科龙化工试剂厂;
1,1-二苯基-2-苦肼基自由基(DPPH)、对硝基苯-β-D-半乳糖吡喃糖苷(pNPG):美国Sigma公司;
纤维素酶、α-葡萄糖苷酶:上海源叶生物科技有限公司;
制备液相色谱仪:AKTA purifier 10型,美国GE公司;
多功能酶标仪:Infinite F500型,瑞士TECAN公司;
电子天平:BSA224型,德国Sartorius公司。
1.2 桑叶多糖含量的测定
采用苯酚-硫酸法[9]。
1.3 纤维素酶法提取桑叶多糖
将新鲜桑叶用蒸馏水冲洗干净,除去表面杂质,冻干粉碎,100目过筛待用。准确称量桑叶粉10.00 g,置于圆底烧瓶中,加入100 mL蒸馏水[料液比1∶10 (g/mL)],适量纤维素酶,充分震荡,使其溶解。调节pH值,在一定温度下酶解。并在80 ℃下回流60 min提取多糖。提取液冷却后抽滤,滤液中加入10 mL三氯乙酸,混匀后4 ℃过夜以沉淀蛋白。过滤,滤液于4 ℃、5 000 r/min离心10 min,弃沉淀。取上清液加入4倍体积的无水乙醇,于4 ℃ 过夜沉淀多糖。4 ℃、5 000 r/min离心10 min去上清,沉淀于-40 ℃冷冻干燥后待用。
1.3.1 单因素对纤维素酶法提取多糖得率的影响 根据文献[10],酶解pH、酶解温度、酶解时间和酶浓度是影响酶法提取多糖得率的主要因素。为了解各因素变化对多糖得率的影响,选取酶解pH、酶解温度、酶解时间和酶浓度进行单因素试验。
(1) 酶解pH的影响:固定纤维素酶浓度2%、酶解温度 55 ℃、酶解时间50 min,分别比较pH为 4.0,4.5,5.0,5.5,6.0,6.5,7.0时对多糖得率的影响。
(2) 酶解温度的影响:固定纤维素酶浓度2%、酶解pH 6.0、酶解时间50 min,分别比较酶解温度为45,50,55,60,65 ℃ 时对多糖得率的影响。
(3) 酶解时间的影响:固定纤维素酶浓度2%、酶解pH 6.0、酶解温度 55 ℃,分别比较酶解时间为10,20,30,40,50,60,70 min时对多糖得率的影响。
(4) 酶浓度的影响:固定酶解时间50 min、酶解pH 6.0、酶解温度 55 ℃,分别比较纤维素酶浓度为0.0%,0.5%,1.0%,1.5%,2.0%,2.5%,3.0%,3.5%,4.0%时对多糖得率的影响。
1.3.2 正交优化试验 在单因素试验的基础上,选取pH、温度、酶浓度和酶反应时间四因素的最优水平进行正交试验,对酶法提取桑叶多糖的工艺条件进行进一步优化。
1.4 桑叶多糖的纯化
参考应芝等[11]的研究,选用 Sephadex G-100 型葡聚糖凝胶为填料,以蒸馏水为流动相。准确称取100 mg桑叶粗多糖溶于5 mL蒸馏水。将样品溶液上柱,以流速为2 mL/min 洗脱,每管收集5 mL洗脱液。每管取100 μL用苯酚-硫酸法在490 nm处测定吸光度。根据每管洗脱液的多糖含量绘制洗脱曲线,合并同一洗脱峰的洗脱液,经截留分子量为3 000 Da 的超滤离心管,4 ℃、7 000 r/min离心30 min 浓缩,收集浓缩液于-40 ℃冷冻干燥后待用。
1.5 桑叶多糖总抗氧化能力的测定
参考Benjakul等[12]的方法(普鲁士蓝法)并修改如下:取1 mL不同浓度(0.2,0.4,0.6,0.8,1.0 mg/mL )桑叶总多糖溶液,依次加入2.5 mL磷酸盐缓冲液(0.2 mol/mL,pH 6.6),2.5 mL 铁氰化钾溶液 (1 g/mL)混匀,于50 ℃下孵育20 min,冷却后加入2.5 mL 三氯乙酸溶液(10 g/100 mL)混匀,从中取出 2.5 mL再加入 2.5 mL蒸馏水和 0.5 mL三氯化铁溶液 (1 mg/mL),常温下反应 20 min后于波长700 nm处测定吸光度值,多糖的总抗氧化能力与吸光度值正相关。
1.6 桑叶多糖对DPPH 自由基的清除能力
为比较纯化前后桑叶总多糖对DPPH 自由基的清除能力,根据文献[13]修改如下:分别取2 mL 不同浓度(0.05,0.10,0.15,0.20,0.25 mg/mL)的桑叶总多糖溶液,加入2 mL DPPH-乙醇溶液 (0.1 mmol/L)混匀,室温下避光孵育 30 min,并于517 nm处测定吸光度值。根据式(1)计算DPPH自由基清除率。
(1)
式中:
d——DPPH清除率,%;
Ai——测定样品的吸光度值;
Aj——采用乙醇替换DPPH-乙醇溶液时样品的吸光度值;
A0——样品被蒸馏水代替时测定的吸光度值。
根据清除率,并参照冯艳萍等[14]报道的方法计算半抑制浓度(IC50值)。
1.7 桑叶多糖对羟自由基(·OH)的清除能力
参考Feton反应的方法[15]修改如下:取0.5 mL浓度分别为0.40,0.80,1.20,1.60,2.00 mg/mL的桑叶总多糖溶液,再加入1 mL硫酸亚铁溶液(6 mmol/L), 1 mL水杨酸-乙醇溶液(6 mmol/L),1 mL 过氧化氢溶液(8.8 mmol/L)和1 mL 蒸馏水,混匀,于37 ℃下孵育30 min,测定波长510 nm处的吸光度值。根据式(2)计算羟自由基(·OH)清除率。
(2)
式中:
d——羟自由基清除率,%;
Ai——样品测定的吸光度值;
Aj——以蒸馏水代替过氧化氢溶液时测定的吸光度值;
A0——以蒸馏水代替样品时测定的吸光度值。
根据清除率,并参照冯艳萍等[18]报道的方法计算IC50值。
1.8 桑叶多糖对α-葡萄糖苷酶的抑制作用
参考Masao Hattori等[16]方法并修改如下:移取50 μL不同浓度 (0.5,1.0,1.5,2.0,2.5 mg/mL)的桑叶总多糖溶液于酶标板中,依次加入 850 μL磷酸盐缓冲液(0.1 mmol/L,pH 5.0),50 μLα-葡萄糖苷酶溶液(100 U/mL),50 μL pNPG溶液(0.011 6 mol/L)混匀。 于37 ℃下恒温孵育10 min 后,再加入4 mL碳酸钠溶液(0.1 mol/L)以终止反应,并测定波长400 nm处的吸光度值。根据式(3)计算桑叶总多糖对α-葡萄糖苷酶的抑制率。
(3)
式中:
h——α-葡萄糖苷酶抑制率,%;
Ai——样品测定的吸光度值;
Aj——以磷酸盐缓冲液代替α-葡萄糖苷酶溶液时测定的吸光度值;
A0——以磷酸盐缓冲液代替样品时测定的吸光度值。
根据抑制率,并参照冯艳萍等[18]报道的方法计算IC50值。
1.9 数据处理与统计分析
所有数据均以3个独立样本(n=3)的x±SEM表示。采用SPSS 22.0 软件进行统计分析,数据进行单因素方差分析后,使用Student's t检验进行两组之间的比较,或者使用进行Duncan检验进行多重比较。以P<0.05为差异具有统计学意义。
2 结果与分析
2.1 纤维素酶法提取单因素试验
2.1.1 pH的影响 由图1可知,当pH<6.0时,多糖得率随pH增加而显著增大,并在pH为6.0时达到最大值。但随着pH值的继续增加,得率呈下降趋势。 pH对多糖得率的影响呈单峰函数,可能是由于过高或过低的pH 值会影响酶的活性,在低pH时,过量的酸会水解多糖的糖苷键而引起多糖结构破坏,而过高的pH会破坏酶的空间结构,影响底物结合效率。当pH 值在6.0时酶活较强,使得植物细胞壁能够迅速降解,多糖更易溶出。
2.1.2 酶解温度的影响 由图2可知,当酶解温度低于55 ℃ 时,多糖得率随温度的升高而显著增加,并于55 ℃ 时达到最大。此后随着温度的升高,得率呈下降趋势。酶解温度对多糖得率的影响呈单峰函数,可能是由于温度升高时酶促反应加速,但当温度超过酶的最适温度时,造成酶活力降低,从而使得率下降。
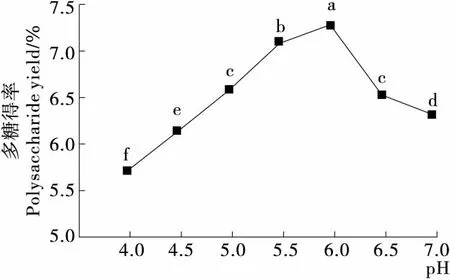
不同字母表示各组差异显著,P<0.05图1 pH对多糖得率的影响Figure 1 Effect of pH on the yield of polysaccharides
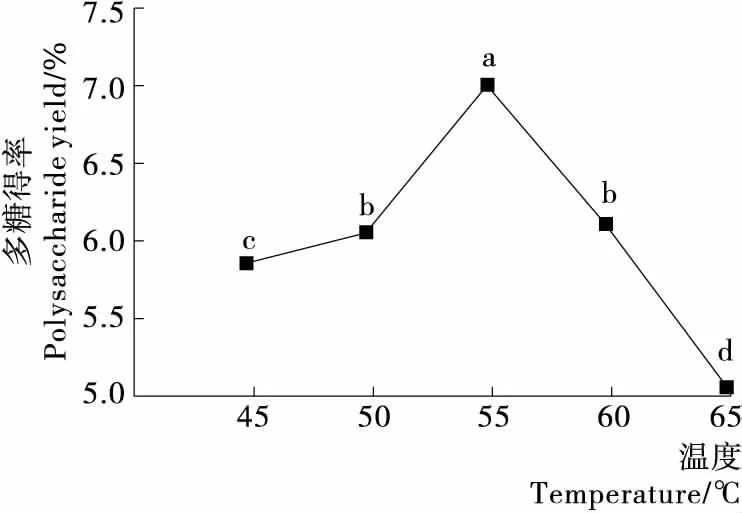
不同字母表示各组差异显著,P<0.05图2 酶解温度对多糖得率的影响Figure 2 Effect of temperature on the yield of polysaccharides
2.1.3 酶浓度的影响 由图3可知,当酶浓度低于2 mg/mL 时,多糖得率随着酶浓度的增加而显著增加,而酶浓度超过2 mg/mL后,多糖得率再无显著变化。这可能是由于随着酶量的增加,酶与底物接触机率增大,使得多糖更快地溶出。而当酶浓度升高到一定程度时,酶促反应达到饱和,使得多糖的得率不再增加。
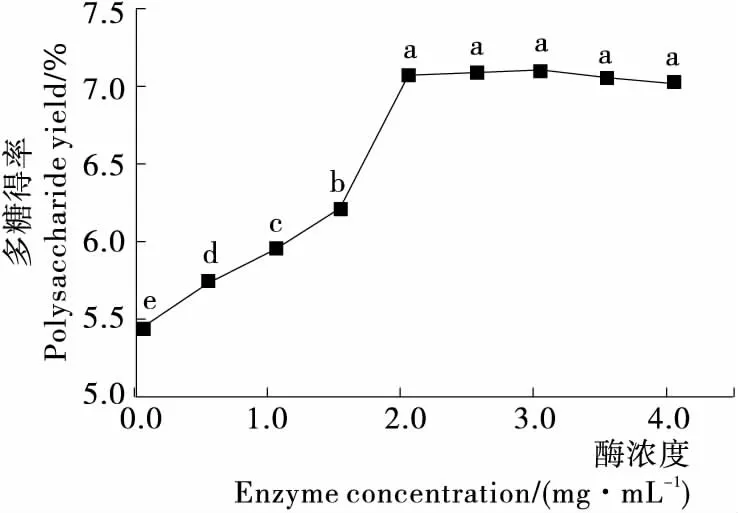
不同字母表示各组差异显著,P<0.05图3 酶浓度对多糖得率的影响Figure 3 Effect of enzyme concentration on the yield of polysaccharides
2.1.4 酶解时间的影响 由图4可知,在多糖提取的初期多糖得率随着酶解时间的延长而显著提高,酶解时间的延长有助于细胞壁的溶解和多糖的溶出。当酶解时间为50 min时,多糖得率达到最大。此后随着酶解时间继续延长,多糖得率反而显著下降。这可能是由于已溶出的多糖在反应体系中发生了破坏和降解。
2.2 纤维素酶法提取正交试验
L9(34)正交试验因素水平取值见表1,试验结果见表2。由表2可知,影响多糖得率的因素主次关系为:pH>酶解温度>酶浓度>酶解时间,最优的组合方式为A2B2C1D3,即:pH 6.0,酶解温度60 ℃,酶浓度1.0%,酶解时间50 min。采用最优组合进行验证实验(n=3),所得多糖得率为(7.608±0.043)%,说明在最优组合下具有较高的多糖得率。
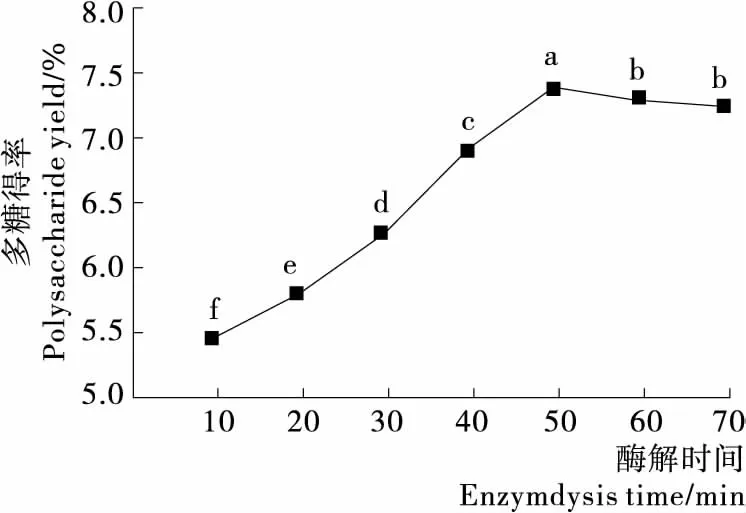
不同字母表示各组差异显著,P<0.05图4 酶解时间对多糖得率的影响Figure 4 Effect of enzymolysis time on the yield of polysaccharides

表1 酶法提取多糖正交试验因素水平表Table 1 Factors level of enzymatic extraction polysaccharide orthogonal test
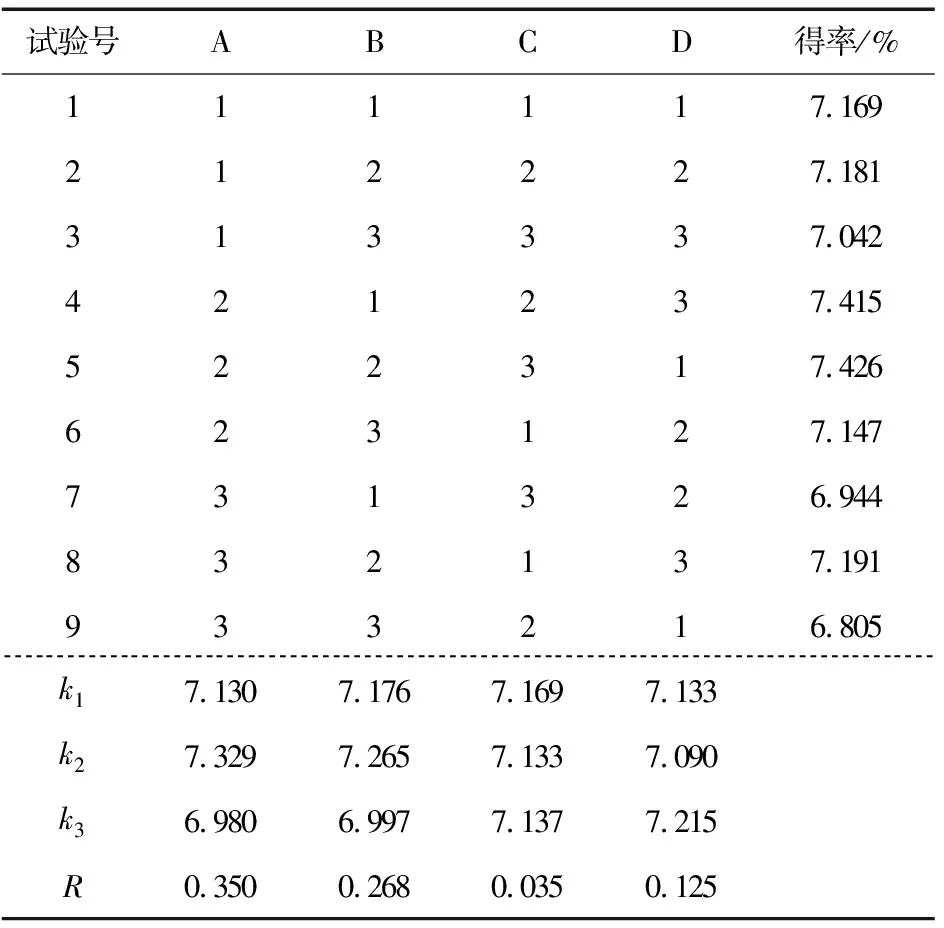
表2 L9(34)正交试验Table 2 L9(34)orthogonal experiment
2.3 桑叶多糖的纯化
由图5可知,洗脱曲线只有一个较大吸收峰,将该吸收峰下糖含量较高的第15~30管洗脱液合并,超滤浓缩并冻干后,即得纯化的桑叶总多糖样品。
虽然通过该方法只能对粗多糖进行纯化,并不能将粗多糖中各个组分分离。不过作为食品原料并不需要高纯度的单一种类多糖,且该方法简单快速,不仅多糖的回收率大于80%,同时也能有效地除去色素、蛋白等杂质。
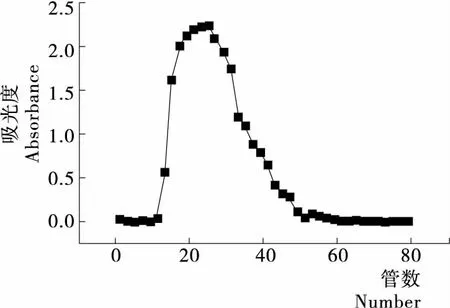
图5 桑叶多糖凝胶过滤洗脱曲线Figure 5 Gel filtration elution curves of total polysaccharide
2.4 桑叶多糖抗氧化活性比较
通过总抗氧化能力、DPPH 自由基(DPPH·)清除能力和羟自由基(·OH) 清除能力试验,对纯化前后桑叶多糖的抗氧化活性进行比较,从图6可知,桑叶总多糖在纯化前后均具有总抗氧化能力、DPPH·和·OH清除能力,且都与其浓度呈正相关,具有显著的剂量依赖效应。这可能是由于多糖的抗氧化能力是通过自身氧化提供电子从而实现自由基的清除[17],多糖浓度越高,所提供的电子数量越多,其抗氧化能力越强。
而在相同浓度下,经纯化的桑叶总多糖的总抗氧化能力、DPPH·和·OH清除能力均显著高于未经纯化的(P<0.01)。纯化前后桑叶多糖对DPPH自由基清除能力的IC50值分别为 0.54,0.11 mg/mL,纯化后提升了约5倍,对·OH清除能力的IC50值分别为24.48,8.19 mg/mL,纯化后约为纯化前的3倍。由于多糖纯度越高其抗氧化活性越强,表明多糖成分在雅津蛋白桑叶抗氧化功能中发挥着主要作用。
2.5 桑叶多糖抑制α-葡萄糖苷酶活性比较
比较纯化前后桑叶多糖对α-葡萄糖苷酶的抑制率发现,纯化前后桑叶多糖对α-葡萄糖苷酶均有明显的抑制作用,且浓度越大,抑制率越高,呈剂量依赖效应(图7),与季涛等[18]的研究一致。但在相同浓度下,经纯化的桑叶总多糖对α-葡萄糖苷酶的抑制率反而显著低于未经纯化的(P<0.01)。通过计算可知纯化前后两者的IC50值分别为 2.70,4.84 mg/mL,纯化后其抑制率仅为纯化前的0.56倍。
由于桑叶具有显著的降血糖功能[19],而α-葡萄糖苷酶作为碳水化合物代谢的关键酶[20],一直是桑叶中降糖功能成分的重要靶点之一[21-22]。已有研究[22]发现桑叶中的黄酮、生物碱类物质也具有抑制α-葡萄糖苷酶的作用,特别是其中的多羟基生物碱1-脱氧野尻霉素(DNJ)已被证明是桑叶降血糖的主要活性成分,具有极强的α-葡萄糖苷酶抑制活性。而纯化后的雅津蛋白桑叶多糖对α-葡萄糖苷酶的抑制率反而显著低于未经纯化的,暗示了纯化前的雅津蛋白桑叶粗多糖中可能含有黄酮、生物碱等其它具有更强α-葡萄糖苷酶抑制活性杂质,也表明虽然雅津蛋白桑叶总多糖也具有一定的α-葡萄糖苷酶抑制能力,但却不是雅津蛋白桑叶中发挥α-葡萄糖苷酶抑制能力的主要成分。
3 结论
采用纤维素酶法提取雅津蛋白桑叶总多糖的最佳工艺条件为:pH 6.0,酶解温度60 ℃,酶浓度1.0%,酶解时间50 min,在此条件下桑叶多糖的得率可达(7.608±0.043)%。选用 Sephadex G-100型葡聚糖凝胶为填料,以蒸馏水为流动相,进行凝胶层析,以截留分子量3 000 Da的超滤管进行浓缩,可以对雅津蛋白桑叶粗多糖进行纯化,满足其作为功能性食品原料的生产工艺要求。
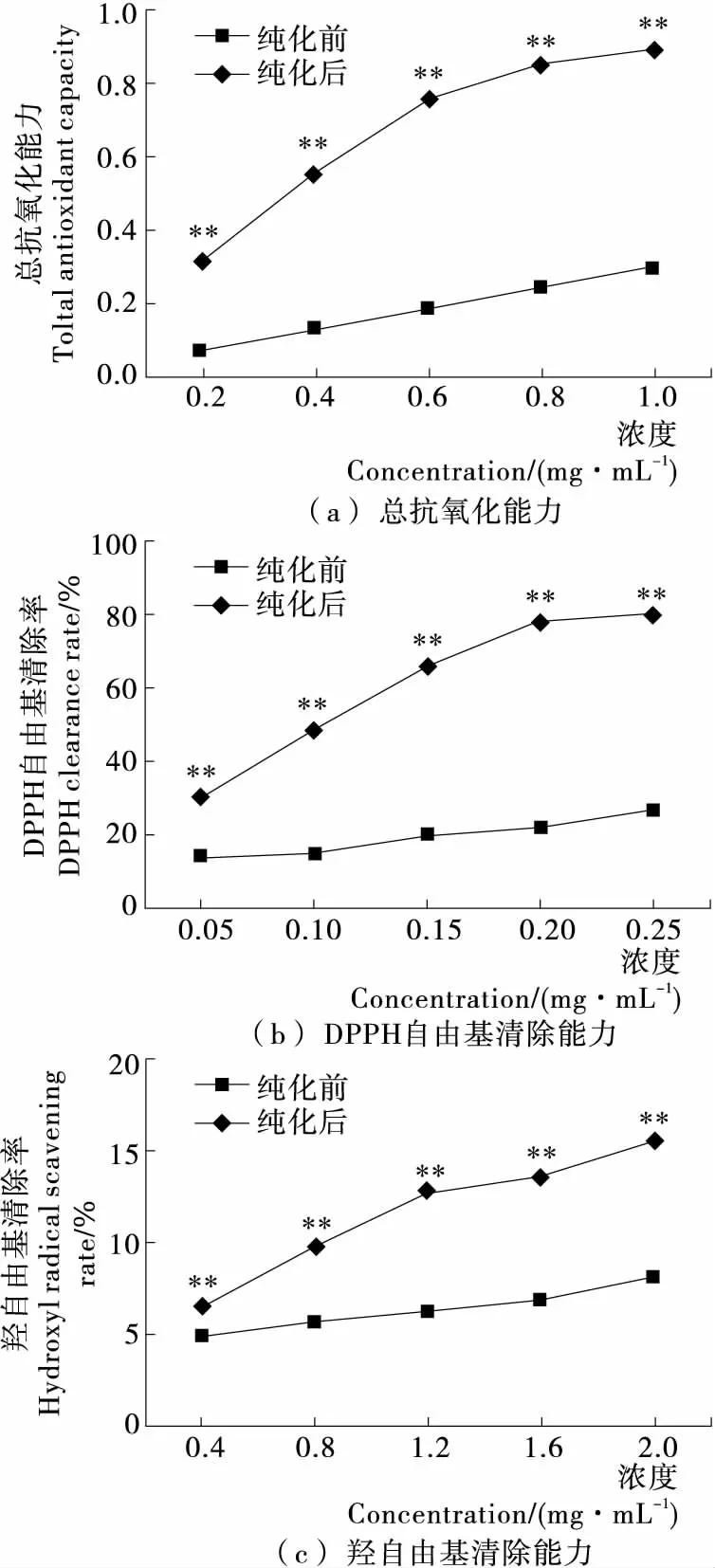
**表示与纯化前相比差异显著,P<0.01图6 纯化前后桑叶多糖的抗氧化能力Figure 6 Antioxidant capacity of different purity total polysaccharides
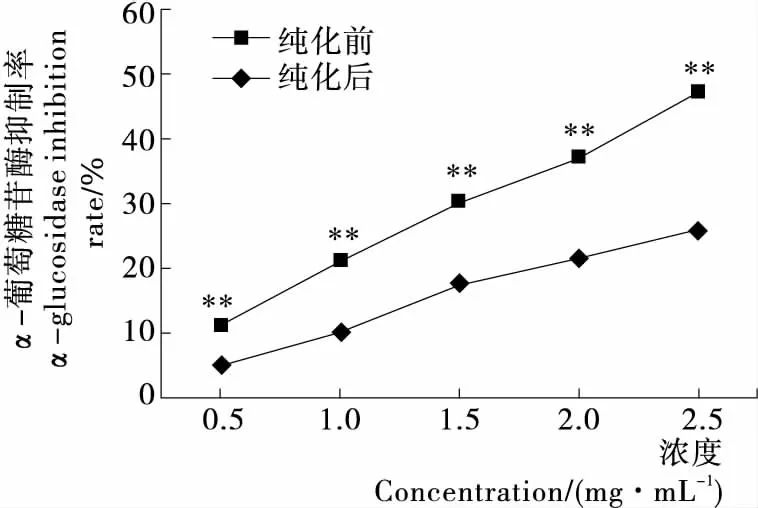
**表示与纯化后相比差异显著,P<0.01图7 纯化前后桑叶多糖对α-葡萄糖苷酶的抑制能力
Figure 7α-glucosidase inhibition rate of different purity mulberry (MorusalbaL.) leavestotal polysaccharides
经过纯化的雅津蛋白桑叶总多糖在总抗氧化能力、DPPH·和·OH清除率方面,均显著高于未经纯化的,表明在桑叶中发挥抗氧化功能的主要成分为多糖。而经过纯化的桑叶总多糖对a-葡萄糖苷酶的抑制能力要弱于未经纯化的,表明多糖并非雅津蛋白桑叶中发挥a-葡萄糖苷酶抑制功能的主要成分。
[1] 国家药典委员会. 中华人民共和国药典: 第一部[M]. 2010版. 北京: 中国医药科技出版社, 2010: 279-280.
[2] WANG Fang, LI Jian-rong, JIANG Yue-ming. Polysaccharides from mulberry leaf in relation to their antioxidant activity and antibacterial ability[J]. Journal of Food Process Engineering, 2010, 33(1): 39-50.
[3] YUAN Qing-xia, XIE Yu-feng, WANG Wei, et al. Extraction optimization, characterization and antioxidant activity in vitro of polysaccharides from mulberry (Morus alba L.) leaves[J]. Carbohydrate Polymers, 2015, 128: 52-62.
[4] 吴洪丽, 郝瑜, 周洪英, 等. 饲料桑开发应用与研究进展[J]. 北方蚕业, 2017(3): 1-5.
[5] ZHANG Dong-yang, WAN Yi, XU Jian-yi, et al. Ultrasound extraction of polysaccharides from mulberry leaves and their effect on enhancing antioxidant activity[J]. Carbohydrate Polymers, 2016, 137: 473-479.
[6] CHEN Ming, ZHAO Jing, XIA Li-ming. Enzymatic hydrolysis of maize straw polysaccharides for the production of reducing sugars[J]. Carbohydrate Polymers, 2008, 71(3): 411-415.
[7] REN Chun-jun, ZHANG Yao, CUI Wei-zheng, et al. A polysaccharide extract of mulberry leaf ameliorates hepatic glucose metabolism and insulin signaling in rats with type 2 diabetes induced by high fat-diet and streptozotocin[J]. International Journal of Biological Macromolecules, 2015, 72: 951-959.
[8] ZHANG Yao, RED Chun-jiu, LU Guo-bing, et al. Purification, characterization and anti-diabetic activity of a polysaccharide from mulberry leaf[J]. Regulatory Toxicology and Pharmacology, 2014, 70(3): 687-695.
[9] 张惟杰. 复合多糖生化研究技术[M]. 2版. 上海: 上海科技出版社, 1987: 6-7.
[10] 周小楠, 董群. 正交试验优化酶法提取金银花多糖[J]. 食品科学, 2012, 33(22): 119-122.
[11] 应芝. 桑叶多糖提取分离、结构鉴定及其降血糖活性的初步研究[D]. 杭州: 浙江工商大学, 2009: 43-51.
[12] BENJAKUL S, LERTITTIKUL W, BAUER F. Antioxidant activity of Maillard reaction products from a porcine plasma protein-sugar model system[J]. Food Chemistry, 2005, 93(2): 189-196.
[13] DUAN Xiao-juan, ZHANG Wei-wei, LI Xiao-ming, et al. Evaluation of antioxidant property of extract and fractions Obtained from a red alga, Polysiphonia urceolata[J]. Food Chemistry, 2006, 95(1): 37-43.
[14] 冯艳萍, 张全, 王萃. 马拉氧磷和异马拉硫磷对乙酰胆碱酯酶联合抑制作用[J]. 浙江工业大学学报, 2011, 39(2): 131-135.
[15] BASSAM Amro, TALAL Aburjai, SAMIR Al-Khalil. Antioxidative and radical scavenging effects of olive cake extract[J]. Fitoterapia, 2002, 73(6): 456-461.
[16] MAO Zhu-xin, MASAO Hattori, MOHSEN Daneshtalab, et al. Chlorogenic acid derivatives with alkyl chains of different lengths and orientations: potent α-glucosidase inhibitors[J]. J Med Che, 2008, 51(19): 6 188-6 194.
[17] 程知庆, 沈和定, 姚理想, 等. 干燥方法对瘤背石磺多糖抗氧化性和还原力的影响[J]. 食品与机械, 2015, 31(6): 169-172.
[18] 季涛, 宿树兰, 郭盛等. 基于α-葡萄糖苷酶抑制活性评价桑叶多组分药效相互作用研究[J]. 中国中药杂志, 2016, 41(11): 1 999-2 006.
[19] 邹宇晓, 瘳森泰, 刘学铭, 等. 桑叶资源治疗糖尿病研究[J]. 天然产物研究与开发, 2004, 16(3): 265-268.
[20] PATEL S S. Cerebrovascular complications of diabetes:α-glucosidase inhibitor as potential therapy[J]. Horm Metab Res, 2015, 48(2): 83-91.
[21] HAMADA Y, NAGASAKI H, FUCHIGAMI M, et al. Theα-glucosidase inhibitor miglitol affects bile acid metabolism and amelioratesobesity and insulin resistance in diabeticmic[J]. Metabolism, 2013, 62(5): 734-742.
[22] KAZUHISA Yatsunami, MASATOSHI Ichida, SATOSHI Onodera. The relationship between 1-deoxynojirimycin content andα-glucosidase inhibitory activity in leaves of 276 mulberry cultivars (Morus spp.) in Kyoto, Japan[J]. Journal of Natural Medicines, 2008, 62(1): 63-66.

