两株乳酸菌对铅的吸附作用
徐 颖XU Ying 李 洁 贺丹丹 - 吕嘉枥 -
(陕西科技大学食品与生物工程学院,陕西 西安 710021)
近年来,重金属污染引起的食品安全问题已成为人们广泛关注的热点,食品中重金属主要来源于工业“三废”和生活垃圾等污染,受污染食品主要包括粮食、果蔬和水产品等。2013年,中国受重金属污染的耕地面积近2.0×107hm2,约占耕地总面积的20%,被重金属污染的粮食多达1.20×107t,合计损失至少200亿元[1],解决重金属污染的问题非常迫切。但重金属污染具有分布范围广、不可降解、治理难度大、危害程度深等特点,传统去除方法主要有物理和化学修复法,包括反渗透法、萃取法、活性炭吸附法、过滤法、化学沉淀法、絮凝法和离子交换法[2-3]。这些方法存在着一些缺点,如仪器设备昂贵、无法实现自动监控、试剂和能源损耗巨大、各种废弃物的产生造成二次污染等,而且这些方法用于治理低浓度废水时效果不好,不能使金属浓度降到排放标准以下。微生物吸附法是一种新兴的高效、环保、经济的重金属污染治理方法,乳酸菌通过菌体表面吸附和体内蓄积作用可有效清除有毒重金属,如干酪乳杆菌(Lactobacilluscasei)DSM20011[4]、鼠李糖乳杆菌(Lactobacillusrhamnosus)GG[5]、粪肠球菌(Enterococcusfaecium)M74[6]、罗伊氏乳杆菌(Lactobacillusreuteri)Pb71-1[7]、植物乳杆菌(Lactobacillusplantarum)CCFM8661[8]、德氏乳杆菌(Lactobacillusdelbrueckii)KLDS1.0207[9]等。乳酸菌作为潜在的重金属生物清除剂具有较高的研究与应用价值。
但关于去除重金属活性乳酸菌的筛选、去除机制和应用方面的研究较少。本研究拟通过分析乳酸菌对铅的吸附作用,判断乳酸菌对铅的耐受性及吸附程度,利用热力学模型和动力学模型对乳酸菌结合铅离子的过程进行模拟,研究乳酸菌对铅的吸附能力,为利用乳酸菌清除食品中重金属研究与应用提供理论依据。
1 材料与方法
1.1 材料与试剂
双歧杆菌(Bifidobacteria,BB)、鼠李糖乳杆菌(Lactobacillusrhamnosus,LR):由陕西科技大学微生物实验室提供;
MRS培养基:北京奥博星生物技术有限责任公司;
其他试剂均为分析纯。
1.2 仪器
恒温振荡摇瓶柜:HYG-A型,苏州培英实验设备有限公司;
分光光度计:722E型,上海光谱仪器有限公司;
压盖型冷冻干燥机:SCIENTZ-18N型,新芝冻干设备公司。
1.3 方法
1.3.1 乳酸菌的耐铅试验 在无菌条件下,配制1 g/L铅离子溶液,用该铅离子溶液溶解MRS肉汤培养基,分别得到含50,150,500 mg/L铅离子的MRS液体培养基。将培养到第三代至对数期的菌液用生理盐水稀释,调整OD600 nm为0.60,即得到种子液,按照2%接种量接种于上述含铅MRS液体培养基中,在37 ℃条件下进行培养,分别在0,2,4,6,8,12,16,20,24 h时取样,进行乳酸菌计数,以确定乳酸菌对不同浓度铅离子的耐受力[10]。
1.3.2 铅含量的测定 二硫腙比色法[11]。
1.3.3 乳酸菌对铅的吸附特性 取菌液0.2 mL接种到MRS培养基中,于37 ℃培养18 h,4 000 r/min离心20 min,弃上清液,湿菌备用。
(1) pH值对吸附的影响:将50 mg/L铅离子溶液分装至锥形瓶中,每瓶20 mL,用0.1 mol/L盐酸或氢氧化钠调节pH至2,3,4,5,6,7,加入湿菌体,使其浓度为1 g/L,并在30 ℃、150 r/min的摇床中吸附1 h,将溶液以8 000 r/min 离心10 min,测定上清液中的铅含量。按式(1)计算菌体对铅的吸附量。
(1)
式中:
q——菌体吸附量,mg/g;
C0——初始铅离子浓度,mg/L;
C1——平衡液中铅离子浓度,mg/L;
V——铅离子溶液的体积,L;
m——湿菌体的质量,g。
(2) 初始铅离子浓度对吸附的影响:铅离子溶液浓度分别为25,50,75,100,150,300,500 mg/L,pH调为 6,其他操作与1.3.3(1)相同。
(3) 初始湿菌添加量对吸附的影响:向20 mL、50 mg/L铅离子溶液中加入湿菌体,使其浓度分别为1,2,3,4,5,6,7 g/L,pH调为 6,其他操作与1.3.3(1)相同。
1.3.4 吸附热力学试验 配制10,20,30,40,50 mg/L铅离子溶液,pH调为6。将收集到的菌体分别置于不同铅离子浓度溶液中,使菌体浓度达到1 g/L(湿菌体重),37 ℃条件下振荡吸附1 h,8 000 r/min离心10 min,取上清测铅离子浓度。按式(1)计算吸附量。
1.3.5 吸附动力学试验 选取pH值为6,初始铅离子浓度为50 mg/L,湿菌体浓度为1 g/L来探究铅吸附的动力学规律。30 ℃,150 r/min分别培养5,10,15,20,25,30,35,40,45,50,55,60 min后取出,将溶液以8 000 r/min离心10 min,测定上清液中的铅含量[12]35-36。按式(1)计算吸附量。
1.3.6 热力学分析
(1) Langmuir模型分析:该模型假设吸附剂表面的吸附位点是均匀的,金属吸附于表面单分子层,每个吸附位点对应一个金属离子,是以化学吸附为主的,吸附和解吸是动态平衡。Langmuir 模型见式(2)。
(2)
式中:
qe——平衡时菌体吸附量,mg/g;
qm——最大吸附量,mg/g;
Ce——平衡液中铅离子浓度,mg/L;
b——吸附系数,L/mg。
(2) Freundlich模型分析:该模型假设的是吸附发生在非均匀介质表面,Freundlich模型见式(3)。
(3)
式中:
qe——平衡时菌体吸附量,mg/g;
Ce——平衡液中铅离子浓度,mg/L;
k——吸附平衡常数。
(3) Langmuir-Freundlich模型分析:Langmuir-Freundl-ich模型见式(4)。
(4)
式中:
qe——平衡时菌体吸附量,mg/g;
Ce——平衡液中铅离子浓度,mg/L;
k——吸附平衡常数;
b——不均匀吸附常数。
1.3.7 动力学分析
(1) 准一级动力学模型分析:准一级动力学模型见式(5)。
(5)
式中:
qe——平衡时菌体吸附量,mg/g;
qt——t时刻菌体吸附量,mg/g;
k1——吸附平衡常数。
(2) 准二级动力学模型分析:准二级动力学模型见式(6)。
(6)
式中:
qe——平衡时菌体吸附量,mg/g;
qt——t时刻菌体吸附量,mg/g;
k2——吸附平衡常数。
2 结果分析
2.1 乳酸菌对铅的耐受性
如图1所示,铅离子浓度由50 mg/L增加到500 mg/L,双歧杆菌和鼠李糖杆菌的生长虽然受到一定抑制,但仍能生长。如当铅离子浓度为50 mg/L时,培养24 h其生物量分别为对照的71.4%和64.3%。当铅离子浓度达到500 mg/L时,培养24 h其生物量分别为对照的35.7%和21.4%。根据《地表水环境质量标准》(GB 3838—2002),Ⅴ类水中铅的含量要求<0.1 mg/L,可见50 mg/L这个浓度较大,这两株菌的耐铅能力较好,以此浓度进行后续试验。
2.2 乳酸菌对铅的吸附特性
2.2.1 pH值对吸附的影响 初始pH值对双歧杆菌和鼠李糖乳杆菌吸附铅能力的影响见图2。铅溶液初始pH值由2增加到7,双歧杆菌对铅离子吸附量由45.25 mg/g增加到48.67 mg/g,鼠李糖乳杆菌对铅离子吸附量由43.67 mg/g增加到44.71 mg/g。在pH为6~7时达到最大吸附值。初始pH值是影响微生物吸附重金属的重要因素之一。pH值影响菌体表面官能团(氨基、羧基、磷酸基)的活力及铅离子对结合位点的竞争力。当溶液pH值很低时,[H3O]+会占据生物细胞表面大量的活性吸附位点,阻止阳离子与这些吸附位点的结合,因此过酸的环境导致微生物对铅离子的排斥力越大,吸附量下降。随着溶液中pH值的升高,细胞表面暴露出更多的负电荷,有利于铅接触并吸附在细胞表面活性位点上。当pH值过高,达到铅离子的溶度积Ksp值后,会生成氢氧化铅沉淀,无法体现生物吸附作用对铅的去除效果,因此本试验不考虑pH值超过7的吸附情况。
2.2.2 初始铅离子浓度对吸附的影响 由图3可知,当铅离子浓度在25~500 mg/L时,随着铅离子浓度的增加,双歧杆菌对铅离子的吸附量由24.29 mg/g增加到109.57 mg/g,鼠李糖乳杆菌对铅离子吸附量由21.86 mg/g增加到112.71 mg/g。但当铅离子浓度超过100 mg/L时,吸附量基本保持不变。可能是铅离子超过菌体的结合位点,达到菌体的吸附极限,因此吸附量基本不变。
2.2.3 初始湿菌量对吸附的影响 由图4可知,在20 mL、50 mg/L 铅离子溶液中,初始湿菌量由0.02 g增加到0.14 g,双歧杆菌和鼠李糖杆乳杆菌对铅的吸附量分别由48.75,49.36 mg/g降低到45.08,43.85 mg/g。原因可能是初始湿菌量过高时,菌体会相互吸附成团,造成结合位点减少,进而吸附率降低[13];菌体向细胞外分泌酸性物质,会改变吸附体系pH值,从而改变菌体表面的物化性质,并进一步减弱菌体对铅的吸附能力。这与嗜麦芽窄食单胞菌对铜、镉的吸附特性[14]以及嗜酸乳杆菌和罗伊氏乳杆菌对铜结合性能[15]相一致。
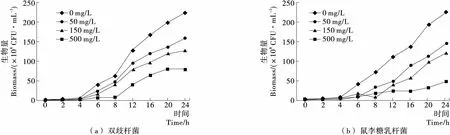
图1 两株乳酸菌在含铅培养基中的生长曲线Figure 1 Growth curves of two strains of Lactobacillus in lead-containing medium
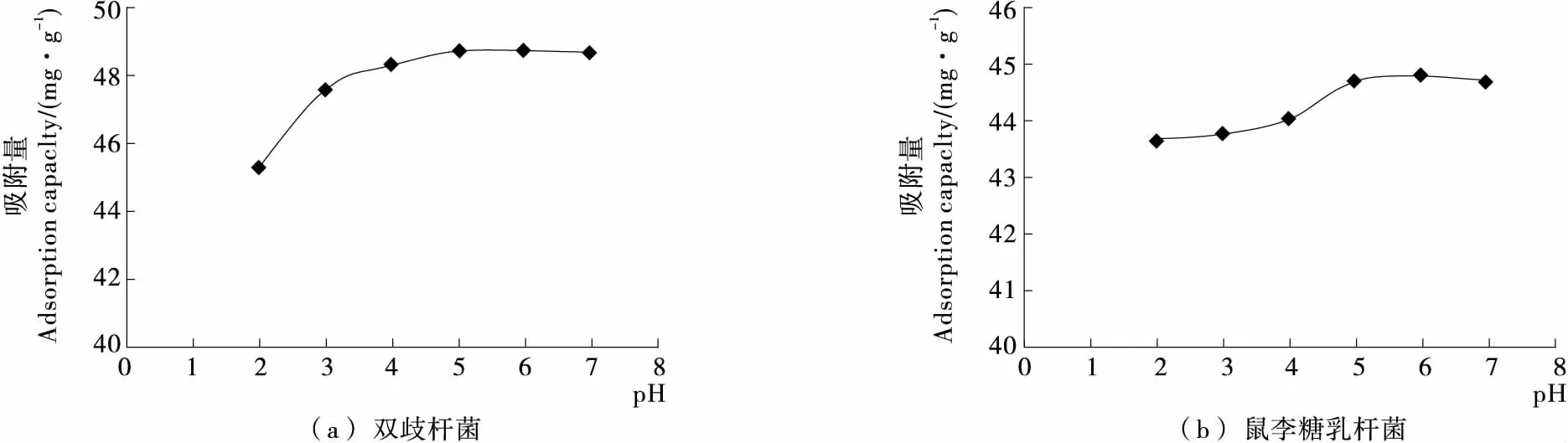
图2 初始pH值对两株乳酸菌吸附铅能力的影响Figure 2 Effect of initial pH on adsorption of lead in two strains of Lactobacillus
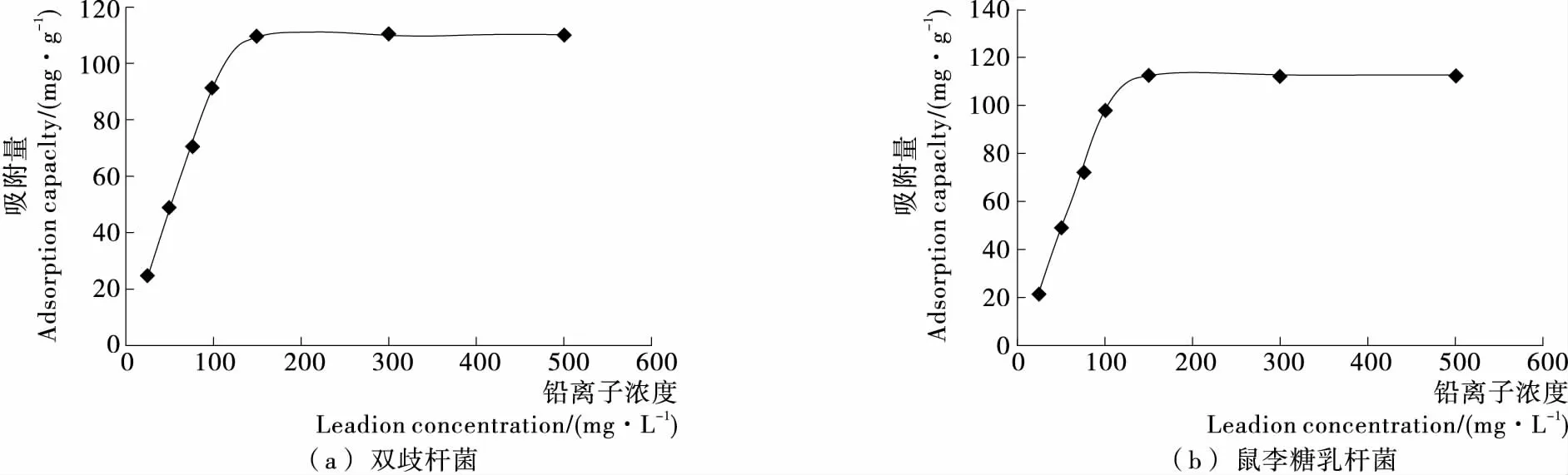
图3 初始铅离子浓度对两株乳酸菌吸附铅能力的影响Figure 3 Effect of lead ion concentration on adsorption of lead in two strains of Lactobacillus
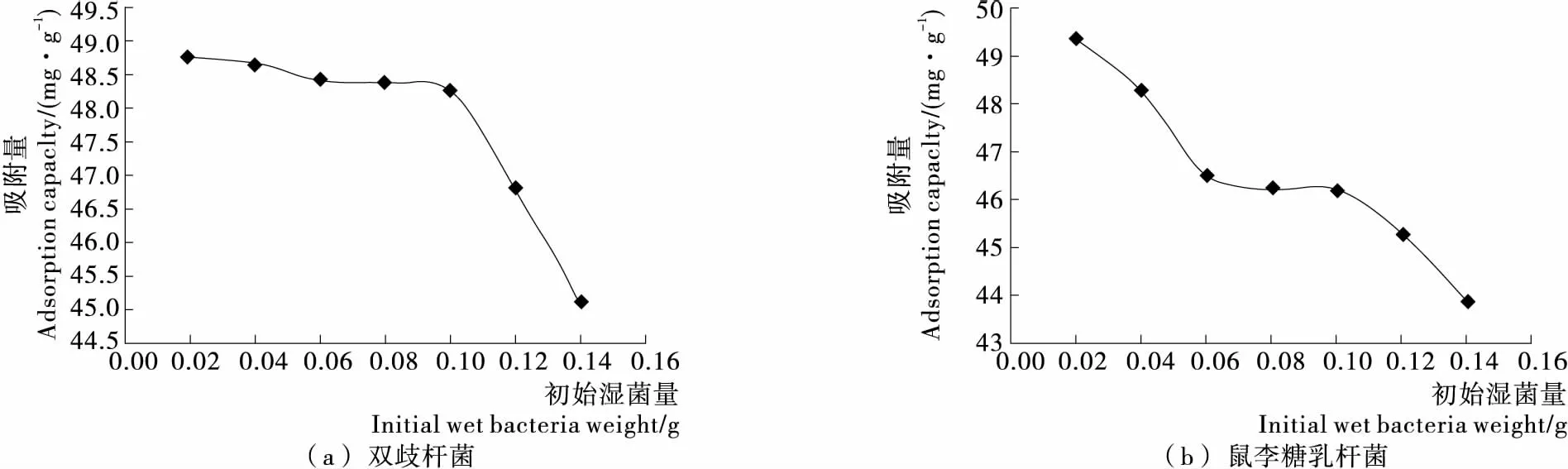
图4 初始湿菌添加量对两株乳酸菌吸附铅能力的影响Figure 4 Effect of initial wet bacteria weight on adsorption of lead in two strains of Lactobacillus
2.3 热力学分析
将Langmuir公式[式(2)]变形,以1/qe为纵坐标,1/ce为横坐标,作图拟合得出双歧杆菌qmax为42.86 mg/g,b为0.086,R2为0.972 9,但拟合结果和实际值48.76 mg/g相差较大;鼠李糖乳杆菌qmax为43.31 mg/g,b为0.085,R2为0.975 8,拟合结果和实际值48.14 mg/g相差也较大。说明两株菌吸附铅过程中的吸附位点是不均匀的,也不是单分子层吸附。
将Freundlich公式[式(3)]变形,以lnqe为纵坐标,lnce为横坐标,作图拟合得出双歧杆菌k为2.473,n为0.398,R2为0.837 4;鼠李糖乳杆菌k为2.364,n为0.406,R2为0.838 4。
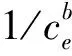
2.4 动力学模型分析
将准一级模型[见式(5)]和准二级模型[见式(6)]作图拟合得出,准一级模型适合吸附过程的前30 min,而不适合整个吸附过程,这主要是由于微生物对重金属的吸附属于被动吸收[17],而不是主动运输,因此吸附速度较快。前30 min的拟合相关系数R2分别达0.892 7和0.879 0。准二级动力学模型中,两株菌的R2均为0.999 8,说明准二级动力学模型比准一级动力学模型更适合表征菌体吸附铅离子的过程,且该过程不是单纯的物理吸附,存在其他的离子交换、化学沉淀等现象。乳酸菌细胞壁上有带大量负电荷官能团的肽聚糖和磷壁酸聚合物,因此它们有很强的吸收金属阳离子的能力。Teemu 等[18]研究发现带有负电荷的磷酰基、羧基具有结合铅、镉离子的能力。此外,许多乳酸杆菌中的表面蛋白质以 S-layer 蛋白质[12]19为主,其官能团一般带负电荷,可以与阳离子发生沉淀。
3 结论
本试验对双歧杆菌和鼠李糖乳杆菌耐铅能力和吸附铅的特性进行研究,初始铅离子浓度为50 mg/L条件下其吸附铅的最佳条件:pH值6,初始湿菌量1 g/L,此时两株菌对铅的吸附率分别为97.44%和96.87%;Langmuir-Freundlich模型比Langmuir模型和Freundlich模型更适合两株菌结合铅离子的过程,准二级动力学模型比准一级动力学模型更适合,说明两株菌与铅的作用包括物理吸附和化学吸附。
[1] 毛雪飞, 徐亚平, 王敏, 等. 国内外粮食产品重金属污染监测对比与分析[J]. 农产品质量与安全, 2014(6): 7-11.
[2] 马欢欢, 白凤翎, 励建荣. 乳酸菌吸附作用清除食品中有毒重金属研究进展[J]. 食品科学, 2017, 38(11): 301-307.
[3] ABBAS S H, ISMAIL I M, MOSTAFA T M, et al. Biosorption of Heavy Metals: A Review[J]. Journal of Chemical Science & Technology, 2014, 3(4): 74-102.
[4] HALTTUNEN T, FINELL M, SALMINEN S. Arsenic removal by native and chemically modified lactic acid bacteria[J]. Intionational Journal of Food Microbiology, 2007, 120(1/2): 173-178.
[5] HALTTUNEN T, COLLADO M C, EI-NEZAMI H, et al. Combining strains of lactic acid bacteria may reduce their toxin and heavy metal removal efficiency from aqueous solution[J]. Letters in Applied Microbiology, 2008, 46(2): 160-165.
[6] TOPCU A, BULAT T. Removal of cadmium and lead from aqueous solution byEnterococcusfaeciumstrains[J]. Journal of Food Science, 2010, 75(1): 13-17.
[7] BHAKTA J N, OHNISHI K, MUNEKAGE Y. Characteriz-ation of lactic acid bacteria-based probiotics as potential heavy metal sorbents[J]. Journal of Applied Microbiology, 2012, 112(6): 1 193-1 206.
[8] TIAN Feng-wei, ZHAI Qi-xiao, ZHAO Jian-xin, et al.LactobacillusplantarumCCFM8661 alleviates lead toxicity in mice[J]. Biological Trace Element Research,2012, 150(1/2/3): 264-271.
[9] 于上富, 靳妲, 丁秀云, 等. 德氏乳杆菌吸附铅离子的机制研究[J]. 食品工业科技, 2016, 37(22): 116-125.
[10] 田丰伟. 缓解氧化应激乳酸菌的筛选、表征和功能评价研究[D]. 无锡: 江南大学, 2012: 48-49.
[11] 中华人民共和国国家卫生和计划生育委员会, 国家食品药品监督管理总局. GB 5009.12—2017 食品安全国家标准 食品中铅的测定[S]. 北京: 中国标准出版社, 2017: 6-9.
[12] 熊婧. 乳酸菌对重金属镉的耐受性和吸附机制研究[D]. 广州: 暨南大学, 2015.
[13] CABUK A, AKAR T, TUNALI S, et al. Biosorption of Pb(II) by industrial strain of Saccharomyces cerevisiae immobilized on the biomatrix of cone biomass ofPinusnigra: equilibrium and mechanism analysis[J]. Chemical Engineering Journal, 2007, 131: 293-300.
[14] 白洁琼, 尹华, 叶锦韶, 等. 嗜麦芽窄食单胞菌对铜镉的吸附特性与离子交换[J]. 环境科学, 2013, 34(1): 217-225.
[15] 倪奕弘. 耐受重金属铜的乳酸菌的筛选及其铜结合性能的研究[D]. 广州: 暨南大学, 2014: 40-41.
[16] 史广宇, 程媛媛, 史绮, 等. 铜绿假单胞菌对铜和铅的吸附[J]. 环境科学学报, 2017, 37(6): 2 107-2 113.
[17] 王晓伟, 姚国强, 高鹏飞, 等. 乳酸菌对重金属污染的生物修复作用[J]. 中国微生态学杂志, 2014, 26(8): 968-972.
[18] TEEMU H, SEPPO S, JUSSI M. Reversible surface binding of cadmium and lead by lactic acid bacteria and bifidobacteria[J]. Intinational Journal of Food Microbiology, 2008, 125(2): 170-175.

