精确放疗联合替莫唑胺化疗脑胶质瘤术后残留病灶近期效果观察
段军伟,唐晓平,张 涛,赵 龙,彭 华,段 劼
脑胶质瘤全称神经胶质瘤,起源于神经上皮组织,约占所有颅内肿瘤的45%,初发时期无明显症状,容易被患者忽视,随着肿瘤增大,压迫颅内其他组织,表现为颅内压增高及脑组织受压的临床症状及体征,自出现症状至就诊时间为数周、数月,部分患者长达数年[1-2]。根据WHO制定,胶质瘤分为I~IV级,III~IV级为恶性胶质瘤,约占胶质瘤的77.5%[3];因恶性脑胶质瘤呈浸润性增长,手术难以完全切除,具有较高的复发率,预后差,5年生存率<10%[4]。目前临床主要采用调强放疗(IMRT),在每次照射剂量上存在一定差异,以保证肿瘤与正常组织之间形成梯度,在后期放疗中对正常组织产生一定的保护性,预防肿瘤的复发。虽然术后联合放疗可降低脑胶质瘤复发率,但部分高度恶性脑胶质瘤预后仍较差[5]。本研究采用放疗联合替莫唑胺联合治疗恶性脑胶质瘤。现报告如下。
1 资料与方法
1.1一般资料 选取2011年3月—2014年2月川北医学院附属医院神经外科收治的行手术切除的脑胶质瘤120例,据术后是否使用替莫唑胺分为联合组67例与放疗组53例。纳入标准:①手术病理确诊恶性脑胶质瘤(III~IV级);②手术方案为肿瘤全切或部分切除;③入组前未接受其他放疗或化疗;④全身功能状态评分(ECOG)0~3分;血常规:白细胞≥4.0×109/L,中性粒细胞≥2.0×109/L,血红蛋白≥100 g/L,血小板计数≥100×109/L。排除标准:①复发胶质瘤;②仅行病灶活检术者;③临床资料不完整者;④预期生存期<6个月。放疗组男30例,女23例;年龄45~78(61.4±7.3)岁;肿瘤位置:额叶22例,颞叶14例,顶叶7例,枕叶6例,其他4例;肿瘤体积4.2~8.7(6.3±1.4)cm3;卡氏行为状态(KPS)评分[6]44~85(68.7±6.4)分;术式:神经导航术32例,传统大骨瓣开颅术17例,显微镜下切除术4例;切除范围:全切37例,次切16例;术后等待放疗时间25~127(36.4±7.3)d。联合组男39例,女28例;年龄42~75(63.5±8.4)岁;肿瘤位置:额叶28例,颞叶17例,顶叶10例,枕叶7例,其他5例;肿瘤体积4.5~8.2 cm(6.5±1.2)cm3;KPS评分41~83(70.5±6.8)分;术式:神经导航术38例,传统大骨瓣开颅术22例,显微镜下切除术7例;切除范围:全切45例,次切22例;术后等待放疗时间20~131(34.7±6.8)d;术后等待放疗时间23~129(37.2±7.5)d。两组一般资料比较差异无统计学意义(P>0.05),有可比性。
1.2治疗方法 两组均给予同期推量调强放疗:①面罩制作:仰卧位,双手置于躯干两侧,将热塑面膜放于60℃~70 ℃的水箱软化,沥干后固定其头部,待冷却后即制成个体化面膜。②扫描:患者继续保持原有体位,采用64排CT(西门子Biograph64)增强扫描,扫描范围从头顶至下颌下缘,层厚设置、水平间距均设置4 mm,并将成像传至Philips Pinnacle治疗计划系统进行CT三维图像重建,根据国际辐射单位与测量委员会(ICRU)50号和62号文件标准定义并勾画靶区及危险器官。③放射剂量选择:临床靶体积(CTV)包括肿瘤靶体积(GTV)外放2.0~2.5 cm及肿瘤旁水肿区;计划靶体积(PTV)为GTV、CTV各外放0.5 cm。高危CTV1表示GTV或(和)术腔外放1.0 cm;低危CTV2表示GTV或(和)术腔外放2.0~3.0 cm;GTV、CTV1、CTV2均表示外扩3 cm分别定义为PGTV、PTV1、PTV2,依据最大幅度降低重要组织和器官的放射剂量,取最适宜放疗方案,分割剂量为GTV-P,每次2.0~2.2 Gy,1次/d,每周5次,总剂量60 Gy/30~33次。4周为1个疗程,共治疗1个疗程。
联合组放疗同期加替莫唑胺辅助化疗:放疗第1 d开始给予替莫唑胺(芬兰,Schering-Plough Europe,注册证号:H20120419)75 mg/(m2·d),空腹口服至放疗结束;并于放疗结束后第4周开始进行4~6周辅助化疗,替莫唑胺150 mg/(m2·d),连续口服5 d后暂停23 d,每28 d为1个周期;后续治疗根据患者耐受情况,如中性粒细胞数≥1.5×109/L,血小板≥100×109/L,则下周期剂量酌情调整剂量至200 mg/(m2·d)。最少治疗2个周期,最多6个周期。两组治疗期间根据病情给予地塞米松或甘露醇脱水降颅压,口服抗癫痫药物预防癫痫发作。治疗期间每周监测血常规,每2周复查肝肾功能。
1.3观察指标及方法 治疗期间,每月复诊1次进行神经学、临床评价,每周行血常规检查,于放化疗开始的第3周复查肝肾功能,根据治疗药物的毒性反应调整用药,总体生存率自放疗开始时计算。疗程结束后以电话、门诊随访结合方式为期3年的随访。治疗前后采用简明SF-36生活质量量表[7]评估生活质量,包括生理功能(PF)、总体健康(TH)、躯体疼痛(BP)、生理职能(RP)、精神健康(MH)、活力(VT)、情感职能(RE)及社会功能(SF)8个维度,本研究着重评价PF、RP、RE、SF 4个维度。
1.4疗效评价 在所有疗程结束后持续1~3个月观察肿瘤缓解情况,以第3个月检查结果为准;近期疗效评价参照WHO制定的标准,完全缓解(CR):影像学检查显示肿瘤病灶消失,持续1个月以上复查均未出现新病灶;部分缓解(PR):肿瘤体积缩小≥50%,持续1个月以上复查均未出现新病灶;稳定(SD):肿瘤体积缩小<50%或增大<25%;病变进展(PD):肿瘤增大>25%或出现新的病灶。总共有效率(RR)=(CR+PR)/病例数×100%,疾病控制率(DCR)=(CR+PR+SD)/病例数×100%。

2 结果
2.1两组近期疗效比较 联合组RR、DCR均显著高于放疗组(P<0.05)。见表1。
2.2两组不良反应比较 治疗期间两组均出现不同程度的不良反应,粒细胞缺乏、贫血、骨髓抑制及胃肠道反应等不良反应发生率,比较差异均无统计学意义(P>0.05)。见表2。
2.3两组生活质量比较 两组PF、RP、RE、SF评分均明显高于治疗前,且联合组RP、RE及总分均显著高于放疗组(P<0.05)。见表3。
2.4两组远期疗效比较 联合组中位无复发生存时间29.2(13.4,35.1)个月,放疗组19.7(6.7,34.8)个月;联合组中位生存时间24(13.6,35.8)个月,放疗组17(8.5,35.5)个月;联合组第1、2年生存率均显著高于放疗组(P<0.05);两组半年生存率、3年生存率比较差异无统计学意义(P>0.05)。见表4。
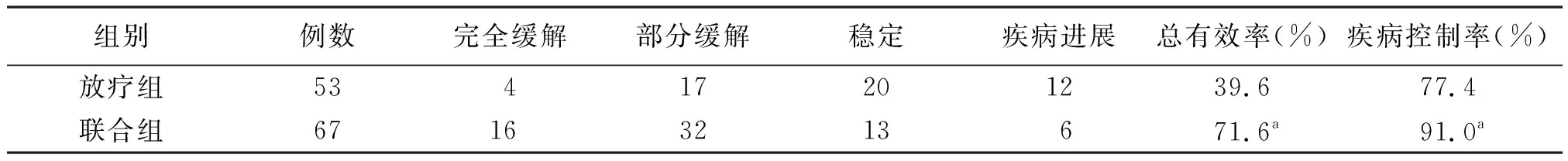
表1 两组脑胶质瘤近期疗效比较
注:联合组采用放疗同期加替莫唑胺辅助化疗,与放疗组比较,aP<0.05
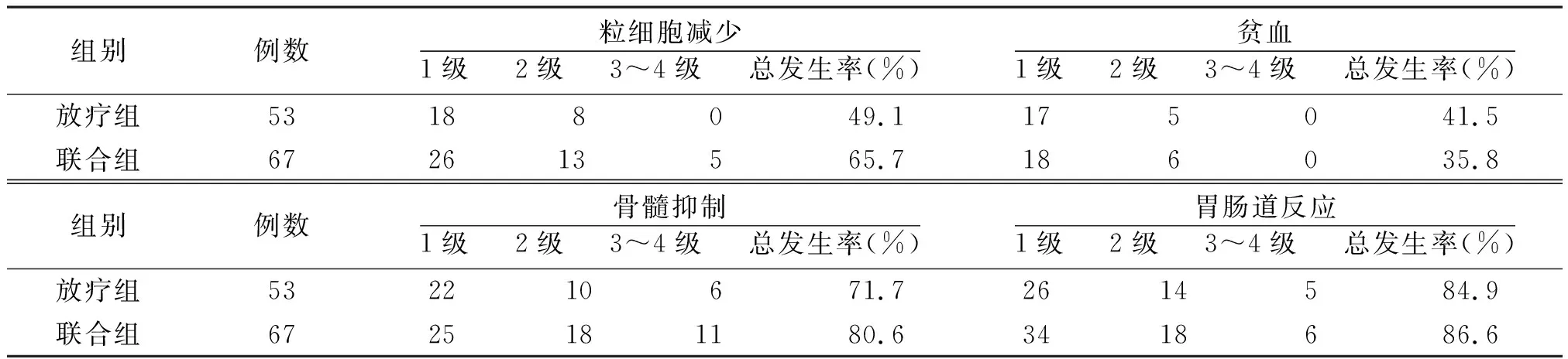
表2 两组脑胶质瘤不良反应比较
注:联合组采用放疗同期加替莫唑胺辅助化疗

表3 两组脑胶质瘤治疗前后生活质量比较分)
注:联合组采用同期放疗加替莫唑胺辅助化疗;与治疗前比较,aP<0.05;与放疗组比较,cP<0.05

表4 两组脑胶质瘤生存率比较[例(%)]
注:联合组采用放疗同期加替莫唑胺辅助化疗,与放疗组比较,aP<0.05
3 讨论
恶性脑胶质瘤主要表现为头痛、认知改变、癫痫、进行性偏瘫等;其恶性程度高、疗效差。目前临床以手术治疗为主,但因该肿瘤呈浸润性生长,手术难以完全清除;且具有原位复发的特点,90%的肿瘤在原发病灶2 cm内复发,因此术后辅以放、化疗,可抑制残留肿瘤细胞生长,降低复发率,延长患者其生存时间[8]。放疗虽可有效杀灭肿瘤细胞,但可损伤正常脑组织,需要在达到治疗目的同时减少正常脑组织接受量[9]。本研究采用2MRT放疗方案,每次对不同靶区给予不同剂量,在肿瘤区及肿瘤周围组织形成剂量梯度;从而缩短总治疗时间,提高等效生物剂量,减少了正常脑组织接受量[10]。
替莫唑胺是一种新型第二代咪唑并四嗪类具有抗肿瘤活性的烷化剂,组织分布性良好,能透过血脑屏障,直接作用在中枢神经系统肿瘤,是临床用于脑胶质瘤治疗的主要化疗药物[11]。替莫唑胺具有如下优点:①其脑脊液浓度/血浆药液浓度比例30%~40%,且肿瘤组织中的浓度显著高于正常脑组织;②无需经肝脏代谢,对器官损伤较小;③作用于肿瘤细胞的核酸、蛋白质及肽亲核区,在肿瘤细胞分类的各个时期均可发挥药效,具有广谱抗肿瘤活性。王小虎等[12]对国内外896例临床对照试验进行荟萃分析后认为,放疗联合替莫唑胺可显著提高恶性脑胶质瘤患者18、24个月总生存率,并且改善6、12、18、24个月内的无进展生存期,但是对远期疗效并无明显改善。相关文献报道,采用该治疗方式的恶性脑胶质瘤患者3年生存率为4.87%~30%,可显著改善近远期治疗效果[13-14]。本研究采用放疗联合替莫唑胺同步化疗,联合组1、2年生存率高于放疗组,疗程结束后2~3个月进行复查,显示患者总有效率RR、DCR均显著高于放疗组,与牛瑞芳等[15]研究结果一致。两组均出现不同程度的骨髓抑制、粒细胞减少、贫血等不良反应,但组间比较差异无统计学意义,且多集中在1~2级,无严重不良反应出现;患者均顺利完成治疗,改善临床症状,提高生活质量。
总之,调强放疗联合替莫唑胺同步化疗治疗脑胶质瘤术后残留病灶,近期疗效较好,且未增加不良反应,有效改善患者生活质量。但本研究样本量小,仍需多中心、大样本研究,并分析远期疗效。
[]
[1] 廖维靖.老年脑胶质瘤患者术后生存及预后相关因素分析[J].西部医学,2016,28(6):794-796.
[2] 陈思,徐应军,石文建,等.成人脑胶质瘤预后相关因素分析[J].中国煤炭工业医学杂志,2016,19(4):543-548.
[3] 陈思群,柳先锋,舒小镭.恶性胶质瘤患者术后同期推量调强放疗的疗效及预后因素分析[J].中国肿瘤临床与康复,2016,23(8):959-962.
[4] 刘桂超,胡学锋,黄国森,等.调强放疗联合替莫唑胺同期化疗治疗恶性脑胶质瘤术后残留病灶的近期疗效[J].中国现代医药杂志,2013,15(8):23-26.
[5] 王家清,于云龙,王慧星,等.调强放疗联合替莫唑胺治疗脑胶质瘤术后残余病灶的疗效观察[J].中国实用神经疾病杂志,2016,19(15):55-56.
[6] 王玉玲,陈婷婷,杜娟.卡诺夫斯基健康状况量表在放疗患者分级护理中的应用[J].解放军护理杂志,2007,24(13):14-15.
[7] 李鲁,王红妹,沈毅.SF-36健康调查量表中文版的研制及其性能测试[J].中华预防医学杂志,2002,36(2):109-113.
[8] 李鸣,梁冲,吴鹤鸣,等.可溶性血管内皮钙粘素对脑胶质瘤患者预后的影响[J].医学临床研究,2016,33(9):1781-1783.
[9] 刘许昌,王健.老年恶性脑胶质瘤术后替莫唑胺化疗联合放疗的近远期疗效[J].中国老年学,2015,35(20):5835-5836.
[10] 任义平,林海.低剂量分次放疗联合化疗治疗复发或进展恶性胶质瘤的疗效[J].医学临床研究,2015,32(7):1339-1341.
[11] 姚萌萌,方川,谢靖,等.放射治疗老年脑胶质瘤预后影响因素[J].中国老年学,2016,36(5):1111-1113.
[12] 王小虎,郭丽云,马彬,等.放疗联合替莫唑胺治疗多形性成胶质细胞瘤的meta分析[J].肿瘤,2010,30(12):1056-1064.
[13] 江浩然, 荆国杰.胶质瘤靶向MGMT增敏替莫唑胺治疗[J].中国现代医生 2016,54(6) : 165-168.
[14] 薛强.恶性胶质瘤术后同期推量调强放疗的疗效及其预后影响因素分析[J].东南大学学报:医学版,2016,35(5):746-751.
[15] 牛瑞芳,杨静,窦长武,等.替莫唑胺联合强放疗对恶性脑胶质瘤患者术后残留病灶的疗效分析[J].肿瘤药学,2017,7(2):200-203.

