亲水纳米SiO2对CH4水合物形成的影响
孙慧翠, 王 韧, 徐显广, 王建华,蒋国盛, 张 凌, 刘天乐, 宁伏龙
(1.中国地质大学(武汉)工程学院,湖北武汉 430074; 2.中国石油集团工程技术研究院有限公司,北京 102206; 3.油气钻井技术国家工程实验室,北京 102206)
天然气水合物的勘探开发离不开钻井,但水合物钻井通常采用过平衡钻井,会促使钻井液侵入储层进而诱发水合物的分解和再形成[1-3]。为了消除这些负面影响,在钻井液中添加适量的纳米颗粒是一种行之有效的方法[4-8],但纳米颗粒对水合物形成的影响仍具不确定性[9-10],因此掌握这种影响规律是探究纳米颗粒是否适用于水合物钻井液的又一关键性问题。笔者选取亲水纳米SiO2作为研究对象,对含纳米颗粒的模拟钻井液中CH4水合物形成特征进行研究,并揭示亲水纳米SiO2影响CH4水合物形成和生长的内在机制,为新型水合物钻井液体系的研发提供参考。
1 试 验
1.1 试验材料
蒸馏水及模拟钻井液中CH4水合物形成模拟试验材料包括:纯度大于等于99.9%的CH4气体(武汉纽瑞德特种气体有限公司);平均粒径为30和50 nm气相法制备的亲水纳米SiO2(江苏惠泽精细化工有限公司);蒸馏水(实验室自制)。模拟钻井液为由不同粒径和加量的纳米颗粒与蒸馏水在20 000 r/min高速搅拌下配制而成的分散性、悬浮性较好的纳米流体。
1.2 试验方法
采用恒温恒容法进行CH4水合物形成模拟试验[11]。参考常用水合物地层钻井液温度范围[12],确定试验温度为5.0 ℃;根据赫瑞瓦特大学研发的天然气水合物相平衡计算软件算得此温度条件下纯水中CH4水合物形成的临界压力值为4.56 MPa,为便于试验结果的对比和分析,确定试验初始压力值为5.0 MPa。为了加速CH4气体在模拟钻井液中的饱和溶解及CH4水合物的形成,并确保纳米颗粒在模拟钻井液中的分散性和悬浮性良好,各组试验均在机械搅拌速度为1 200 r/min的动态条件下完成。
水合物形成模拟试验利用自主研发的HCSHW-1型多功能水合物反应模拟装置完成(图1)。试验步骤如下:
(1)清洗容积为650 mL的高压可视化反应釜,利用N2检验釜体气密性。
(2)将250 mL待测液样装入釜内,并持续抽真空30 min;向缓冲罐内注入CH4气体并达到10.0 MPa,打开温控系统对反应釜内的待测液样和缓冲罐内的CH4气体进行降温(为防止纳米颗粒聚集并产生沉淀,待测液样在300 r/min的动态条件下进行降温)。
(3)试验体系温度稳定在5.0 ℃后,将缓冲罐内的CH4气体由反应釜上进气口注入釜内,压力达到5.0 MPa后停止注气,然后将搅拌速度增至1 200 r/min,并打开监测软件采集釜内温度和压力数据至试验结束。
试验过程中使用高清摄像机记录釜内试验现象,并将拍摄到的试验现象与数据采集系统生成的温度和压力曲线进行比对,以确保试验的可靠性。为保障各组试验具有可重复性,每组试验均重复3次或3次以上,本文中所示数据均为多次试验的平均值。

图1 试验装置示意图Fig.1 Schematic of experimental setup
1.3 试验数据处理
利用HCSHW-1型多功能水合物反应模拟装置配备的数据采集系统记录试验过程中反应釜内温度(气、液两相)和压力随时间的变化,再使用该系统对所得数据进行处理并导出相应的温度和压力曲线,确定水合物开始、停止形成的时间点和压力等重要参数。
图2为蒸馏水中CH4水合物形成试验温度、压力随时间变化的曲线和3个关键时刻釜内试验现象的记录图,曲线中标志着水合物开始形成的压力骤降和温度骤升能够很好的对应,试验进行一段时间后釜内压力达到平衡,说明水合物已经停止形成[13]。依此,可得到水合物开始形成的时间点即水合物形的诱导时间t1(采用广义方法进行判定,即试验开始至气体充分溶解后再次出现压力骤降所经历的这段时间[14-15]),水合物停止形成时间t2,以及水合物开始、停止形成时釜内的压力p1和p2。

图2 蒸馏水中水合物形成温度和压力变化Fig.2 Changes in temperature and pressure in hydrate formation in distilled water
评价某种添加物对水合物形成的影响时,需要从水合物形成的诱导时间、形成量、形成速率等方面进行全面分析[9]。各组试验水合物形成的诱导时间可从压力随时间变化曲线上直接读取。由于试验所用客体气体为纯度较高的CH4气体,所以CH4气体的消耗量也就代表了水合物的形成量,各组试验的CH4气体消耗量均采用下式计算得出[16]:
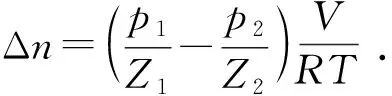
(1)
式中,Δn为气体消耗量,mol;R为气体常数,8.314 41 J/(mol·K);T为气体温度,K;V为气体体积,m3;Z1和Z2分别为水合物开始形成时和停止形成时所处压力状态下的气体压缩因子,由天然气偏差系数计算软件计算。
水合物形成速率通过单位时间内CH4气体消耗量进行表征,即水合物开始形成至停止形成这段时间内CH4气体的平均消耗速率,计算公式为
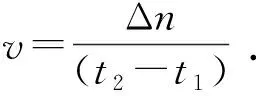
(2)
式中,v为气体消耗速率,mol/min。
2 试验结果
现有研究在评价钻井液处理剂或添加物对水合物形成的影响时,往往将焦点集中于水合物形成诱导时间以及水合物形成量上,较少关注水合物形成速率。综合考虑水合物形成的诱导时间、形成量和形成速率,能够更加全面、准确地评价不同粒径、加量的亲水纳米SiO2对CH4水合物形成的影响。文中各组试验所得试验数据如表1所示。
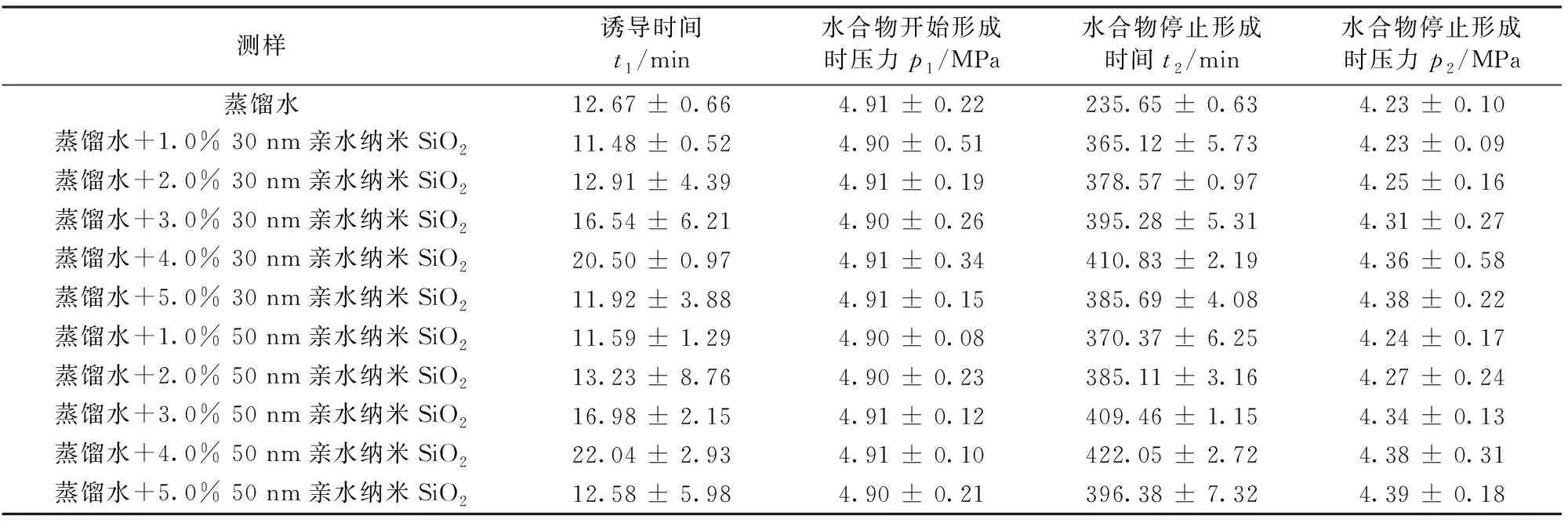
表1 蒸馏水及不同模拟钻井液中CH4水合物的形成情况
2.1 诱导时间
图3为各组试验中水合物形成诱导时间的对比。观察可知,使用30 nm的亲水纳米SiO2配制的5种模拟钻井液中,纳米颗粒加量为1.0%和5.0%时水合物形成的诱导时间短于蒸馏水试验中对应的诱导时间,说明这两个加量下亲水纳米SiO2对CH4水合物的开始形成起到了促进作用;加量为2.0%~ 4.0%时,水合物形成诱导时间逐渐延长且均长于蒸馏水试验中对应的诱导时间,说明这3个加量下亲水纳米SiO2对水合物的开始形成具有一定的抑制作用。使用50 nm的亲水纳米SiO2配制成的5种模拟钻井液中,不同加量纳米颗粒对水合物形成诱导时间的影响与粒径为30 nm时规律一致,只是粒径为50 nm时抑制水合物开始形成的能力更强。
亲水纳米SiO2在模拟钻井液中的加量从1.0%增至4.0%的过程中,水合物形成的诱导时间逐步增长,标志着纳米颗粒抑制水合物开始形成的能力逐渐增强,尤其是加量为4.0%时,这种抑制作用达到最强;当加量达到5.0%后,相比于蒸馏水试验,此时纳米颗粒对水合物的开始形成反而起到了微弱的促进作用。
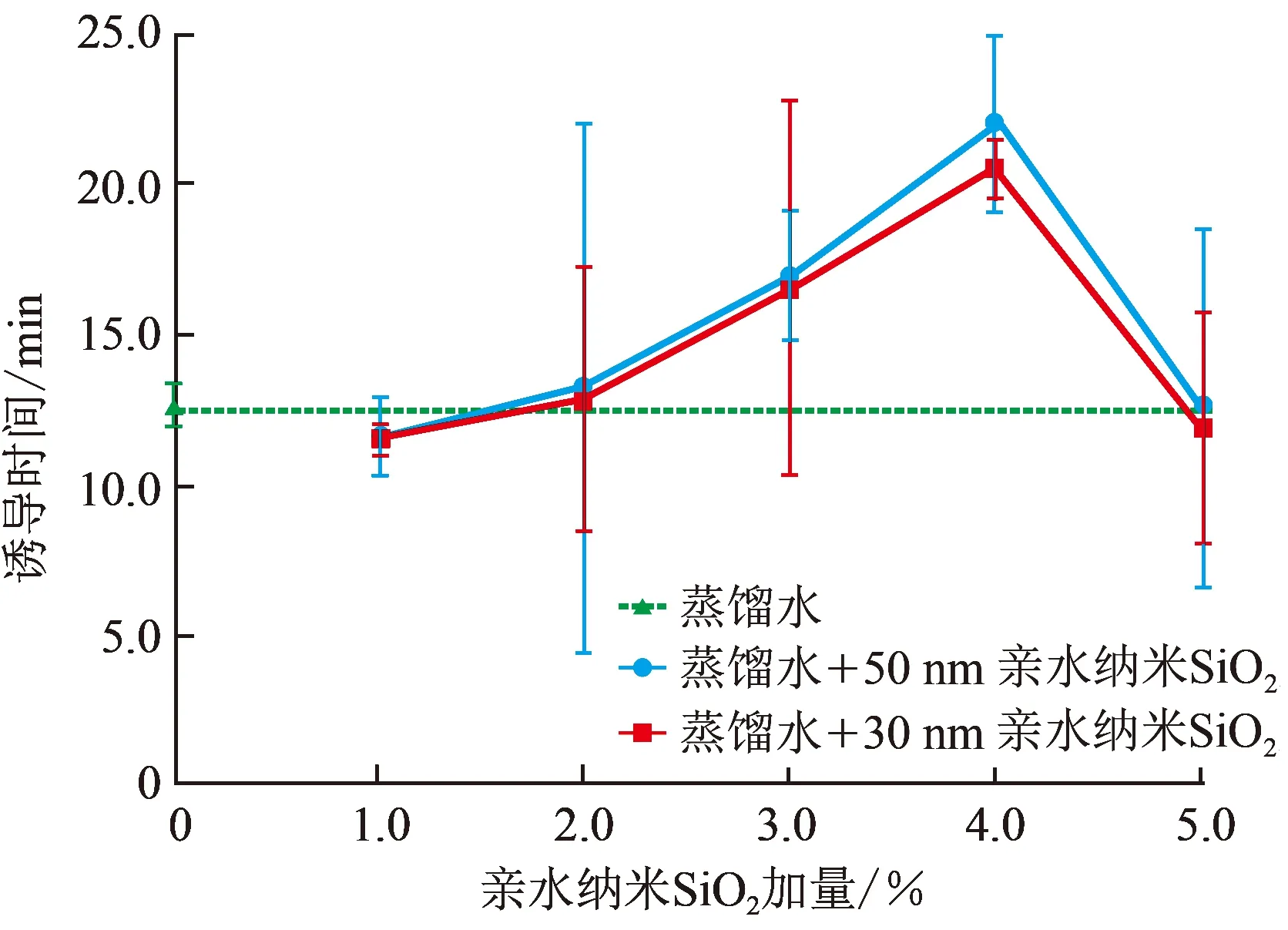
图3 各组试验水合物形成诱导时间对比Fig.3 Induction time for hydrate formation in each set of experiments
2.2 形成量
分析表1中各组试验水合物开始形成时的压力(p1)可以发现,各组试验气体饱和溶解后釜内压力基本相同,所以不同粒径和加量的亲水纳米SiO2对CH4气体在模拟钻井液中的溶解量几乎没有影响。将试验所得的相关数据代入式(1)可计算得出各组试验CH4气体的消耗量,并以此表征试验过程中水合物的形成量,所得结果的对比情况如图4所示。
分析图4可知,两种粒径的亲水纳米SiO2配制成的模拟钻井液中水合物的形成量随纳米颗粒加量的增大而逐渐减小,且都小于蒸馏水试验中水合物的形成量。也就是说,不同粒径和加量的亲水纳米SiO2在模拟钻井液中都能够减小水合物的形成量,并且这种抑制能力会随着纳米颗粒粒径和加量的增大而逐渐增强。

图4 各组试验气体消耗量对比Fig.4 Gas consumption in each set of experiments
2.3 形成速率
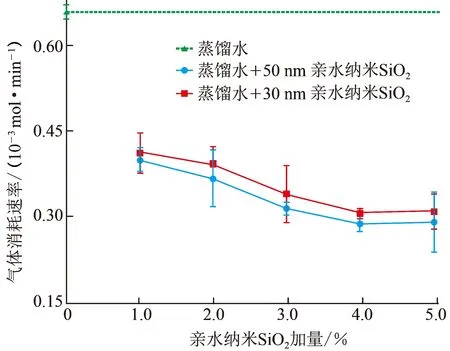
图5 各组试验气体平均消耗速率对比Fig.5 Average gas consumption rate in each set of experiments
将相关试验数据代入式(2)可得到各组试验CH4气体的平均消耗速率,并依此评价各组试验中水合物的形成速率,试验结果对比如图5所示。两种粒径的亲水纳米SiO2配制成的模拟钻井液中,水合物形成速率随纳米颗粒加量改变而变化的趋势一致,并且都较大幅度的慢于蒸馏水中水合物的形成速率。亲水纳米SiO2加量为1.0%~4.0%时,水合物形成速率随亲水纳米SiO2加量的递增呈递减趋势,但加量达到5.0%后,水合物形成速率相对于加量为4.0%时反而有微弱的加快(粒径为30和50 nm时分别加快了0.3×10-5和0.2×10-5mol/min)。此外,在相同加量的情况下,使用粒径为50 nm的亲水纳米SiO2配制而成的模拟钻井液中水合物的形成速率明显更慢一些。
综上所述,模拟钻井液中的亲水纳米SiO2对水合物形成速率具有较强的减缓能力。纳米颗粒粒径相同但加量不同时,加量为4.0%的情况下减缓水合物形成速率的能力最强;纳米颗粒粒径不同加量相同时,50 nm的亲水纳米SiO2减缓水合物形成速率的能力更强。
3 分析讨论
水合物的形成过程是一个传热传质控制的过程[11, 17],在已知所研究的各组模拟钻井液中CH4水合物相平衡条件与纯水中CH4水合物相平衡条件一致的前提下(纳米颗粒粒径大于25 nm后便不会对气体水合物的相平衡条件产生影响,并且纳米颗粒粒径不变加量改变时,气体水合物的相平衡条件也不会受到影响)[18-19],从传热角度分析,均匀分散在模拟钻井液中的纳米颗粒可以一定程度的增强钻井液导热性能,使水合物形成所释放的热量更快速地被传递出钻井液体系,促进水合物生长;而从传质角度分析,纳米颗粒在模拟钻井液中又会起到增大体系气液接触面积的作用,进而加速水合物的形成[9,20]。但本文中所研究的纳米SiO2颗粒表面带有大量羟基使其具有亲水的特性(图6,使用傅里叶红外光谱仪测试得出,由于两种纳米材料制备工艺相同,所以只对50 nm的亲水纳米SiO2表面所带基团进行了测试),这就使纳米颗粒在降低模拟钻井液体系中水分子活度的同时(图7,使用LabSwift-aw水活度测定仪测试得出)[17],还会吸附一定量的水分子在其附近,致使这部分水分子成为束缚水,且束缚水又分为弱束缚水和强束缚水(被吸附于纳米颗粒表面的水分子);当温度和压力条件满足水合物形成条件时,由于弱束缚水在氢键作用下定向排列形成包裹CH4分子笼形结构的过程较难完成且速度缓慢,而强束缚水又极有可能无法与CH4分子在水合物作用下形成水合物(图8),所以纳米颗粒抑制了水合物的形成和生长[21-23],并且这种抑制作用要强于纳米颗粒对水合物形成和生长所起到的促进作用。
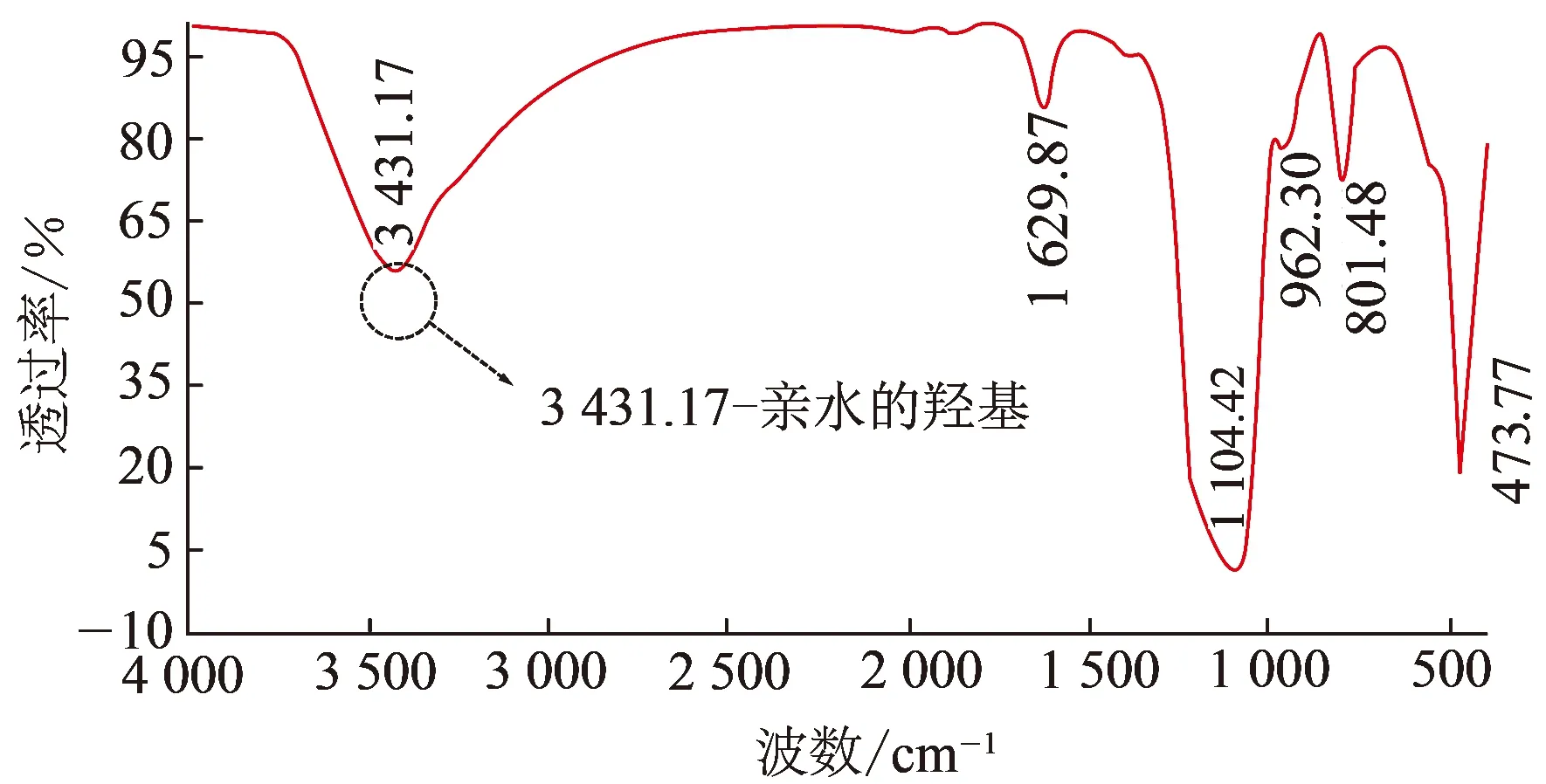
图6 亲水纳米SiO2颗粒红外光谱测试Fig.6 Infrared spectrum of hydrophilic nano-SiO2
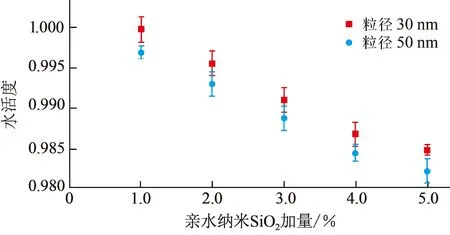
图7 各组模拟钻井液水活度Fig.7 Water activity of each simulated drilling fluid
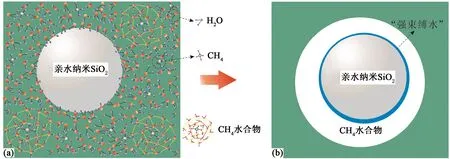
图8 亲水纳米SiO2颗粒抑制水合物形成机制示意图Fig.8 Mechanism of hydrate inhibition for hydrophilic nano-SiO2
明确了亲水纳米SiO2抑制CH4水合物形成和生长的机制之后,探究不同粒径和加量的纳米颗粒对水合物形成的抑制规律和抑制机制则成为关注的重点。通过改变模拟钻井液中亲水纳米SiO2的粒径发现,当粒径由30 nm增大到50 nm后,模拟钻井液中水合物形成的诱导时间有所延长,形成量有所减小,形成速率有所减慢。由于亲水纳米颗粒在模拟钻井液中是以大小各异的“团簇体”形式均匀分散的[24],所以纳米团簇的平均粒径对体系中水合物形成具有较大影响。
各组模拟钻井液中纳米团簇平均粒径分布如图9所示。由图9可知,加量相同的情况下,粒径为50 nm时相对于粒径为30 nm时亲水纳米SiO2在模拟钻井液中所形成“团簇体”的平均粒径要略小一些(使用Mastersizer 3000纳米激光粒度仪测试得出),这就说明50 nm的亲水纳米SiO2在蒸馏水中团聚性更弱,分散性更好,纳米团簇的比表面积更大,能够束缚的水分子更多,并且降低模拟钻井液中水分子活度的能力更强(图7),所以体系中水合物形成的诱导时间更长,形成量更小,形成速率更慢。
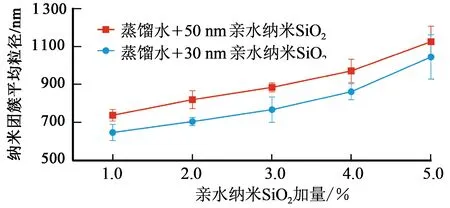
图9 各组模拟钻井液中纳米团簇平均粒径Fig.9 Average grain sizes of nanoclusters in each simulated drilling fluid
模拟钻井液中亲水纳米SiO2粒径相同加量不同的情况下,加量为1.0%时,纳米颗粒在体系中束缚的水分子数量较少,对体系中水分子活度的影响也较小,并且增大了体系气液接触面积,所以对水合物的开始形成起到了一定的促进作用(图3);但由于纳米颗粒对附近水分子具有束缚作用,使被束缚的水分子较难甚至无法与CH4分子形成水合物,所以此时纳米颗粒仍会减缓水合物的形成速率并减小水合物的形成量[21-22]。纳米颗粒加量由2.0%增至4.0%的过程中,模拟钻井液中的自由水分子数量逐渐减少且水分子活度逐渐降低,促使水合物形成诱导时间逐渐增长,水合物形成量逐渐减少,水合物形成速率逐渐降低,并且加量为4.0%时,纳米颗粒抑制水合物成核和生长的能力达到峰值。纳米颗粒加量增大到5.0%后,虽然纳米颗粒表面强束缚水的量进一步增多,使水合物形成量继续减小,但是此时体系中纳米团簇的粒径已达到甚至超过1.0 μm(图9),纳米颗粒所特有的某些纳米效应可能已经失效,并且由于体系中气液接触面积增大到一定程度,导致纳米颗粒促进了水合物的开始形成;在此加量下,搅拌作用很可能在加剧纳米颗粒之间碰撞的同时也加速并加剧了对颗粒表面已形成水合物壳的破坏,使原本被水合物壳包裹的弱束缚水与更多的气体分子接触,在气液接触面积变大的情况下,促进弱束缚水与CH4分子形成水合物,所以纳米颗粒加量为5.0%时相对于加量为4.0%时水合物的形成速率有了微弱的增快。虽然模拟钻井液中纳米颗粒加量为1.0%~4.0%时匀速搅拌情况下这种颗粒与颗粒之间的碰撞作用也是存在的,但对颗粒表面水合物壳的破坏作用不够强,使这一作用对水合物形成速率的影响较小;只有纳米颗粒加量增大到一定值后,这种碰撞破坏作用才会突显出来,致使体系中水合物的形成速率有所加快。
4 结 论
(1)对于水合物形成诱导时间和形成速率,当模拟钻井液中亲水纳米SiO2的粒径为50 nm、加量为4.0%时,体系中水合物形成的诱导时间最长、形成速率最慢。
(2)对于水合物形成量,模拟钻井液中亲水纳米SiO2的粒径为50 nm、加量为5.0%时,体系中水合物的形成量最小。
(3)粒径为50 nm、加量为4.0%的亲水纳米SiO2在模拟钻井液中对CH4水合物成核和生长的抑制效果最佳,比蒸馏水中CH4水合物形成的诱导时间延长了74%,形成量减少了21%,形成速率降低了56%。
:
[1] MCCONNELL D R, ZHANG Z J, BOSWELL R. Review of progress in evaluating gas hydrate drilling hazards[J]. Marine and Petroleum Geology, 2012,34(1):209-223.
[2] NING F L, ZHANG K N, WU N Y, et al. Invasion of drilling mud into gas-hydrate-bearing sediments—part I: effect of drilling mud properties[J]. Geophysical Journal International, 2013,193(3):1370-1384.
[3] NING F L, WU N Y, YU Y B, et al. Invasion of drilling mud into gas-hydrate-bearing sediments—part II: effects of geophysical properties of sediments[J]. Geophysical Journal International, 2013,193(3):1385-1398.
[4] CAI J, CHENEVERT M E, SHARMA M M, et al. Decreasing water invasion into Atoka shale using nonmodified silica nanoparticles[J]. SPE Drilling & Completion, 2012,27(1):103-112.
[5] LIU T L, JIANG G S, ZHANG P, et al. A new low-cost drilling fluid for drilling in natural gas hydrate-bearing sediments[J]. Journal of Natural Gas Science and Engineering, 2016(33):934-941.
[6] 白小东,蒲晓林,郑艳.钻井液用纳米处理剂研究[J].西南石油大学学报,2007(增1):43-45.
BAI Xiaodong, PU Xiaolin, ZHENG Yan. Nano-additive used in drilling fluid[J]. Journal of Southwest Petroleum University, 2007(sup1):43-45.
[7] ZAKARIA M, HUSEIN M M, HARLAND G. Novel nanoparticle-based drilling fluid with improved characteristics[R]. SPE 156992 MS, 2012.
[8] 沈丽.钻井液用纳米膨润土复合体的研究与应用[D].东营:中国石油大学(华东),2010.
SHEN Li. Research and application of nanometer bentonite composite for drilling fluid [D]. Dongying: China University of Petroleum(East China), 2010.
[9] FARHANG F, NGUYEN A V, SEWELL K B. Fundamental investigation of the effects of hydrophobic fumed silica on the formation of carbon dioxide gas hydrates[J]. Energy & Fuels, 2014,28(11):7025-7037.
[10] CHARI V D, SHARMA D V, PRASAD P S R, et al. Methane hydrates formation and dissociation in nano silica suspension[J]. Journal of Natural Gas Science and Engineering, 2013,3(11):7-11.
[11] JACOBSON L C, HUJO W, MOLINERO V. Amorphous precursors in the nucleation of clathrate hydrates[J]. Journal of the American Chemical Society, 2010,132(33):11806-11811.
[12] KOTKOSKIE T S, AL-UBAIDI B, WILDEMAN T R, et al. Inhibition of gas hydrates in water-based drilling muds[J]. SPE Drilling Engineering, 1992,7(2):130-136.
[13] VYSNIAUSKAS A, BISHNOI P R. A kinetic study of methane hydrate formation[J]. Chemical Engineering Science, 1983,38(7):1061-1072.
[14] SKOVBORG P, NG H J, RASMUSSEN P, et al. Measurement of induction times for the formation of methane and ethane gas hydrates[J]. Chemical Engineering Science, 1993,48(3):445-453.
[15] MAKOGON Y F. Natural gas hydrates-A promising source of energy[J]. Journal of Natural Gas Science and Engineering, 2010,2(1):49-59.
[16] FARHANG F, NGUYEN A V, HAMPTON M A. Influence of sodium halides on the kinetics of CO2hydrate formation[J]. Energy & Fuels, 2014,28(2):1220-1229.
[17] WALSH M R, KOH C A, SLOAN E D, et al. Microsecond simulations of spontaneous methane hydrate nucleation and growth[J]. Science, 2009,326(5956):1095-1098.
[18] LI J P, LIANG D Q, GUO K H, et al. Formation and dissociation of HFC134a gas hydrate in nano-copper suspension[J]. Energy Conversion and Management, 2006,47(2):201-210.
[19] 李金平.纳米流体中制冷剂气体水合物生成动力学和相平衡特性研究[D].上海:上海交通大学,2005.
LI Jinping. Study on reaction kinetics and phase equilibrium of refrigerant gas hydrates in nanofluids [D]. Shanghai: Shanghai Jiao Tong University, 2005.
[20] 周诗岽,余益松,甘作全,等.纳米石墨颗粒对气体水合物生成诱导时间的影响[J].天然气化工(C1化学与化工),2015,40(1):60-64.
ZHOU Shidong, YU Yisong, GAN Zuoquan, et al. Effect of graphite nanoparticles on induction of gas hydrate formation[J]. Natural Gas Chemical Industry, 2015,40(1):60-64.
[21] RIESTENBERG D, WEST O, LEE S, et al. Sediment surface effects on methane hydrate formation and dissociation[J]. Marine Geology, 2003,198(1):181-190.
[22] WU Q, ZHANG Q, ZHANG B Y. Influence of super-absorbent polymer on the growth rate of gas hydrate[J]. Safety Science, 2012,50(4):865-868.
[23] SA J H, KWAK G H, HAN K, et al. Gas hydrate inhibition by perturbation of liquid water structure[R]. Scientific Reports 11526,2015.
[24] 任俊,卢寿兹.亲水性及疏水性颗粒在水中的分散行为研究[J].中国粉体技术,1999,5(2):6-9.
REN Jun, LU Shouci. Dispersion behaviors of hydrophilic and hydrophobic particles in water[J]. China Powder Science and Technology, 1999,5(2):6-9.

