siRNA慢病毒载体介导DKK-1基因沉默对骨髓间充质干细胞分化影响的实验研究*
岳辰张雪温阳阳刘又文**康鹏德
(1.河南省洛阳正骨医院河南省骨科医院髋部损伤治疗中心,河南洛阳471000;
2.河南省洛阳正骨医院河南省骨科医院风湿科,河南洛阳471000;
3.河南中医药大学洛阳研究生培养工作部,河南洛阳471000;4.四川大学华西医院骨科,成都610041;)
股骨头坏死(osteonecrosis of femoral head,ONFH)是骨科常见的难治性疾病之一。中国是ONFH的高发国家,其病因主要包括创伤、糖皮质激素应用、酗酒等[1]。其中长期大剂量或短期超大剂量应用糖皮质激素是ONFH最常见的诱因之一[2,3],以上述方法应用糖皮质激素患者的激素性股骨头坏死(steroid-induced osteonecrosis of femoral head,SONFH)的发生率甚至可超过40%[4]。
近年来大量研究指出,SONFH的发生与骨代谢紊乱密切相关,在超生理剂量糖皮质激素作用下,股骨头内骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSC)成脂分化增加,成骨分化减少、骨修复能力减弱,从而进一步导致股骨头内压力增高,骨修复停滞,最终导致ONFH[5-9],而这一病理生理过程的发生、发展可能与经典Wnt信号通路的失调有紧密联系[7-9]。
Wnt信号通路是存在于自然界多种生物中的一条高度保守的信号传导途径,与细胞增殖、分化,胚胎发育等多种生理过程密切相关。Wnt通路可分为经典的Wnt/β-catenin信号通路与非经典通路,而Wnt/β-catenin信号通路与骨代谢密切相关,各种原因导致的Wnt/β-catenin信号通路失调可能是导致骨质疏松、骨坏死等多种骨科疾病的重要原因之一[10-12]。
BMSC是存在于成体骨髓中的多能干细胞,正常生理条件下,BMSC按一定比例进行成骨与成脂分化,在维持骨代谢的动态平衡中起着极为重要的作用[13]。Wnt/β-catenin信号通路的激活和传导是促进BMSC向成骨细胞分化、增殖,抑制成脂分化,调节骨代谢平衡的关键[10-12]。正常生理情况下,Wnt/β-catenin信号通路处于激活状态,促进BMSC成骨分化,并抑制其成脂分化。其生理过程可简单概括为Wnt糖蛋白与其受体卷曲蛋白特异性结合形成受体复合体,进入细胞并使胞质内的糖原合成激酶3β失活,抑制βcatenin的磷酸化和降解,从而进一步激活成骨相关基因Runx-2转录,促进BMSC成骨细胞分化,同时抑制成脂相关基因PPAR-γ转录而抑制BMSC成脂分化和成熟[14,15]。而胞外蛋白Dickkopf-1(DKK-1)对Wnt/β-catenin信号通路的正常激活起负向调节作用[16-18],是经典Wnt信号通路的抑制剂。DKK-1通过作用于包膜Wnt相关糖蛋白,阻抑其与卷曲蛋白相结合形成复合体,从而抑制正常Wnt信号通路的传导和激活,抑制其生物调节功能。近年来的研究证实,超生理剂量激素性可能通过激活DKK-1过表达而抑制经典Wnt信号通路的表达,导致BMSC异常分化,从而引起ONFH[16-18]。
因此,本实验选择Wnt/β-catenin信号通路,以DKK-1基因作为靶点,通过RNA干扰技术,利用慢病毒作为载体,将DKK-1 siRNA导入激素诱导下的BMSC进行长效的基因沉默,研究特异性抑制DKK-1过表达对超生理剂量糖皮质激素作用下Wnt/βcatenin通路的调控作用及对BMSC分化的影响,探索SONFH的发病机制,并为研究SONFH防治的新途径、新方法提供有效数据。
1 资料与方法
1.1 大鼠BMSC样本来源
本实验所提取的BMSC均由SD大鼠长骨骨髓中获得。SPF级SD大鼠乳鼠由达硕生物科技有限公司提供,1周龄,雌雄不限,体重20~30 g。
1.2 主要试剂
成骨诱导液(美国GIBCO公司提供),成脂诱导液(美国GIBCO公司提供),仓鼠抗大鼠CD29单克隆抗体(美国BD公司提供),小鼠抗大鼠CD44单克隆抗体(美国BD公司提供),小鼠抗大鼠CD90单克隆抗体(美国BD公司提供),人抗大鼠CD34单克隆抗体(美国Santa Cruz公司提供),小鼠抗大鼠CD45单克隆抗体(美国BD公司提供),DKK-1基因慢病毒干扰载体及病毒感染增强液polybrene(上海吉凯公司提供),RNA引物(中国擎科生物公司提供),地塞米松(美国Sigma公司提供),兔抗大鼠RUNX2单克隆抗体(美国CST公司提供),山羊抗大鼠PPARγ-2多克隆抗体(美国Santa Cruz公司提供),兔抗大鼠GSK-3β单克隆抗体(美国CST公司提供),兔抗大鼠β-catenin单克隆抗体(美国CST公司提供),兔抗大鼠DKK-1多克隆抗体(美国CST公司提供),兔抗大鼠GAPDH单克隆抗体(美国CST公司提供)。
本实验DKK-1基因慢病毒干扰载体购自上海吉凯基因化学技术有限公司,采用3质粒系统包装病毒。而本实验目的序列通过Genebank查找:通过Pubmed miRNAbase检索大鼠DKK-1全长cDNA序列(NM_001106350),通过Invitrogen软件设计目的序列GTACAAATCTGCCTGGCTT,同时设计一条无序序列TTCTCCGAACGTGTCACGT用于对照组实验,通过BLAST比对验证该序列对其他基因序列的靶向性无干扰效果。
各基因序列见表1。PCR反应条件:95℃预变性5 min,94℃变性30 s,54℃退火30 s,72℃延伸40 s,最后一个循环72℃延伸8 min。PCR产物经15 g/L琼脂糖凝胶电泳后,以UVP凝胶密度扫描仪对各基因特异性扩增产物的电泳条带进行密度扫描,用Labwork 3.0软件分析电泳条带密度值。

表 1 各基因序列
1.3 实验方法
将大鼠处死后取其双侧股骨及胫骨,取含骨髓液离心(1300 rpm,5 min),用含10%FBS的DMEM低糖培养基培养(37℃,5%CO2),首次换液时间为48 h,之后每48 h换液1次,细胞贴壁达到80%以上后按1:3传代。取第3代细胞倒置相差显微镜下观察细胞形态,并成骨及成脂分化诱导,流式细胞学进行CD29、CD44、CD90、CD34、CD45表型鉴定。取第3代BMSC,分为对照组(A组)、激素组(B组)、激素+无序序列慢病毒载体组(C组)及激素+DKK-1慢病毒载体组(D组)进行实验。C、D组进行慢病毒载体转染,前期预实验已确定慢病毒载体转染最佳浓度为感染复数(multiplicity of infection,MOI)=25,A、B组常规更换培养基。转染96 h后,吸去各组培养基,A组更换基础培养基,B、C、D组加入含1×10-6mol/L地塞米松的培养基。以后每48 h全量换液,A组仍更换基础培养基,B、C、D组更换含上述浓度地塞米松的培养基。每日观察,待细胞达到80%融合时进行传代培养。培养14 d后,提取各组细胞RNA及蛋白,对DKK-1、PPAR-γ2和RUNX2进行Real-time PCR检测及Western-blot检测,并对各组进行油红O、茜素红染色,观察各组BMSC分化情况。实验简要流程见图1。
1.4 统计学方法
采用SSPS 20.0进行统计学分析,两组间数据结果比较采用t检验,两组以上组间比较采用单因素方差分析;P<0.05为有统计学差异。
2 结果
2.1 BMSC的鉴定结果
2.1.1 形态学鉴定:原代细胞培养并传至第3代已纯化,几乎所有细胞呈长梭形,并随细胞量的增加逐渐由长梭形变为短梭形,细胞整体呈波浪形,贴满瓶底(图2)。
2.1.2 成骨及成脂分化诱导染色鉴定:对第3代BMSC进行成骨分化诱导14 d,茜素红染色阳性,倒置相差显微镜下观察可见散在分布的橘红色团块沉积(图3)。对第3代BMSC进行成脂分化诱导21 d,油红O染色阳性,倒置相差显微镜下观察可见大量红染圆形脂滴(图4)。
2.1.3 流式细胞学表型鉴定:流式细胞仪检测细胞表型显示所提取细胞CD29、CD44、CD90表达率分别为100%、100%、99.9%,CD34、CD45表达率分别为0.4%及0.5%。
2.2 MOI=25时DKK- 1慢病毒载体的转染效率
MOI=25时,萤光显微镜下可见大量荧光转染区(图5),流式细胞仪检测DKK-1慢病毒载体的转染效率已超过90%(图6)。
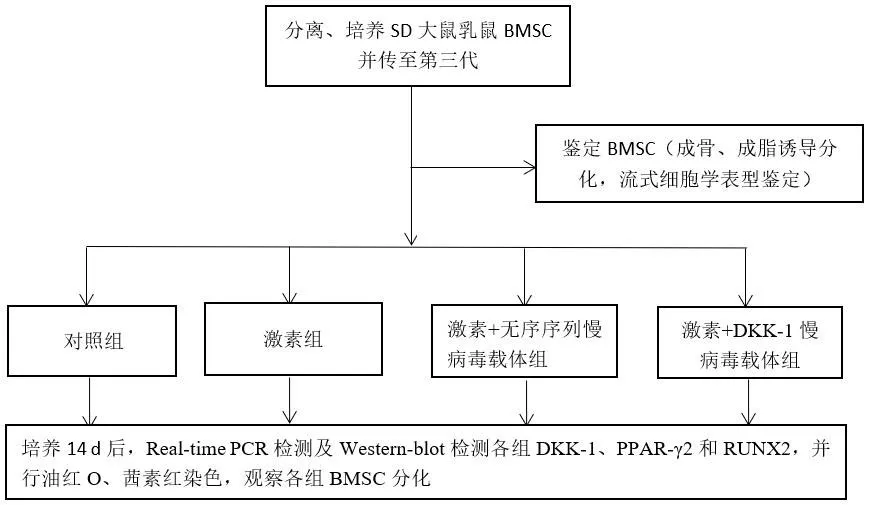
图1 简要流程图

图2 第三代BMSC已纯化,几乎所有细胞呈长梭形(40×)
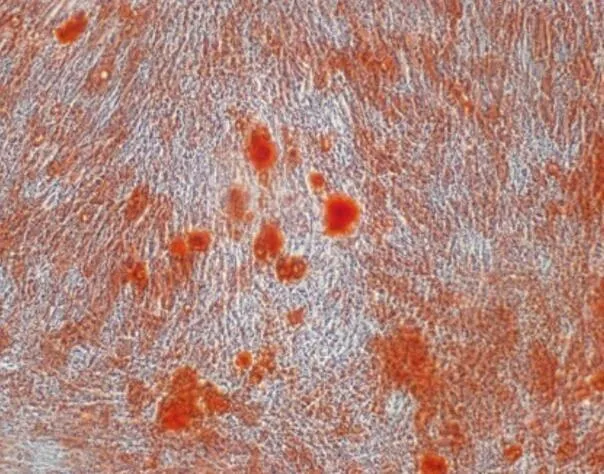
图3 第三代BMSC成骨诱导14 d,可见散在分布的橘红色团块沉积,茜素红染色(+)(100×)
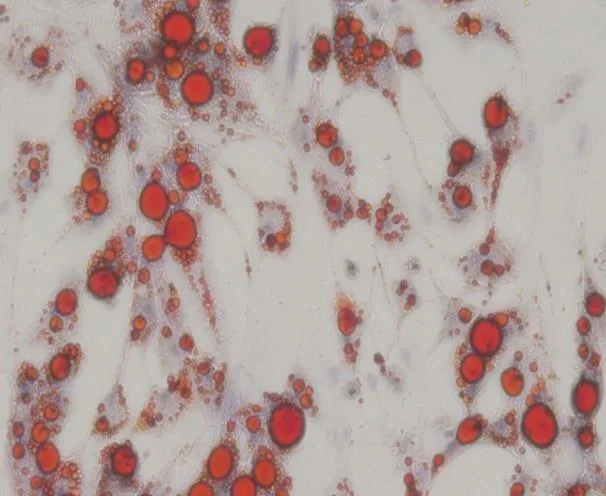
图4 第三代BMSC成脂诱导21 d,可见大量红染圆形脂滴,油红O染色(+)(100×)
2.3 不同组间DKK- 1、PPAR- γ 2及RUNX 2基因的表达
2.3.1 DKK-1:B、C组与A、D组相比,DKK-1表达显著增高(P<0.05,图7)。B组DKK-1的RNA相对表达量是A组的3.8倍,而D组的RNA相对表达量也明显低于B组(P=0.014,图7)。
2.3.2 成脂相关基因PPAR-γ2:B、C组与A、D组相比,成脂相关基因PPAR-γ2表达明显升高,(P<0.05,图8)。B组PPAR-γ2的RNA相对表达量是A组的1.98倍,而D组PPAR-γ2的RNA相对表达量明显低于B组,但与A组相比差异无统计学意义(P=0.262,图8)。
2.3.3 成骨相关基因RUNX2:B、C组与A、D组相比,成骨相关基因RUNX2表达显著降低(P<0.05,图9)。B组RUNX2的RNA相对表达量是A组的45%(P=0.000,图9),而D组RUNX2的相对表达量明显高于B组,但与A组相比差异无统计学意义(P=0.169,图9)。
2.4 不同组间Wnt通路相关蛋白的表达
2.4.1 DKK-1:B、C组与A、D组相比,DKK-1蛋白表达显著增高(P<0.05,图10)。B组DKK-1的相对表达量是A组的1.7倍,而D组DKK-1蛋白的表达也明显低于B组(P<0.05,图10)。
2.4.2 成脂相关基因PPAR-γ2:B、C组与A、D组相比,成脂相关基因PPAR-γ2蛋白表达明显升高,差异有统计学意义(P<0.05,图11)。B组PPAR-γ2的相对表达量是A组的2.1倍,而D组PPAR-γ2的相对表达量明显低于B组(P<0.05,图11)。

图5 MOI=25,荧光显微镜下可见大量荧光转染区(100×)
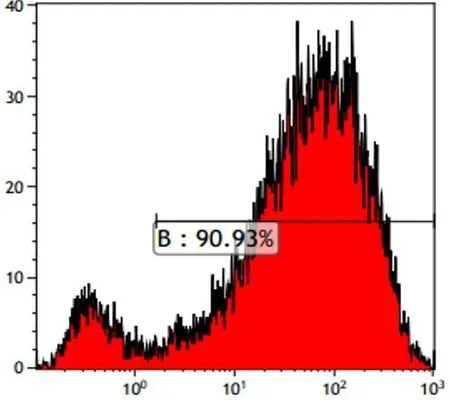
图6 MOI=25,DKK-1慢病毒载体的转染效率为90.93%
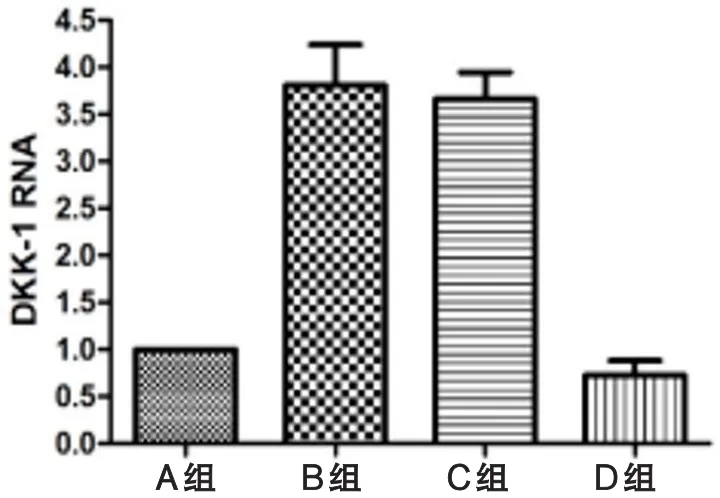
图7 各组间DKK-1的RNA相对表达量
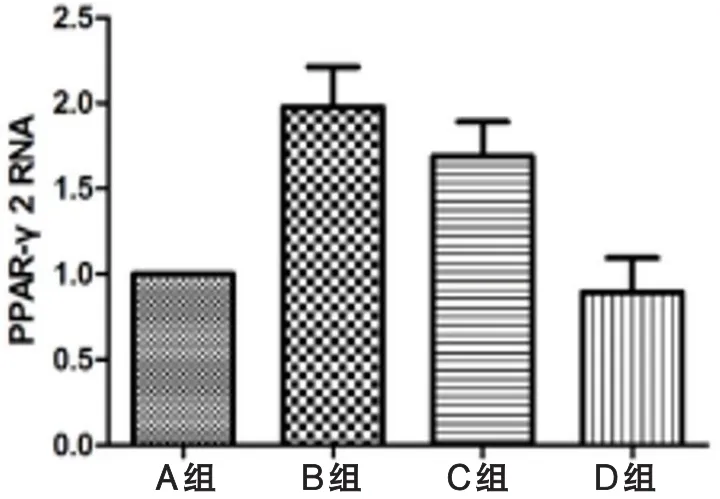
图8 各组间PPAR-γ2的RNA相对表达量
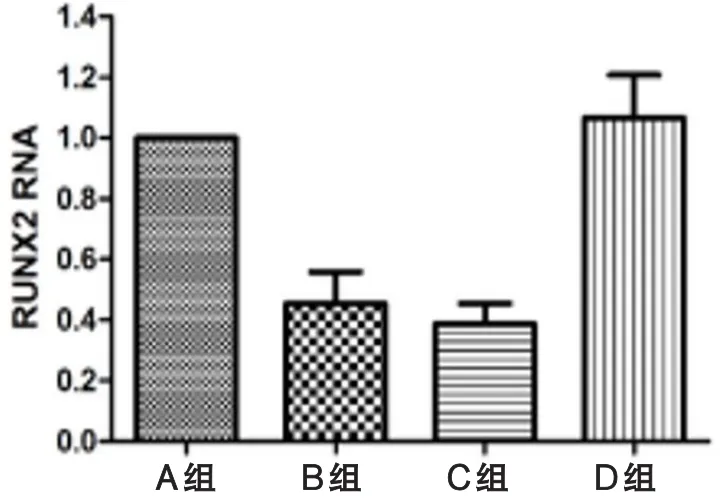
图9 各组间RUNX2的RNA相对表达量
2.4.3 成骨相关基因RUNX2:B、C组与A、D组相比,成骨相关基因RUNX2蛋白表达量显著降低,差异有统计学意义(P<0.05,图12)。B组RUNX2的相对表达量仅为A组的66%,而D组RUNX2的相对表达量明显高于B组,但与A组相比差异无明显统计学意义(P>0.05,图12)。
2.5 不同组间的细胞分化
各组的BMSC培养至14 d后进行油红O及茜素红染色,倒置相差显微镜观察各组BMSC分化情况。结果显示B组及C油红O染色阳性、茜素红染色阴性。A组及D组油红O染色阴性、茜素红染色阳性(图13、14)。
3 讨论
SONFH的发病机制尚不完全清楚,目前主要的假说包括骨内高压学说、凝血机制改变学说、骨质疏松学说、骨细胞凋亡学说等[19-21],虽各有一些临床和实验研究依据,但均不能完全解释SONFH的全部病理过程。其中,股骨头内骨代谢紊乱,骨细胞活性的改变是上述多种学说的中间作用环节,因此越来越多的学者逐渐重视ONFH过程中骨代谢及骨细胞活性的变化,并认为BMSC脂肪变及成骨分化障碍使髓腔的压力增高、骨修复能力降低,这可能在ONFH的发生过程中起关键作用,而超生理剂量糖皮质激素引起的BMSC异常分化是这一过程的始动环节[20,21]。
目前研究认为Wnt/β-catenin信号通路是调节BMSC正常分化的关键信号通路,超生理剂量激素能够通过上调Wnt/β-catenin信号通路拮抗因子DKK-1的表达阻抑Wnt/β-catenin信号通路的激活,介导PPAR-γ2高表达和Runx2低表达,从而导致BMSC成脂分化增加、成骨分化减少,最终形成骨髓腔内脂肪细胞多于成骨细胞,股骨头髓腔压力增加,股骨头发生坏死[14-18]。

图10 各组间DKK-1蛋白表达(内参GAPDH)

图11 各组间PPAR-γ2蛋白表达(内参GAPDH)
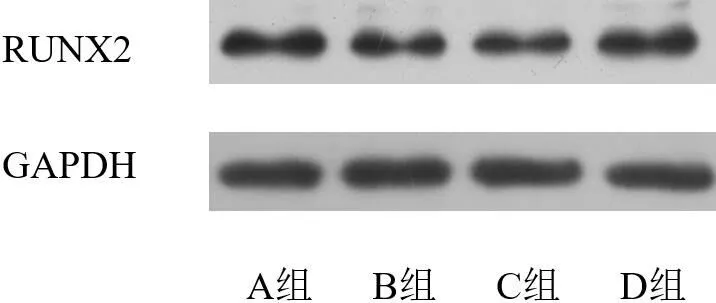
图12 各组间RUNX2蛋白表达(内参GAPDH)
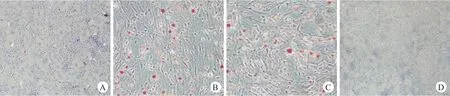
图13 各组油红O染色结果(阳性为圆形红染区,代表BMSC成脂分化)
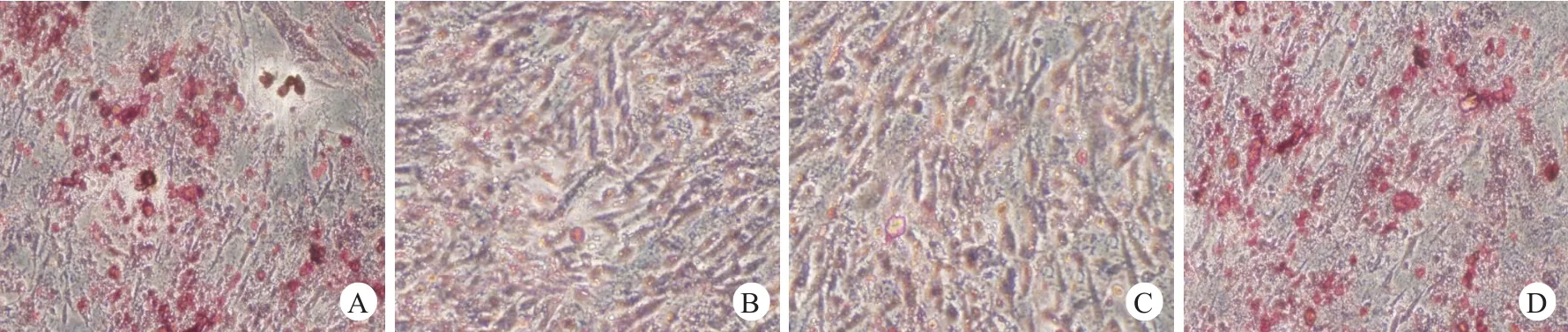
图14 各组茜素红染色结果(阳性结果为红色局部区域,代表钙结节形成,BMSC成骨分化)
胞外蛋白DKK-1对Wnt/β-catenin信号通路的正常激活起负向调节作用,是经典Wnt信号通路的抑制剂,通过对DKK-1的抑制,理论上可以同时调控PPAR-γ2和Runx2的表达,从而调控BMSC的异常分化[14,15]。DKK-1蛋白属于Dickkopf家族,作为一种分泌型胞外蛋白,DKK-1可与细胞膜表面的Wnt/βcatenin受体LRP5/6和DKK-1共受体Kremen1或Kremen2结合,形成内吞小体,减少细胞膜表面的LRP5/6的数量,抑制Wnt/β-catenin信号通路的激活[17]。有研究表明,DKK-1的异常表达会造成骨质疏松,而通过药物或基因技术特异性抑制DKK-1的表达可能会起到治疗目的[22]。使用DKK-1的中和抗体可以增加多发性骨髓瘤肿瘤细胞的小鼠骨组织中成骨细胞的数量,而利用基因技术敲除或沉默DKK-1基因可以促进成骨细胞的增殖、分化,增加骨量[23]。因此,以DKK-1作为靶点调节Wnt信号通路,对于以骨量减少为特点的骨科疾病,可能是一种有效的治疗方法。对于超生理剂量激素引起的BMSC分化异常,以往的研究多以PPAR-γ2或Runx2基因为靶点,虽然得到了较好的实验结果,但若能以一种同时调控PPAR-γ2和Runx2的基因为靶点,可能对于重新调控超生理剂量激素引起的BMSC异常分化是一种新的思路。
因此,基于以往研究的基础进行了本实验,结果显示超生理剂量激素可通过致DKK-1过表达而抑制Wnt/β-catenin信号通路的正常激活,进而上调成脂相关基因PPAR-γ2的表达、同时下调成骨基因RUNX2的表达,诱导BMSC向脂肪细胞方向分化,并抑制其成骨分化。DKK-1基因慢病毒干扰载体可以通过基因沉默,特异性抑制DKK-1过表达而重新激活Wnt/β-catenin信号通路,有效减少成脂相关基因PPAR-γ2的表达、增加成骨基因RUNX2的表达。染色结果显示,通过DKK-1基因沉默,成功抑制BMSC成脂分化,促进BMSC分化成为有生物活性的成骨细胞,为早期SONFH的治疗提供了新的思路。
由于Wnt/β-catenin信号通路在生物体内广泛存在,而DKK-1的高表达也不完全是有害的,盲目抑制DKK-1表达可能会对机体内其他脏器、组织产生影响,所以进行相应的动物实验以验证其有效性及安全性是利用DKK-1基因治疗SONFH的下一步研究方向,也是本实验的最大不足。相信本实验结果能为下一步的研究提供可靠的实验数据。
[1]Hong YC,Luo RB,Lin T,et al.Efficacy of alendronate for preventing collapse of femoral head in adult patients with nontraumatic osteonecrosis.Biomed Res Int,2014,2014:716538.
[2]Kong X,Li X,Zhang C,et al.Aqueous fraction of huogu formula promotes osteogenic differentiation of bone marrow stromal cells through the BMP and wnt signaling pathways.Rejuvenation Res,2016,19(6):509-520.
[3]Tripathy SK,Goyal T,Sen RK.Management of femoral head osteonecrosis:Current concepts.Indian J Orthop,2015,49(1):28-45.
[4] Issa K,Pivec R,Kapadia BH,et al.Osteonecrosis of the femoral head:the total hip replacement solution.Bone Joint J,2013,95-B(11 SuppleA):46-50.
[5]Weinstein RS,Hogan EA,Borrelli MJ,et al.The pathophysiological sequence of glucocorticoid-induced osteonecrosis of the femoral head in male mice.Endocrinology,2017,158(11):3817-3831.
[6]Lin T,Liu J,Yang S,et al.Relation between the development of osteoporosis and osteonecrosis following glucocorticoid in a rabbit model.Indian J Orthop,2016,50(4):406-413.
[7]Li J,Fan L,Yu Z,et al.The effect of deferoxamine on angiogenesis and bone repair in steroid-induced osteonecrosis of rabbit femoral heads.Exp Biol Med,2015,240(2):273-280.
[8]Gao YS,Wang HF,Ding H,et al.A novel rat model of osteonecrosis of the femoral head induced by periarticular injection of vascular endothelial growth factor receptor 2 antibody.J Surg Res,2013,183(1):e1-5.
[9]Xu C,Wang J,Zhu T,et al.Cross-talking between PPAR and Wnt signaling and its regulation in mesenchymal stem cell differentiation.Curr Stem Cell Res Ther,2016,11(3):247-254.
[10]Zhang C,Zou YL,Ma J,et al.Apoptosis associated with Wnt/β-catenin pathway leads to steroid-induced avascular necrosis of femoral head.BMC Musculoskelet Disord,2015,16:132.
[11]Chughtai M,Piuzzi NS,Khlopas A,et al.An evidencebased guide to the treatment of osteonecrosis of the femoral head.Bone Joint J,2017,99-B(10):1267-1279.
[12]李昕,朱智敏.Wnt信号通路与骨细胞生物力刺激信号转导间的关系.国际口腔医学杂志,2012,39(3):328-331.
[13]Gu Q,Cai Y,Huang C,et al.Curcumin increases rat mesenchymal stem cell osteoblast differentiation but inhibits adipocyte differentiation.Pharmacogn Mag,2012;8(31):202-208.
[14]Jami A,Gadi J,Lee MJ,et al.Pax6 expressed in osteocytes inhibits canonical Wnt signaling.Mol Cells.2013,35(4):305-312.
[15]Kim JH,Liu X,Wang J,et al.Wnt signaling in bone formation and its therapeutic potential for bone diseases.Ther Adv Musculoskelet Dis,2013,5(1):13-31.
[16]Zou YC,Yang XW,Yuan SG,et al.Downregulation of dickkopf-1 enhances the proliferation and osteogenic potential of fibroblasts isolated from ankylosing spondylitis patients via theWnt/β-catenin signaling pathway in vitro.Connect Tissue Res,2016,57(3):200-211.
[17]Zhou XL,Qin XR,Zhang XD,et al.Downregulation of Dickkopf-1 is responsible for high proliferation of breast cancer cells via losing control of Wnt/beta-catenin signaling.Acta Pharmacol Sin,2010,31(2):202-210.
[18]Jiang Y,Zhang Y,Zhang H,et al.Pravastatin prevents steroid-induced osteonecrosis in rats by suppressing PPARγ expression and activating Wnt signaling pathway.Exp Biol Med(Maywood),2014,239(3):347-355.
[19]Mont MA,Cherian JJ,Sierra RJ,et al.Nontraumatic osteonecrosis of the femoral head:where do we stand today?A ten-year update.J Bone Joint Surg Am,2015,97(19):1604-1627.
[20]Lee JS,Lee JS,Rob HL,et al.Alterations in the differentiation ability of mesenchymal stem cells in patients with nontraumatic osteonecrosis of the femoral head:comparative analysis according to the risk factor.J Orthop Res,2006,24(4):604-609.
[21]Mont MA,Jones LC,Hungerford DS.Nontraumatic osteonecrosis of the femoral head:ten years later.J Bone Joint SurgAm,2006,88(5):1117-1132.
[22]Li Y,Jin D,Xie W,et al.PPAR-γ and Wnt regulate the differentiation of MSCs into adipocytes and osteoblasts respectively.Curr Stem Cell Res Ther,2017 Oct 12.[Epub ahead of print]
[23]Fulciniti M,Tassone P,Hideshima T,et al.Anti-DKK1 mAb(BHQ880)as a potential therapeutic agent for multiple myeloma.Blood,2009;114(2):371-379.

