弗雷德盐去除锑矿矿坑废水中的锑*
王宁宁 ,胡 容 ,曹建新 ,章兴华 ,陆 洋
(1.贵州大学化学与化工学院,贵州贵阳550025;2.贵州省分析测试研究院;3.贵州省绿色化工与清洁能源技术重点实验室)
2015年中国锑产量约占世界锑产量的76.7%。锑矿山的开采、选矿和冶炼加工等过程中会排出大量含锑废液、废气和矿渣,它们是当前环境中含锑污染物的主要来源。因此,锑矿山周边河流中的锑含量与矿山有着直接的关系。例如,贵州省独山半坡锑矿自然矿化区水体中Sb质量浓度为82.1~87.8 μg/L;矿坑水的 Sb 质量浓度相对较高(514.6~1 377 μg/L);尾矿库渗滤水的Sb质量浓度为1 427 μg/L;尾矿库渗滤水汇入岔河后水体的Sb质量浓度为31.1~197.6 μg/L[1]。
锑是人体非必需的微量元素,它具有积累毒性和致癌性,其毒性与砷相似[2]。近年来,锑污染越来越为国内外所重视,欧盟规定饮用水中锑的质量浓度不得超过5 μg/L,美国环保局规定饮用水中锑的质量浓度不得超过6 μg/L,日本对饮用水中的锑质量浓度的规定最为严格,为2 μg/L。中国GB 3838—2002《地表水环境质量标准》和《生活饮用水卫生规范》中规定饮用水中锑的质量浓度不得超过5 μg/L。
由于锑在水环境中的存在形态非常复杂,当前应用新技术[3-4](电化学、膜分离技术等)、新材料(离子交换树脂等)等除锑大都处于试验阶段,且操作复杂,成本较高。对于工业大规模含锑废水处理的主流技术仍主要采用混凝沉淀和吸附法除锑[5-7]。这些处理方法虽然对高浓度锑污染均具有一定的去除效果,但都很难既满足低浓度锑污染净化处理达到水质标准要求的同时又兼顾处理的经济性;或者根本就无法对河流等流动水体超过国家饮用水标准的低浓度锑污染实施净化处理。特别是现有吸附剂去除水体中的锑普遍存在 “阴离子吸收边”[8](即吸附剂对锑阴离子的最高吸附区域均在酸性pH范围,一旦由中性进入碱性pH范围,吸附剂对锑阴离子的吸附就急剧下降的现象)[9]。因此,深度去除水体中低浓度锑还需开发低成本和更高效的混凝-吸附材料。
笔者开发了一种用液态含钙聚合铝(PACCa)与石灰乳为原料的氧化物-盐分解沉淀合成弗雷德盐的方法[10],PACCa 中的 Al-Ca 络离子[Ca2Al(OH)6]+作为弗雷德盐的成核中心、在碱性条件下直接与溶液中的 Ca2+、Al3+、Cl-加合生长形成弗雷德盐晶体,省略了第一步的成核反应并加快反应速率,缩短生产周期并由此大幅降低了生产成本。
根据弗雷德盐的层状结构特征,其层间阴离子的可交换性是它有别于其他阳离子黏土矿物的最大特性。笔者拟用这种低成本途径合成的弗雷德盐,以絮凝沉降法对矿坑废水中的锑进行去除研究,探讨弗雷德盐对锑的去除机理,为工业上深度处理含锑废水提供一条新的途径,具有一定的经济意义和环保意义。
1 材料与方法
1.1 弗雷德盐与聚合氯化铝铁制备
实验所用弗雷德盐以文献[10]介绍的氧化物-盐分解沉淀法合成;按 n(Ca)∶n(Al)=3∶1,用含钙聚合铝溶液加入氢氧化钙溶液,在常温与强搅拌条件下导向合成。产品为乳白色浆液,pH约为10.0。实验用氢氧化钙由分析纯石灰水化。
图1为合成的弗雷德盐的SEM照片。由图1可见,合成的弗雷德盐具有六角形片状双羟合体的结构特征,其结构式为[Ca2Al(OH)6]+·[Cl·2H2O]-。

图1 合成弗雷德盐的SEM照片
聚合氯化铝铁(PAFC)的合成,按 n(Al)∶n(Fe)=7∶3,用PACCa溶液加入三氯化铁溶液,在常温与强搅拌条件下合成。产品为黑棕色浆液,pH约为2.5。
1.2 废水性质
矿坑废水样分别于2012年7月和2017年3月取自贵州省某锑矿矿井坑口。废水分析如表1所示。

表1 贵州省某锑矿矿坑废水
1.3 检测与观察
处理前后水的pH用pHS-3C型精密pH计测定。废水处理以ZR4-6型六联搅拌器在150 r/min的速率下搅拌2 min,加入所需药剂,再慢速搅拌5 min,沉降20 min。上层清水立即测定pH并经0.45 μm滤膜抽滤后,用7500a型ICP-MS电感耦合等离子质谱仪测定滤后液中残余的锑浓度。
过滤所得沉淀于100℃下干燥后用于XRD和FT-IR测定。XRD选择X′Pert Powder型X射线衍射仪(Cu靶,仪器光管功率为40 kV,电流为40 mA,扫描角度为 5~90°);FT-IR 选择 Nicolet iS50型傅立叶变换红外光谱仪(分辨率为4cm-1,采样次数64次,以光谱纯 KBr压片测定);SEM观察采用 JSM-6490LV型扫描电镜(加速电压为20 kV);干燥样品用乳钵轻碾后以双面胶黏结于铝台座表面,镀碳膜。弗雷德盐及其含锑絮体的ζ电位测定实验在JS94F型微电泳仪上进行。混凝实验慢速搅拌结束后,不等絮体沉降,吸取少量水样,在微电泳仪上测定絮体微粒的ζ电位。用适宜浓度的HCl和NaOH溶液调节不同的混凝pH,分别测定不同pH条件下弗雷德盐在水中加酸、碱后所得絮体、以及弗雷德盐处理含锑废水所得絮体的ζ电位。
2 实验结果
2.1 弗雷德盐除锑
表2~4分别为弗雷德盐用量、弗雷德盐结合石灰以及弗雷德盐结合PAFC对矿坑废水中Sb去除率的影响。

表2 弗雷德盐用量对矿坑废水中Sb去除率的影响
表2~4的数据表明:直接应用弗雷德盐能够在中性或微碱性pH条件下对矿坑废水中的锑取得很高去除率,原水中锑的质量浓度从1 mg/L左右降至30μg/L 左右,大大低于 GB30770—2014《锡、锑、汞工业污染物排放标准》中工业废水中锑的排放标准(0.3 mg/L),也低于 GB 50282—1998《城市给水工程规划规范》中规定的饮用水水源中锑<50 μg/L的标准。

表3 弗雷德盐结合石灰对Sb去除率的影响
表2、3的数据还表明:随着初始锑浓度的增大,弗雷德盐对锑的去除率保持不变;弗雷德盐辅以助剂石灰,对锑的去除率帮助不明显且会导致出水pH超标;添加助剂PAFC,不但可使锑的去除率提升1%,且可确保出水pH在规定范围。

表4 弗雷德盐结合PAFC对Sb去除率的影响
2.2 弗雷德盐及其除锑絮体的ζ电位随pH的变化

图2 弗雷德盐及其除锑絮体的ζ电位随pH的变化
因为弗雷德盐在 pH>5后稳定[11],本文以弗雷德盐除锑均在中性及碱性区域进行。故而ζ电位测定从pH≥5开始。向弗雷德盐水悬浊液中加酸、碱后所得絮体,以及弗雷德盐处理含锑废水所得絮体的ζ电位测定结果见图2。由图2可见,与文献报道LDHs的ζ电位相一致,弗雷德盐絮体从pH≥5到整个碱性区域的ζ电位均为正值[12]。在pH≥5,弗雷德盐的ζ电位>20 mV,在中性区域ζ电位由20 mV降至10 mV,而在整个碱性区域(pH>8),弗雷德盐的ζ电位为正值,但比较微小。由此说明,水体中OH-浓度的增加与弗雷德盐微粒的静电相互作用只能部分中和其表面正电荷,但尚不足以使其界面电荷反向。
弗雷德盐吸附锑后的絮体的ζ电位从pH=5的8 mV急剧降至pH=5的-5 mV;并在中性至整个碱性区域的ζ电位都保持微小负值不变。由此说明,水体中的Sb(OH)6-与弗雷德盐微粒的静电相互作用很快就使其界面电荷反向;但随后吸附于颗粒表面的Sb(OH)6-与弗雷德盐层间的Cl-产生交换反应,ζ电位保持不变。
2.3 弗雷德盐除锑前后的XRD
实验对弗雷德盐及其含锑沉淀物做了XRD表征,结果见图3,弗雷德盐絮凝除锑前后晶格参数的变化见表5。
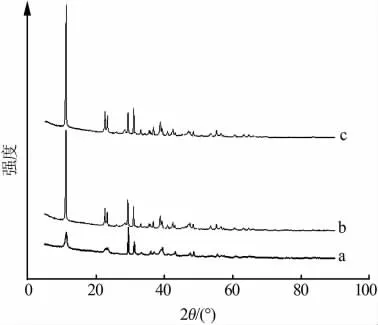
图3 弗雷德盐除锑前后的XRD谱图
由图3a可见,以聚合铝为主要原料,用盐-(羟)氧化物法合成的层状双羟合物弗雷德盐属于氯-碳铝酸盐型亚稳态的单斜[Ca2Al(OH)6]·[Cl1-x·(CO3)x/2·(2+x/2)H2O]固溶体多型[13],(003)峰的 d=0.776 8 nm(2θ=11.39°)。 交换后,除锑沉淀在 2θ=11.27°处的衍射峰得到加强(d=0.785 1 nm)、在 2θ=11.31°处的加石灰样沉淀的衍射峰同样得到加强(d=0.782 1 nm)。XRD谱图证实,弗雷德盐除锑后仍然保持其层状结构,但其层间距的d值全部增大(见表5)。由于Sb(OH)6-的离子半径大于 Cl-,应该是有部分Sb(OH)6-替换Cl-进入到弗雷德盐层间。交换后,弗雷德盐亚稳态的单斜多型的(006)峰 d=0.394 0 nm(22.56°)和 d=0.383 8 nm(23.17°)双峰改变为 d=0.391 8 nm(22.69°)和 d=0.380 5 nm(23.38°),且强度大大增加,沉淀转变为稳定的菱晶[Ca2Al(OH)6]·[Cl1-x·(CO3)x/2·(2+x/2)H2O]固溶体多型[14]。
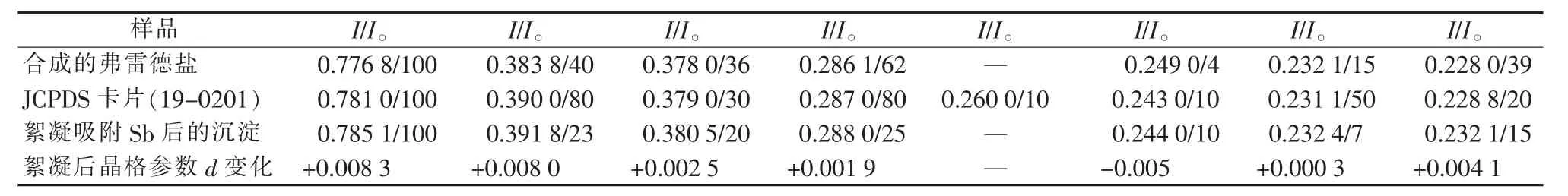
表5 弗雷德盐絮凝除锑前后晶格参数的变化 nm
2.4 弗雷德盐除锑前后的FT-IR
图4为弗雷德盐除锑前后的FT-IR谱图。由图4可以看出,弗雷德盐的1 437 cm-1碳酸根吸收强峰在吸附锑后变弱(曲线b)、而最大变化就是代表弗雷德盐晶格振动的783 cm-1中强峰[15]在交换锑后消失(曲线b和曲线c);由图4还可观察到,弗雷德盐吸附锑后在 640 cm-1和671 cm-1处产生新峰(曲线b)、弗雷德盐加石灰除锑产生的新峰则是在640 cm-1和668 cm-1(曲线c);这些新峰对应于具有八面体结构的合成化合物MSb(OH)6的反对称伸缩振动[27]。 观察到氯-碳铝酸盐多型的(CO3)的对称伸缩振动谱图是在1 086 cm-1处,这是层间碳酸根的特征,与图3中[Ca2Al(OH)6]·[Cl1-x·(CO3)x/2·(2+x/2)H2O]固溶体多型的结果相互印证。在1400 cm-1附近的展宽峰是典型的 (非层间)吸附碳酸盐阴离子的(ν3)O—C—O振动。本研究中弗雷德盐、弗雷德盐除锑沉淀以及弗雷德盐加石灰除锑沉淀3个样品在1 459 cm-1的(ν3)肩峰和 873 cm-1(ν2)处的峰与 XRD谱图证实存在的方解石相符。
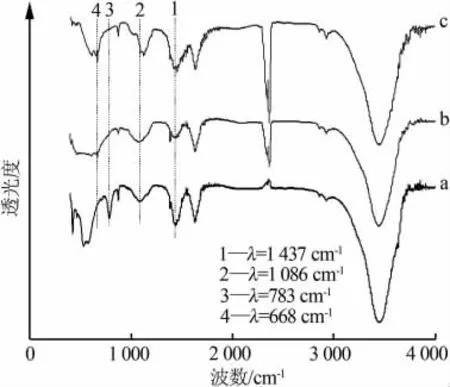
图4 弗雷德盐除锑前后的FT-IR谱图
J.Sejkora等[16]研究了选择性合成锑酸盐的红外光谱,发现在528~775 cm-1区间的峰为SbO单元的伸缩振动;在1 030~1 120 cm-1区间的峰为δ-SbOH单元的变形振动。图3b和图3c表明,弗雷德盐吸附锑后产生 1 038、1 028 cm-1新峰(弱);528~775 cm-1区间的峰与弗雷德盐原有532~588 cm-1峰相互叠加而无法辨认,但可以观察到474~671 cm-1区间的峰明显被展宽增强。
3 弗雷德盐除锑机理讨论
一般而言,锑在氧化性环境中主要以五价锑[Sb(OH)6-]存在,还原性环境中则主要以三价锑[Sb(OH)3、Sb(OH)2+、Sb(OH)4-]形态存在[17];在本研究所选定的碱性区域,水体中的锑绝大部分应该以带负电荷的Sb(OH)6-存在;由于除锑的pH增加至大于9.0,溶液很容易吸收来自空气的CO2并转换成CO32-,结合溶解的Ca2+产生碳酸钙。在实验中Sb(OH)6-与原始的氯碳酸盐型水铝钙石发生下列交换:

在搅拌下,它们与弗雷德盐层间结构中的Cl-·2H2O和CO32-迅速交换而被固定。以上情况使得表3弗雷德盐高效去除水体中锑、图2弗雷德盐吸附锑后沉淀的ζ电位在中性和整个碱性区域ζ电位是微小负值,以及图4中弗雷德盐层间交换锑后代表弗雷德盐晶格振动的783 cm-1中强峰消失和在640、671 cm-1产生对应于MSb(OH)6的反对称伸缩振动(强)峰的支持。
杂质方解石(CaCO3)在 2θ=29.52°(d=0.302 6 nm)的峰大大减弱 (图3b~3c),伴随着弗雷德盐多型(003)衍射峰得到加强的这个事实,可能还有如下交换反应发生:

这也得到图4b弗雷德盐层间交换锑后代表层间碳酸根对称振动的1 086 cm-1峰减弱的支持;相应地,1 437 cm-1碳酸根吸收强峰在吸附锑后变弱了(图4b)。
对于矿坑废水中可能存在的三价锑,由于在pH为2.0~10.0的范围内Sb(Ⅲ)以中性分子的形式存在,它们以分子吸附方式被吸附,因此不会受到电荷的影响。
本文采用弗雷德盐在碱性环境下以动态絮凝的方式去除水体中重金属锑,其第一阶段为氧化-静电吸附阶段:在搅拌条件下用石灰调节含重金属锑水体的pH为8.5~9.0,使其中的Sb3+在氧化态条件下迅速转化为Sb5+生成Sb(OH)6-;或在碱性条件下形成难溶的Sb(OH)3,这样可确保水体中的Sb3+占总锑比例从mg数量级降至μg数量级;第二阶段为离子交换-絮凝沉淀。
加入石灰除锑后的XRD和FT-IR谱图与弗雷德盐单独除锑的完全相似,表明加入的石灰在反应中主要是提供碱度和Ca2+。
4 结论
1)用弗雷德盐除锑,可在中性及碱性区域始终保持对锑≥97%的去除率,与现有多种吸附剂除锑研究呈现的“阴离子吸收边”现象相悖。
2)单独用弗雷德盐可将东峰锑矿矿坑废水中的锑降至 32 μg/L;以弗雷德盐加聚合氯化铝铁(PAFC)絮凝剂组合,可将矿坑废水中的锑降至24.4 μg/L,且可确保出水 pH 为 8.5~9.0。以弗雷德盐除锑,矿坑废水中的残余锑远低于GB 30770—2014《锡、锑、汞工业污染物排放标准》中0.3 mg/L的国家排放标准一个数量级。弗雷德盐是去除锑矿矿坑废水中锑的潜在絮凝-吸附剂。
3)在本研究所选定的碱性区域,水体中的锑绝大部分以带负电荷的Sb(OH)6-存在,它们与弗雷德盐层间结构中的Cl-·2H2O和CO32-迅速进行离子交换而被固定。
致谢:感谢贵州省绿色化工与清洁能源技术重点实验室的支持,感谢贵州大学矿业学院谢飞老师对XRD谱图计算的帮助。
[1] 宁增平,肖唐付,杨菲,等.锑矿区水体水环境锑污染及硫同位素示踪研究[J].矿物岩石地球化学通报,2011,30(2):135-141.
[2] 客绍英,石洪凌,刘冬莲.锑的污染及其毒性效应和生物有效性[J].化学世界,2005,46(6):382-384.
[3] 张家兴,王超,杨波,等.电混凝去除水中锑污染物[J].环境工程学报,2014,8(10):4244-4248.
[4] 陈京晶,张国平,李海霞,等.电化学氢化物发生法处理含锑废水及对锑的回收[J].环境科学,2015,36(4):1338-1344.
[5] 高源,贺维鹏,施周,等.聚硫酸铁强化混凝除锑(Ⅴ)作用机制探讨[J].中国环境科学,2015,35(11):3346-3351.
[6] Dai Chaomeng,Zhou Zhe,Zhou Xuefei,et al.Removal of Sb(Ⅲ)and Sb(Ⅴ) from aqueous solutions using nZVI[J].Water Air Soil Pollut.,2014,225(1799):1-12.
[7] Li Xuehua,Dou Xiaomin,Li Junqing.Antimony(Ⅴ) removal from water by iron-zirconium bimetal oxide:Performance and mechanism[J].环境科学学报:英文版,2012,24(7):1197-1203.
[8] Kang M,Kamei T,Magara Y.Comparing polyaluminum chloride and ferric chloride for antimony removal[J].Water Research,2003,37(17):4171.
[9] Guo Xuejun,Wu Zhijun,He Mengchang.Removal of antimony(Ⅴ)and antimony(Ⅲ)from drinking water by coagulation-flocculationsedimentation (CFS)[J].Water Re search,2009,43(17):4327-4335.
[10] 章兴华,周丽芸.一种生产弗雷德盐的方法:中国,ZL201110048719.9[P].2011-11-28.
[11] Wu Yueying,Chi Ying,Qian Guangren,et al.Effective removal of selenate from aqueous solutions by the Friedel phase[J].Journal of Hazardous Materials,2010,176(1/2/3):193-198.
[12] Xu Zhiping,Jin Yonggang,Liu Shaomin,et al.Surface charging of layered double hydroxides during dynamic interactions of anions at the interfaces[J].Journal of Colloid&Interface Science,2008,326(2):522-529.
[13] Mesbah A,Cau-Dit-Coumes C,Frizon F,et al.A new investigation of the Cl--CO32-,substitution in AFm phases[J].Journal of the American Ceramic Society,2011,94(6):1901-1910.
[14] Adel M,Jean-Philippe R,Michel F,et al.Crystal structures and phasetransitionofcementitiousBi-anionicAFm-(Cl-,CO32-) compounds[J].J.Am.Ceram.Soc.,2011,94(1):261-268.
[15] Laetitia V,Isabelle R,Fabrice L,et al.Hydrocalumite and its polymer derivatives.1.reversible thermal behavior of Friedel′s salt:A direct observation by means of high-temperature in situ powder X-ray diffraction[J].Chem.Mater.,2003,15:4361-4368.
[16] Sejkora J,Ozdin D,Vitáloš J,et al.Schafarzikite from the type locality Pemek (Malé Karpary Mountains,Slovak Republic) revisited[J].European Journal of Mjneralogy,2007:19(3):419-427.
[17] Filella M,Belzile N,Chen Y W.Antimony in the environment:A review focused on natural waters:I.Occurrence[J].ChemInform,2003,34(23):125-176.

