RNA结合蛋白KSRP在急性髓系白血病(AML)M5型细胞中的功能
王小爽,于 姗,何金蓉,余 佳
(中国医学科学院基础医学研究所 北京协和医学院基础学院 生物化学与分子生物学系医学分子生物学国家重点实验室, 北京 100005)
在成体中,造血干细胞(hematopoietic stem cells, HSC)位于一系列多等级不同方向的始祖细胞的顶端,其下游的各种不同定向的始祖细胞经过各自的分化, 最终形成了造血系统中各类具有明确功能的分化末端细胞[1]。多能始祖细胞分为共同淋巴样祖细胞(common lymphoid progenitors, CLP)以及共同髓样祖细胞(common myeloid progenitors, CMP)。CMP进一步分化为巨核系/红系祖细胞(megakaryocyte-erythroid progenitor cells, MEP)以及粒系/单核系祖细胞(granulocyte-macrophage progenitors, GMP)[2]。GMP最终分化产生的中性粒细胞和单核-巨噬细胞对于对抗病原体入侵和识别损伤组织裂解后的细胞碎片非常重要[3]。在这些多级、多向的分化过程中,细胞中也经历了一系列复杂而精细的调控事件,精确而准时地控制细胞的自我更新、增殖和分化。当正常造血分化中的调控发生异常时,常导致血液系统肿瘤的产生,包括急性髓系白血病(acute myeloid leukemia, AML)[4]。本研究旨在分析RNA结合蛋白(RNA binding protein, RBP)KSRP在AML中的表达情况,明确KSRP调控AML发展的机制,从而初步探索KSRP在异常造血中的生物学意义。
1 材料与方法
1.1 材料
Western blot及IP细胞裂解液、DAB辣根过氧化物酶显色试剂盒和BCA蛋白浓度测定试剂盒(碧云天生物技术公司);293T和THP- 1细胞(ATCC)抗兔KSRP抗体[Abcam(上海)公司];抗兔二抗(北京中杉金桥生物技术有限公司);Lipofectamine转染试剂、M-MLV反转录酶、RPMI- 1640、DMEM和进口胎牛血清(Thermo-Fisher公司);RT-qPCR试剂(Takara公司);构建质粒所需的内切酶(NEB公司);细胞增殖(Cell Counting Kit- 8,CCK- 8)和凋亡检测试剂盒(东仁化学科技有限公司);CD14分选磁珠和磁柱(德国美天旎生物公司);EasySepTMHuman Neutrophil Enrichment Kit(Stemcell公司); ApoLive-GloTMMultiplex Assay (Promega公司)。
1.2 方法
1.2.1 外周血中性粒细胞和单核细胞的分离:采用正常人外周血白细胞层样品(50 mL)。本研究已获得中国医学科学院基础医学研究所伦理委员会的批准书,由于使用的是血液中心的报废样品,已经申请免除知情同意书。
利用Ficoll分离白细胞样品,随后利用CD14分选磁珠对淋巴细胞-单核细胞层的细胞进行阳性筛选,将分选得到的细胞在含有10%胎牛血清的RPMI1640培养基中培养4~6 h,收集贴壁细胞。对于红细胞-粒细胞层,裂解红细胞后300×g离心收集细胞沉淀。随后利用EasySepTMHuman Neutrophil Enrichment Kit中的磁珠和抗体进行分选,收集阴性筛选得到的细胞。
1.2.2 实时荧光定量PCR(RT-qPCR)检测mRNA:Trizol法提取细胞总RNA。测定RNA样品的浓度和纯度,A260/A280值在1.80~2.00。M-MLV合成cDNA第一链。使用3’-磷酸甘油醛脱氢酶(GAPDH)为相对定量的内参基因,每个样品实验设计3个复孔,检测总体积为20 μL。程序如下:94 ℃ 10 s;58 ℃ 10 s,72 ℃ 20 s,共50个循环;94 ℃ 15 s,64 ℃~94 ℃,缓慢升温,产生熔解解离曲线。RT-qPCR用到的引物见表1。

表1 RT-qPCR扩增引物序列Table 1 Primers for RT-qPCR
1.2.3 重组质粒的构建
1.2.3.1 miRNA过表达载体的构建:从基因组模板中PCR扩增700 bp左右的miR- 129初级转录本,切胶回收目的片段。将pMIRNA1空载体和纯化得到的PCR产物进行双酶切,切胶回收酶切好的载体片段和目的DNA片段,进行连接。
1.2.3.2 shRNA载体的构建:通过shRNA干扰片段在线设计网站http://rnaidesigner.thermofisher.com/rnaiexpress/以及KSRP的干扰序列,设计两条shRNA,并在shRNA两端连接相应的酶切位点黏性末端。序列由天一辉远生物技术有限公司合成。合成的片段退火,退火得到的片段与pSIH-H1载体连接。
1.2.4 细胞系培养:将THP- 1细胞悬于 RPMI1640完全培养基(10%胎牛血清)中,293T细胞放入DMEM完全培养基(10%胎牛血清)中,细胞在37 ℃、5% CO2饱和湿度的细胞培养箱中培养。
1.2.5 慢病毒制备和细胞感染:使用Lipofectamine LTX转染293T细胞,48 h后,收集培养上清。0.45 μm滤膜过滤,4 ℃、20 000 r/min离心2.5 h,进行病毒颗粒的收集。弃上清,使用下游感染所需细胞培养基重悬病毒颗粒并分装,冻存于-80 ℃。慢病毒感染当天,将THP- 1细胞铺入6孔板。将病毒液加入细胞中,然后加入polybrene。细胞孵育过夜,感染12~16 h后,更换新鲜完全培养基。
1.2.6 Western blot检测KSRP蛋白:收集细胞并使用Western及IP细胞裂解液提取总蛋白,BCA法测定蛋白浓度。SDS-PAGE分离蛋白样品,每个样品上样量为20 μg。随后将蛋白转印到PVDF膜上,5%脱脂牛奶室温封闭2 h。加入抗兔KSRP一抗孵育过夜,随后加入抗兔二抗,室温孵育1 h。DAB法显影,分析蛋白表达。
1.2.7 CCK8法检测细胞增殖:在96孔板中配置100 μL的细胞悬液,每孔的细胞数量为3 000~5 000个。将培养板在培养箱预培养24 h(37℃,5% CO2)。向培养板加入10 μL CCK8,在培养箱孵育4 h,不要在孔中生成气泡。用酶标仪测定在450 nm处的吸光度值。
1.2.8 流式细胞术检测细胞凋亡:将PBS清洗后的细胞重悬于100 μL的1×结合缓冲液中,分别加入加5 μL 荧光标记的Annexin V和PI染色液。室温避光孵育15 min。细胞滤网过滤去掉成团的细胞,然后快速上流式细胞仪BD Accuri C6检测,结果使用C6的软件进行分析。
1.2.9 ApoLive-GloTMMultiplex Assay试剂盒检测细胞凋亡:在96孔板中配置100 μL的细胞悬液,每孔的细胞数量为3 000~5 000个。培养细胞72 h后,每孔加入20 μL活性检测试剂。水平轻微震荡后,在培养箱预培养30 min(37 ℃,5% CO2),检测在400 nm激发光/505 nm发射光处的吸光度值。每孔加入100 μL Caspase-Glo® 3/7 Reagent,水平轻微震荡后,在培养箱预培养30 min(37 ℃,5% CO2),检测萤光。
1.3 统计学分析

2 结果
2.1 KSRP在外周血中性粒细胞和单核细胞中表达不同
取3名正常人外周血的中性粒和单核细胞。KSRP mRNA在其中2名中具有相似的表达情况,即在中性粒细胞中的表达显著高于单核细胞(P<0.05)(图1)。在#3中KSRP呈现在单核细胞和中性粒细胞中几乎相同的表达水平。由于KSRP在髓系细胞中促进miR- 129的加工[5],进而在这3名正常人样品中检测了miR- 129的表达,发现其表达在2名正常人样本中均与KSRP一致(P<0.001)(图1)。

*P<0.05, **P<0.001 compared with monocytes图1 KSRP和miR- 129在中性粒细胞和单核细胞中的表达Fig 1 KSRP和miR- 129 expression in granulocytes and n=3)
2.2 KSRP在特定AML群体中具有表达差异
KSRP在中性粒细胞和单核细胞中的显著变化提示该蛋白可能在不同类型的AML中具有差异表达,因而在最常见4类异常核型AML、正常核型AML(normal)和正常对照(NC)中分析KSRP的表达。首先利用同一个实验室来源的GSE34184和GSE30285两套数据,发现KSRP在4类核型异常AML患者中均异常上调。并且KSRP在混合谱系白血病(MLL)易位AML(M5型)中的表达水平显著高于t(15;17) 急性早幼粒细胞白血病(APL)患者(图2)。利用Bloodspot的数据进一步分析[6],发现与正常对照相比,KSRP仅在MLL易位AML(包括M4和M5型)中显著上调,并且KSRP在t(15;17) APL中的表达水平显著低于其在MLL易位和t(8;21)病例中的表达(图2)。最后,在包括了GSE13159、GSE15434、 GSE61804、GSE14468和TCGA 5个数据集合共1 299例AML患者的Bloodpool数据库中进一步分析KSRP的表达,发现在t(15;17) APL中KSRP的表达水平显著低于其他类型AML(图2)。综上,KSRP在t(15;17) APL中低表达,而在MLL易位的急性单核细胞白血病或急性粒-单核细胞白血病中高表达。

KSRP expression analyzed in GSE34184 and GSE30295(A), bloodspot(B), bloodspool(C) database, respectively;*P<0.05,**P<0.01,***P<0.001,****P<0.0001 compared with the indicated controls
图2KSRP在AML患者中的表达

2.3 抑制内源KSRP的表达减缓了AML细胞的增殖
KSRP可能在AML-M5型中发挥原癌基因的功能,因此利用AML-M5来源的THP- 1细胞进行功能研究。在THP- 1细胞中,构建的两条位点特异的shRNA均能显著在蛋白和RNA水平抑制KSRP的表达(P<0.05)(图3),可以用于后续功能实验。抑制KSRP的表达导致THP- 1细胞增殖受阻(P<0.01),凋亡显著增加(P<0.01)(图4)。

*P<0.05, **P<0.01 compared with pSIH
2.4 过表达miR- 129促进了AML细胞的增殖
由于miR- 129位于KSRP下游,miR- 129可能与KSRP具有相似的功能。在THP- 1细胞中过表达miR- 129,使细胞中miR- 129的水平显著增加(图5A)。随后分两步分别检测存活细胞的数量以及以caspase活性为标志的细胞凋亡。结果显示培养72 h后,miR- 129显著促进了细胞增殖(P<0.05)(图5B),但是对细胞凋亡的影响不显著(图5C)。

*P<0.01, **P<0.001 compared with pSIH图4 KSRP对THP- 1增殖和凋亡的影响Fig 4 Effect of KSRP on cell proliferation and apoptosis in THP- 1 n=3)
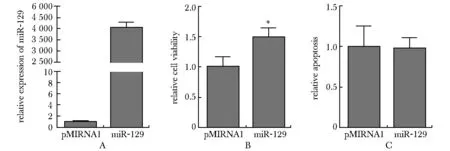
A.analysis of miR- 129 expression in THP- 1 cells; B.miR- 129 overexpression promoted cell viability; C.cell apoptosis was not affected by miR- 129 overexpression;*P<0.05 compared with pMIRNA1
图5miR-129对THP-1增殖和凋亡的影响

3 讨论
在过去十几年中, 人们对转录后调控网络的认识逐渐深入, RBP位于这一网络的中心位置。RBP参与RNA加工的多个过程,包括选择性剪接、RNA转运和稳定性维持、RNA定位以及mRNA的翻译等[7]。根据RBP结合的RNA或者发挥作用的生物环境不同,RBP的调控作用可能是正向或者负向的。研究发现RBP的表达变化或者RNA结合位点的突变可以导致多种疾病,包括遗传疾病、神经系统疾病以及癌症[8]。研究发现KSRP能够促进CD34+造血干/祖细胞的粒系分化而抑制单核分化,并且KSRP通过促进miR- 129初级转录本的加工而发挥其在髓系分化中的调控功能[5]。在免疫系统中的研究也发现KSRP可以通过其KH结构域的结合促进一系列miRNA的成熟,并且KSRP这种调控可能发生在miRNA初级转录本或前体两个阶段[9- 10]。
在本研究中,KSRP与miR- 129均在中性粒细胞中显著高表达于单核细胞。在AML病例中的调查发现,与正常对照相比,KSRP在MLL易位的M4和M5型AML中稳定地高表达;相反地,t(15;17) APL中KSRP的表达总是低于其他类型的AML。临床诊断上M4和M5型AML主要表现为原始或幼稚单核细胞异常增加[11],因而KSRP的异常高表达可能与单核细胞AML的发生相关。对KSRP的功能研究发现KSRP能够促进THP- 1的增殖,并且miR- 129在THP- 1中的功能与KSRP相似。综上,KSRP可能通过促进miR- 129的成熟增加AML- M5细胞的增殖能力,从而发挥原癌基因的功能。
:
[1] Morrison SJ, Kimble J. Asymmetric and symmetric stem-cell divisions in development and cancer [J]. Nature, 2006, 441: 1068- 1074.
[2] Fernandez KS, De Alarcon PA. Development of the hematopoietic system and disorders of hematopoiesis that present during infancy and early childhood [J]. Pediatr Clin North Am, 2013, 60: 1273- 1289.
[3] Alvarez-Errico D, Vento-Tormo R, Sieweke M,etal. Epigenetic control of myeloid cell differentiation, identity and function [J]. Nat Rev Immunol, 2015, 15:7- 17.
[4] Friedman AD. Transcriptional control of granulocyte and monocyte development [J]. Oncogene, 2007, 26:6816- 6828.
[5] Zhao H, Wang X, Yi P,etal. KSRP specifies monocytic and granulocytic differentiation through regulating miR- 129 biogenesis and RUNX1 expression [J]. Nat Commun,2017, 8:1428.
[6] Bagger FO, Sasivarevic D, Sohi SH,etal. BloodSpot: a database of gene expression profiles and transcriptional programs for healthy and malignant haematopoiesis[J]. Nucleic Acids Res, 2016, 44:917- 924.
[7] Ye J, Blelloch R. Regulation of pluripotency by RNA binding proteins [J]. Cell Stem Cell, 2014, 15: 271- 280.
[8] Ciafre SA, Galardi S. microRNAs and RNA-binding proteins: a complex network of interactions and reciprocal regulations in cancer[J]. RNA Biology, 2013, 10: 935- 942.
[9] Nicastro G, García-Mayoral MF, Hollingworth D,etal. Noncanonical G recognition mediates KSRP regulation of let- 7 biogenesis[J]. Nat Struct Mol Biol, 2012, 19:1282- 1286.
[10] Ruggiero T, Trabucchi M, De Santa F,etal. LPS in-duces KH-type splicing regulatory protein-dependent processing of microRNA- 155 precursors in macrophages[J]. FASEB J, 2009, 23:2898- 2908.
[11] Arber DA, Orazi A, Hasserjian R,etal. The 2016 revision to the World Health Organization classification of myeloid neoplasms and acute leukemia[J]. Blood, 2016, 127:2391- 2405.

