微波-超声联合提取参数对黄秋葵多糖和黄酮得率的影响
刘春菊, 王海鸥, 唐明霞, 李大婧, 刘春泉, 张钟元, 江 宁, 牛丽影, 袁春新
(1.江苏省农业科学院农产品加工研究所,江苏南京 210014; 2.国家蔬菜加工技术研发专业分中心,江苏南京 210014;3.南京晓庄学院食品科学学院,江苏南京 211171; 4.江苏沿江地区农业科学研究所,江苏如皋 226541)
黄秋葵[Abelmoschusesculentus(L.) Moench]是锦葵科秋葵属一年生草本植物,被誉为素菜之王,富含蛋白质、维生素、矿物质等营养物质及多糖、黄酮、果胶、锌和硒等功能成分,具有抗氧化、防止衰老、抗肿瘤、降血脂等作用,具有较高的食用价值和药用价值[1-3]。随着黄秋葵的特殊食用、药用功效日渐被人们认识和了解,受到了许多专家学者的极大关注,其中在黄秋葵多糖和黄酮方面的研究表现得尤为突出。国内外研究发现,黄秋葵中含有一种黏性多糖,它是由阿拉伯糖、半乳糖、鼠李糖等构成的多糖与蛋白质形成的共价复合物,具有助消化、增强免疫力、抗肿瘤、降血脂等功效[4-5]。黄秋葵还富含黄酮类化合物,黄酮类物质是公认的天然抗氧化剂,具有降脂、抗心血管疾病、消除自由基以及抗氧化、抗骨质疏松、防癌抗癌等作用[6]。
植物中多糖和黄酮类化合物的提取方法主要包括沸水浸提法、微波辅助提取法、超声辅助提取法。近年来,微波、超声辅助提取技术在植物有效成分提取方面的应用广泛,超声波可利用其空化效应加快介质分子的运动速度,从而使可溶性活性成分迅速溶出[7]。微波辅助提取主要利用介电加热和离子传导作用,即利用离子在微波作用下的剧烈运动,使物质中的成分溢出,从而达到快速提取的目的。微波、超声辅助提取都具有溶剂用量少、提取时间短、提取温度低等优点[8],但一般都是单独辅助提取1种有效成分,联合2种技术提取2种以上有效成分的研究尚未见报道,因此,本研究以黄秋葵老蒴果为原料,采用微波-超声辅助技术联合提取黄秋葵中的多糖和黄酮,研究微波提取料液比、微波提取功率、微波提取时间、超声提取乙醇体积分数、超声提取料液比、超声提取功率、超声提取温度、超声提取时间对黄秋葵多糖和黄酮得率的影响,以期为黄秋葵功能活性物质的综合提取提供技术支撑和理论依据。
1 材料与方法
1.1 材料
黄秋葵品种为卡里巴,于2016年10月采自南通盛泰农业发展有限公司黄秋葵种植基地,选取不能食用的黄秋葵老蒴果作为试验样品。
1.2 仪器与试剂
UV-6300型紫外可见分光光度计(上海美谱达仪器有限公司);BS224S电子分析天平(北京赛多利斯科学仪器公司);TG16-WS台式高速离心机(湖南长沙湘仪离心机仪器有限公司);WP800SL23-2格兰仕微波炉(佛山市顺德区格兰仕微波炉电器有限公司);KQ-S1000VDE型三频数控超声波清洗机(昆山市超声仪器有限公司);真空冷冻干燥机(江苏博莱客冷冻科技发展有限公司);FW100高速万能粉碎机(天津市泰斯特仪器有限公司);HH-8恒温水浴锅(金坛市环保仪器厂)。葡萄糖、芸香苷标准品购于中国药品生物制品检定所;无水乙醇、氢氧化钠、亚硝酸钠、硝酸铝、蒽酮、硫酸等均为分析纯。
1.3 黄秋葵冻干粉制备
当天采摘的黄秋葵老蒴果经过清洗、切片后,平铺于物料盘上,将冷冻盘放入冷冻干燥设备中,当物料温度达到-30~-40 ℃时冷冻1~2 h,抽真空直至冻干仓真空度达到30 Pa以下,打开加热板开关,进行真空冷冻干燥,待黄秋葵中心温度与加热板温度一致时干燥结束。将冻干黄秋葵采用粉碎机研磨成粉,过80目筛,获得黄秋葵冻干粉,置于-20 ℃环境中低温保存。
1.4 微波-超声联合提取工艺
准确称取黄秋葵冻干粉0.20 g,以料液比1 g ∶100 mL加入蒸馏水混匀,用528 W微波功率提取4 min,每次20 s,中间停2 min,微波提取后离心,获得上清液1和沉淀1。在上清液1中加入无水乙醇,使乙醇浓度达到80%,置于4 ℃冰箱中静置过夜,离心后弃去上清液获得沉淀2,取沉淀2用适量蒸馏水溶解,定容后获得多糖提取液。向沉淀1中以料液比1 g ∶30 mL加入70%乙醇溶液,混匀后以超声波功率 600 W,70 ℃超声40 min,离心得到上清液2,然后用70%乙醇定容后获得黄酮提取液。
1.5 多糖和黄酮测定方法
采用蒽酮-硫酸比色方法[9]测定多糖的含量;采用亚硫酸钠-硝酸铝分光光度方法[10]测定黄酮的含量。测得提取液多糖、黄酮含量后,按照式(1)计算多糖、黄酮得率:

(1)
式中:m1为多糖或黄酮提取液中多糖或黄酮含量,g;m为黄秋葵粉的质量,g。
1.6 试验设计
固定基本提取参数,分别考虑微波提取料液比(1 g ∶50 mL、1 g ∶75 mL、1 g ∶100 mL、1 g ∶125 mL、1 g ∶150 mL)、微波提取功率(136、320、528、680、760 W)、微波提取时间(2、3、4、5、6 min)、超声提取乙醇体积分数(50%、60%、70%、80%、90%)、超声提取料液比(1 g ∶10 mL、1 g ∶20 mL、1 g ∶30 mL、1 g ∶40 mL、1 g ∶50 mL)、超声提取功率(400、600、800、1 000 W)、超声提取温度(40、50、60、70、80 ℃)、超声提取时间(20、30、40、50、60 min)。
1.7 数据处理
所有数据采用SPSS 19.0统计软件进行单因素方差分析(One-way ANOVA),由Tukey分析均值差异的显著性,显著水平0.05。
2 结果与分析
2.1 微波提取料液比对黄秋葵多糖、黄酮得率的影响
由表1可以看出,随着料液比的增加,黄秋葵多糖得率整体呈增加趋势,在料液比达到1 g ∶100 mL时多糖得率最高,为2.95%,料液比从1 g ∶50 mL增加到1 g ∶100 mL,多糖得率提高0.8倍,料液比继续增加,多糖得率变化不显著(P>0.05),这可能是因为随着料液比的增加,黄秋葵中多糖的扩散速度逐渐增大,提取液的黏度逐渐减小,对多糖的溶出起促进作用[11]。此外,随着蒸馏水添加量的增加,过多的蒸馏水使其他杂质大量溶出,使多糖得率变化不大[9]。随着料液比的增加,黄酮的得率逐渐下降,这可能是由于随着微波提取料液比的增加,溶出的多糖得率增加,少量黄酮也会随之溶出,造成沉淀中的黄酮量减少,导致黄酮得率逐渐降低。综合考虑多糖得率和黄酮得率,将微波提取料液比确定为 1 g ∶100 mL 较为合适。

表1 微波提取料液比对黄秋葵多糖、黄酮得率的影响
注:同列数据后不同小写字母表示处理间差异显著(P<0.05)。下表同。
2.2 微波提取功率对黄秋葵多糖、黄酮得率的影响
从表2可以看出,黄秋葵多糖得率整体上随着微波功率的增大而增加,当微波功率达到528 W后,随着微波功率的继续增大,多糖得率变化不显著(P>0.05),微波功率从 136 W 增大到528 W,多糖得率提高0.3倍,可能是由于微波辐射使得黄秋葵的细胞遭到破坏,多糖容易溶出,随着微波功率的增大,温度升高,分子的运动速度加快,部分多糖在高温条件下发生水解[12]。黄酮得率随着微波功率的增大而增加,这可能是由于微波功率增大对细胞产生的破坏,在超声提取时可促使黄酮溶出量的增加[13]。因此,确定最佳微波提取功率为528 W。

表2 微波提取功率对黄秋葵多糖、黄酮得率的影响
2.3 微波提取时间对黄秋葵多糖、黄酮得率的影响
从表3可以看出,随着微波提取时间的增加,黄秋葵多糖得率呈先增加后减少的变化趋势,当微波提取时间为4 min时,多糖得率达到最大值,提取时间继续增加,多糖得率有所减少;随着微波提取时间的增加,黄酮得率呈先增加后减少的变化趋势,在提取时间为4 min时黄酮得率达到最大值,继续增加提取时间,黄酮得率急剧下降,微波提取时间从2 min增加到4 min,多糖得率和黄酮得率都提高0.4倍。这可能是由于短时间内的微波辐射对细胞的破碎作用较大,使得多糖溶出较多,较长时间的微波辐射使多糖的稳定性下降[14],并且随着提取时间的延长,细胞破碎得更完全,其他物质也同时被提取出来[15]。因此,微波提取时间为4 min时黄秋葵多糖、黄酮得率最高。

表3 微波提取时间对黄秋葵多糖、黄酮得率的影响
2.4 超声提取乙醇体积分数对黄秋葵黄酮得率的影响
从表4可以看出,随着乙醇体积分数的增加,黄秋葵黄酮得率先增加后减少,在乙醇体积分数为80%时,黄酮得率达到最大值,这与孙鲜明等从流苏花中超声提取总黄酮的研究结果[16]一致。这可能是由于黄酮类化合物具有较高的极性,乙醇体积分数的增加可使黄酮更好地溶出[13]。但当乙醇体积分数超过80%后,黄酮类化合物达到饱和,同时一些亲脂性杂质成分的溶出量增加,这些成分与黄酮类化合物竞争性溶出,从而导致黄酮类化合物得率下降[17]。因此,最佳超声提取乙醇体积分数为80%。

表4 超声提取乙醇体积分数对黄秋葵黄酮得率的影响
2.5 超声提取料液比对黄秋葵黄酮得率的影响
从表5可以看出,黄秋葵黄酮得率整体上随着超声提取料液比的增加而增加,当料液比达到1 g ∶20 mL时,黄酮得率达到最大值,料液比从1 g ∶10 mL增加到1 g ∶20 mL,黄酮得率提高0.3倍,继续增加料液比,黄酮得率变化不显著(P>0.05),这可能由于随着料液比的增加,黄酮类物质与乙醇溶液的接触面积增大,从而使得黄酮类物质可以充分溶解出来,但料液比的继续增加,可使除了黄酮以外的杂质也被溶解出来,对黄酮得率产生影响[15]。综合考虑,确定的最佳超声提取料液比为1 g ∶20 mL。

表5 超声提取料液比对黄秋葵黄酮得率的影响
2.6 超声提取功率对黄秋葵黄酮得率的影响
从表6可以看出,黄秋葵黄酮得率整体随着超声提取功率的增大而增加,在800 W时达到最大值,超声功率从400 W增大到800 W,黄酮得率提高0.2倍,继续增加超声功率,黄酮得率变化不显著(P>0.05)。这可能是由于随着超声功率的增大,黄秋葵细胞壁的破损程度增大,在800 W后黄秋葵中的细胞组织已全部破碎变形,黄秋葵中黄酮几乎全部被提取出来,使得继续增大提取功率时黄酮的提取率变化不显著(P>0.05)。综合考虑超声提取功率为800 W较合适。

表6 超声提取功率对黄秋葵黄酮得率的影响
2.7 超声提取温度对黄秋葵黄酮得率的影响
从表7可以看出,黄秋葵黄酮得率整体上随着超声提取温度的升高先增加后减少,在温度为70 ℃时达到最大值,提取温度从40 ℃升高到70 ℃,黄酮得率提高0.4倍,继续增加提取温度,黄酮得率下降,这可能是由于黄酮在乙醇中的溶解度在一定范围内随温度的升高而增加,同时由于温度逐渐升高,提取液黏度减小,扩散系数增加,促使提取速度加快[18],但过高的温度容易使黄酮类化合物氧化,并且其他杂质的溶出也会增多。因此,最佳超声提取温度为70 ℃。
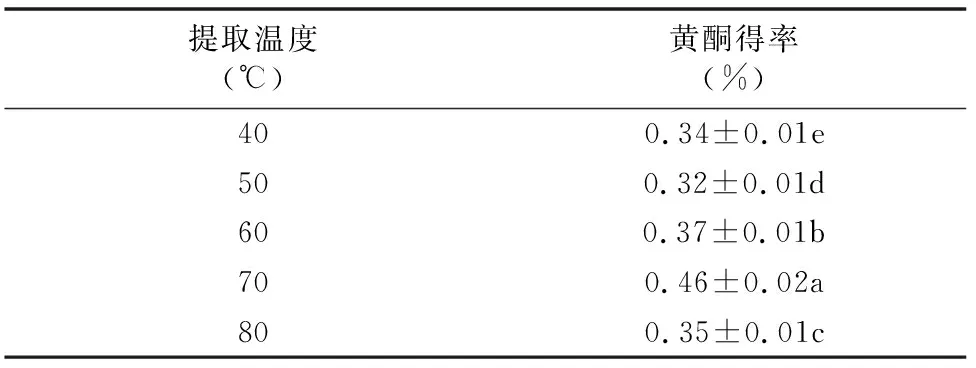
表7 超声提取温度对黄秋葵黄酮得率的影响
2.8 超声提取时间对黄秋葵黄酮得率的影响
从表8可以看出,黄秋葵黄酮得率整体上随着超声提取时间的增加而增加,在提取时间为50 min时达到最大值,提取时间从20 min增加到50 min,黄酮得率提高0.3倍,继续增加超声时间,黄酮得率变化不明显。这可能是由于在一定范围内增加提取时间,可以使黄秋葵原料与乙醇的接触时间增加,从而使黄酮在溶液中的溶解度增加,当超声时间超过50 min时,溶质大量挥发,原料中的其他醇溶性物质也会被溶解并提取出来,对黄酮的提取与测定产生影响[19]。因此,超声提取时间为50 min较合适。

表8 超声提取时间对黄秋葵黄酮得率的影响
3 结论
不同微波提取参数对黄秋葵多糖、黄酮得率具有明显影响,其中黄秋葵多糖得率随着微波提取料液比的增加整体呈增加趋势,从1 g ∶50 mL增加到1 g ∶100 mL,多糖得率提高0.8倍;黄酮得率随着微波提取料液比的增加而逐渐减少。黄秋葵多糖、黄酮得率整体上随着微波提取功率的增大而增加,其中微波功率从136 W增加到528 W,多糖得率提高0.3倍。随着微波提取时间的增加,黄秋葵多糖、黄酮得率先增加后减少,当提取时间为4 min时,达到最大值。
不同超声提取参数对黄秋葵黄酮得率影响明显,随着超声提取乙醇体积分数的增加,黄秋葵黄酮得率先增加后减少,当乙醇体积分数为80%时,黄酮得率达到最大值;黄秋葵黄酮得率整体上随着超声提取料液比的增加而增加,从料液比 1 g ∶10 mL 增加到1 g ∶20 mL,黄酮得率提高0.3倍;随着超声提取功率的增加,黄秋葵黄酮得率整体呈增加趋势,超声功率从400 W增加到800 W,黄酮得率提高0.2倍;随着超声提取温度的增加,黄秋葵黄酮得率先增加后减少,当温度为 70 ℃ 时,黄酮得率达到最大值;随着超声提取时间的增加,黄秋葵黄酮得率整体呈增加趋势,当提取时间为50 min时,达到最大值。
微波-超声联合提取黄秋葵多糖和黄酮的最佳工艺:微波提取料液比为1 g ∶100 mL,微波提取功率为528 W,微波提取时间为4 min,超声提取乙醇体积分数为80%,超声提取料液比为1 g ∶20 mL,超声提取功率为800 W,超声提取温度为70 ℃,超声提取时间为50 min。
:
[1]Gemede H F,Ratta N,Haki G D,et al. Nutritional quality and health benefits of okra(Abelmoschusesculentus):a review[J]. J Food Process Techno,2015,25(1):16-25.
[2]Singh N,Singh D K,Pandey P,et al. Correlation and path coefficient studies in okra[Abelmoschusesculentus(L.) Moench][J]. Int J Curr Microbiol App Sci,2017,6(7):1096-1101.
[3]周兆祥,白石琦,邹 烨,等. 黄秋葵茶叶的成分分析及其水提物的抗氧化活性测定[J]. 江苏大学学报(医学版),2015,25(3):260-262.
[4]Chen H R,Jiao H W,Cheng Y,et al.Invitroandinvivoimmunomodulatory activity of okra (AbelmoschusesculentusL.) polysaccharides[J]. Journal of Medicinal Food,2016,19(3):253-265.
[5]任丹丹. 黄秋葵多糖提取纯化及其体外结合胆酸能力和抑制肿瘤活性分析[D]. 广州:华南理工大学,2011.
[6]胡 帅,张 骋,李 强,等. 不同黄秋葵花中总黄酮的提取和含量测定[J]. 激光生物学报,2013,22(4):375-378.
[7]Duan Z H,Li Y L,Wang J L. Study on the technology of extraction protein of fish swim bladder with ultrasonic treatment[J]. Advanced Materials Research,2012,396/367/368:1413-1416.
[8]付志红,谢明勇,聂少平. 微波技术用于车前子多糖的提取[J]. 食品科学,2005,26(3):151-154.
[9]王振宇,孙 芳,刘 荣. 微波辅助提取松仁多糖的工艺研究[J]. 食品工业科技,2006,9(9):133-135,139.
[10]郑 义,邵 颖,陈安徽,等. 益智仁总黄酮超声辅助提取工艺优化及其抗氧化活性[J]. 食品科学,2014,35(6):44-49.
[11]刘怡彤,段振华,马华林,等. 超声波辅助提取黄秋葵多酚和多糖的工艺研究[J]. 食品工业科技,2013,34(21):247-249,253.
[12]崔凤杰,许泓瑜,舒 畅,等. 响应曲面法优化灰树花水溶性多糖提取工艺的研究[J]. 食品科学,2006,27(4):142-147.
[13]林建原,季丽红. 响应面优化银杏叶中黄酮的提取工艺[J]. 中国食品学报,2013,13(2):83-90.
[14]王晓君,王维香. 川麦冬多糖的微波提取[J]. 食品工业科技,2007,4(4):128-129,132.
[15]魏凤华,倪 艳,宋 强,等. 响应曲面法优化葛根总黄酮的提取工艺研究[J]. 世界科学技术-中医药现代化,2015,17(1):261-266.
[16]孙鲜明,李小方,邓瑞雪,等. 流苏花总黄酮超声提取工艺及抗氧化活性研究[J]. 食品工业科技,2015,36(16):266-271,278.
[17]寇 亮,李 璐,陆丽娜,等. 响应面法优化柠条锦鸡儿总黄酮超声提取工艺及其体外抗氧化性研究[J]. 食品工业科技,2016,37(17):225-231.
[18]冯宗帅,吴彩娥,方升佐,等. 青钱柳叶总黄酮超声辅助提取工艺优化[J]. 农业机械学报,2009,40(2):130-134,75.
[19]孙 美,黄艳菲,赵小燕,等. 响应曲面法优化荞麦总黄酮的提取工艺[J]. 现代食品科技,2012,12(12):1714-1718,1742.

