大孔树脂联合硅胶柱纯化核桃枝中胡桃醌的条件
吴 琴, 丁 杰
(四川理工学院化学工程学院,四川自贡 643000)
核桃,又名胡桃,胡桃科属,《本草纲目》中记载到,核桃除果仁可以食用外,其青皮、枝皮、壳等部位都可作药用[1]。胡桃醌,又名核桃醌,是一种存在于核桃枝皮、核桃青果皮等部位的活性物质,具有抗肿瘤[2]、抗癌[3]、抑菌[4]、杀虫[5]等多种生物活性。近年来,关于核桃中胡桃醌的研究报道较多,主要集中在对核桃壳、青果皮等部位的研究。郭瑜等采用超声波辅助提取结合响应面法分析核桃壳中的胡桃醌,得到最佳提取条件为:温度45 ℃,时间1.4 h,超声功率250 W,料液比1 g ∶24 mL,在此条件下核桃壳中胡桃醌的提取率为 8.150 3%[6]。冯迟等以青果皮为原料,通过单因素试验优选出胡桃醌的最佳提取工艺,其提取率可达1.72 mg/g[7]。马乐等采用D101大孔树脂来纯化核桃青皮中的胡桃醌,利用HPLC鉴定和分析纯度,结果表明,D101大孔树脂对胡桃醌具有较好的分离纯化效果[8]。而许绍慧等通过对核桃枝皮中化学成分的研究,发现胡桃醌在其中的含量相对较高,达到1 g ∶(2.5~50.4) kg(鲜质量)[9]。为更好利用核桃枝皮资源,提高胡桃醌的药用和经济价值,本研究以核桃枝为原料,拟采用大孔树脂联合硅胶柱对胡桃醌进行富集纯化,通过单因素试验优选纯化胡桃醌的工艺条件,对综合利用和合理开发核桃枝具有指导意义。
1 材料与方法
1.1 材料与试剂
核桃枝采自四川省内江市资中县;胡桃醌对照品,上海阿拉丁生化科技股份有限公司;D101、HPD-300、HPD-100、HPD-600、NKA-9、DM301大孔树脂,北京英莱克科技发展有限公司;95%乙醇、乙酸乙酯、甲醇(分析纯)等试剂均购自成都市科龙化工试剂厂。
1.2 仪器与设备
玻璃柱(2.6 cm×30.5 cm、1.7 cm×30.5 cm),北京欣维尔;OSB-2100旋转蒸发仪,上海爱朗仪器有限公司;KQ-300E超声波清洗器,昆山市超声仪器有限公司;恒温培养摇床,武汉瑞华仪器设备有限公司;UV-1800PC紫外可见分光光度计,翱艺仪器(上海)有限公司;CP114电子分析天平,奥豪斯仪器(上海)有限公司;LC3000型高效液相色谱仪,创新通恒科技有限公司;色谱柱:Welchrom C18柱(4.6 mm×250 mm,5 μm)。
1.3 胡桃醌标准曲线的建立
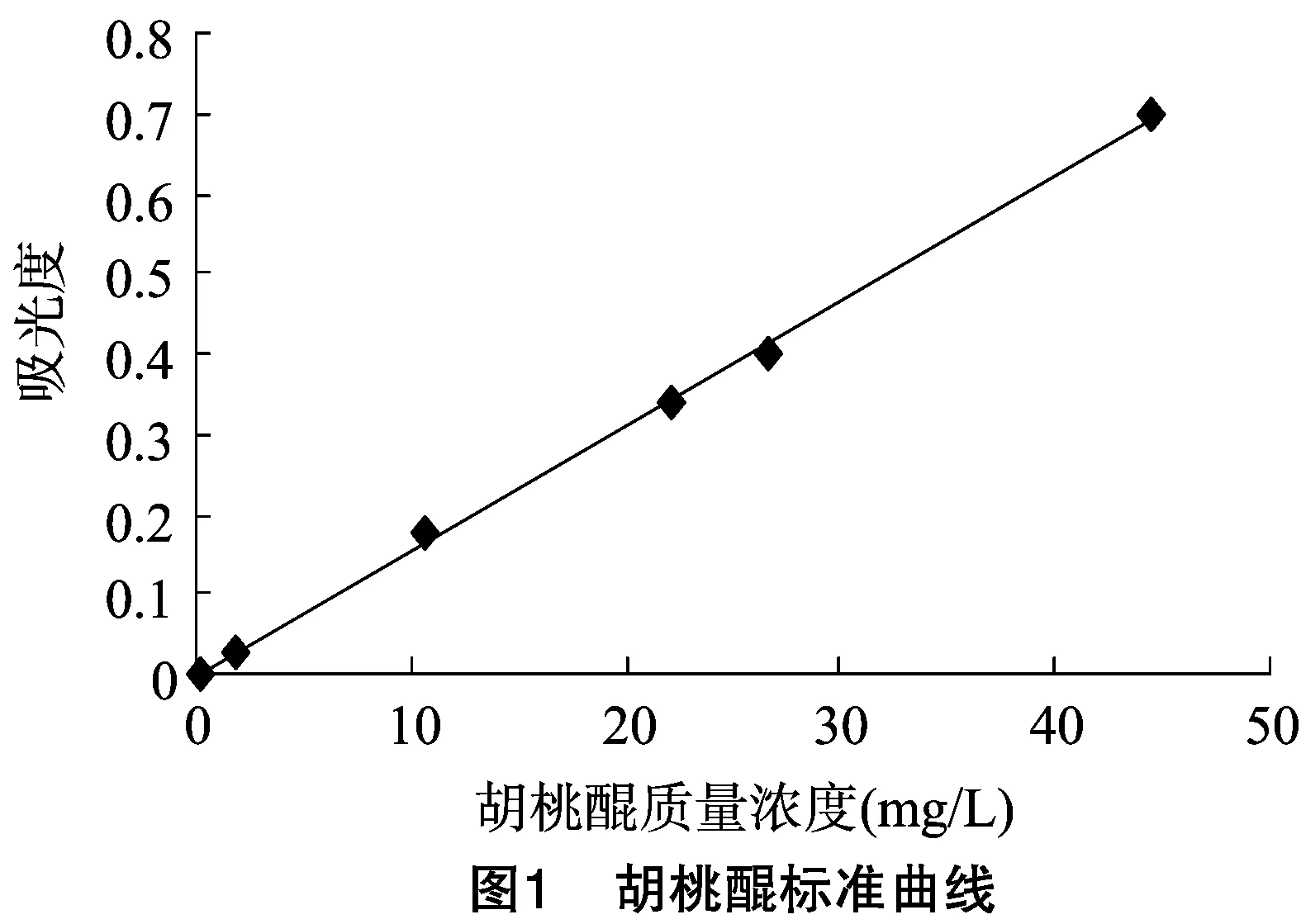
1.3.1 紫外-可见光度法 精确称取胡桃醌标准品 11.1 mg,甲醇溶解后,定容至25.0 mL容量瓶中作为母液,再分别配制0.177 6、1.776 0、10.660 0、22.200 0、26.640 0、44.400 0 mg/L 的不同浓度标准液,在420 nm波长下测吸光度,以浓度-吸光度作标准曲线,得线性回归方程为y=0.015 6x-0.000 7(r2=0.999 2)。表明胡桃醌浓度在0.177 6~44.400 mg/L范围内具有良好的线性关系,标准曲线见图1。
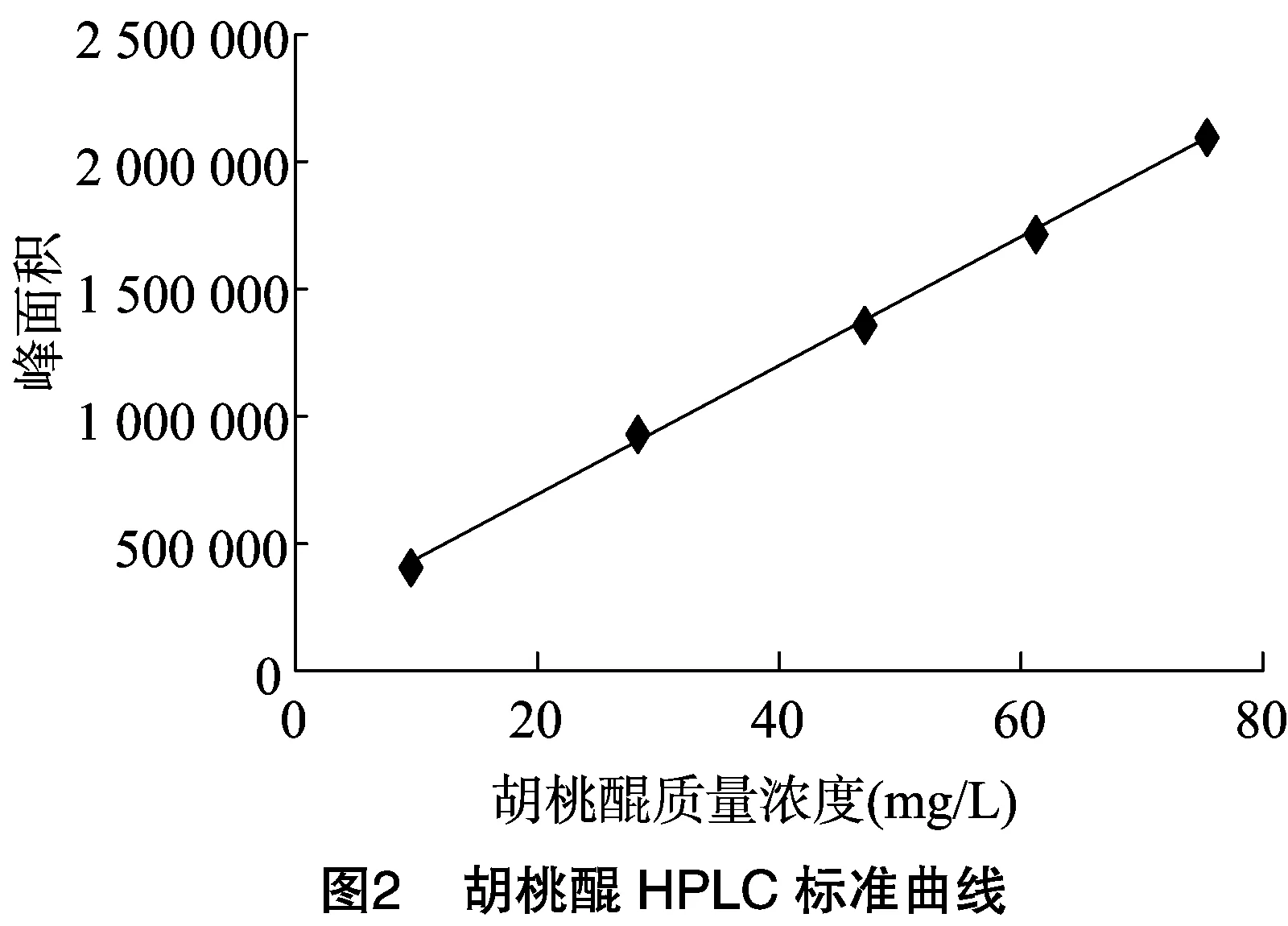
1.3.2 HPLC法 取“1.3.1”节下母液配制浓度为9.440、28.320、47.200、61.360、75.520 mg/L的标准液,按照流动相:甲醇 ∶水=70 ∶30(体积比)(色谱柱:Welchrom C18柱,4.6 mm×250 mm,5 μm);洗脱速度:1.0 mL/min;柱温:30 ℃;进样量:10 μL;检测波长:250 nm进样测定,以测得的峰面积-浓度作标准曲线,得线性回归方程为:y=25 042x+195 771(r2=0.999 2)。表明胡桃醌浓度在9.440~75.520 mg/L 的浓度范围内线性关系良好,标准曲线见图2。
1.4 样品液制备
传统的胡桃醌提取中用到的提取剂主要是乙醇水溶液、甲醇水溶液或纯的乙醇、甲醇、丙酮等单一溶剂,它们的极性都非常接近或很大,因此,作为提取剂时,所得的粗提物中杂质成分多且与目标物极性相似,使得胡桃醌后期的分离纯化难度增加。故而通过使用混合溶剂来改变提取剂体系的极性,从而得到易于纯化的粗提物。
选用实验室常用的二氯甲烷、乙酸乙酯、石油醚与95%乙醇配比作为提取剂提取胡桃醌,再与单一的95%乙醇、甲醇、乙酸乙酯、二氯甲烷做为提取剂进行对比,结果乙酸乙酯-95%乙醇(体积比1 ∶1)对胡桃醌的提取效果最佳,因此选择乙酸乙酯-95%乙醇(体积比1 ∶1)为制备样品液的提取溶剂。样品液制备步骤如下:
称取200.0 g核桃枝粉末,以5 000 mL乙酸乙酯-95%乙醇(体积比1 ∶1)为溶剂,在35 ℃下超声提取2次,每次 45 min,合并滤液,在35 ℃下减压蒸馏除去溶剂,浓缩为浸膏备用。
1.5 大孔树脂预处理
新购买的大孔树脂内孔里面通常会有气泡或残留部分有机物和惰性溶剂,为防止在使用时有害物对树脂造成污染和产生过多的气泡,在使用前必须经过预处理。参照刘宛玲等的方法[10],先用95%乙醇浸泡大孔树脂24 h以除去脂溶性杂质,水洗至无醇味,再以5% NaOH溶液和5% HCl溶液分别浸泡3 h对树脂进行活化,水洗至中性,水封备用。
1.6 大孔树脂选择
1.6.1 静态吸附试验 取处理好的6种不同型号的大孔树脂,过滤,分别称取3.0 g置于6个相同型号的锥形瓶中,同时加入浓度为29.47 mg/L的胡桃醌标准品甲醇溶液 20.0 mL,密封,置于摇床(28 ℃,150 r/min)上振摇3 h,取上清液在紫外分光光度计下测吸光度,计算吸附率[11]。计算公式如下:
式中:E为吸附率(%);C0、C1为吸附前后药液中胡桃醌的质量浓度(mg/L)。
1.6.2 静态解吸试验 将吸附后的树脂过滤,并用蒸馏水清洗2遍,再分别放入6个相同型号的锥形瓶中,加入20.0 mL 95%乙醇在相同条件的摇床上振摇解吸3 h,取上清液在紫外分光光度计下测吸光度,计算解吸率。
式中:D为解吸率(%);C2为解吸后药液中胡桃醌的质量浓度(mg/L);C0、C1为吸附前后药液中胡桃醌的质量浓度(mg/L);V1为吸附液体积(L);V2为解吸液体积(L)。
1.7 HPD-100大孔树脂纯化胡桃醌的动态吸附与解吸工艺
1.7.1 上样浓度的选择 取适量筛选出的理想树脂,湿法装柱。配制不同质量浓度的上样液(19.21、23.38、27.55、36.07、39.21 mg/L)各100 mL,以1.0 mL/min的流速上柱吸附,收集流出液,浓缩,紫外分光光度计下测吸光度,计算吸附率。
1.7.2 上样流速的选择 取适量筛选出的理想树脂,湿法装柱。配制500.0 mL浓度为36.07 mg/L的上样液,分别取100.0 mL以不同流速(1.0、1.5、2.0、2.5、3.0 mL/min)上柱吸附,收集流出液,浓缩,紫外分光光度计下测吸光度,计算吸附率。
1.7.3 上样量的选择 取适量筛选出的理想树脂,湿法装柱。配制浓度为36.07 mg/L的上样液,以1.5 mL/min的速度上柱吸附,流出液每10 mL收集1份,浓缩,紫外分光光度计下测吸光度,计算胡桃醌质量浓度,绘制泄露曲线。
1.7.4 洗脱剂的选择 取适量筛选出的理想树脂,湿法装柱。按最佳吸附条件进行上样,以1 BV蒸馏水洗脱除杂,取甲醇、95%乙醇溶液各100.0 mL,以1.0 mL/min的速度进行洗脱,收集洗脱液,浓缩,甲醇定容,紫外分光光度计下测吸光度,计算解吸率。
1.7.5 洗脱剂体积分数的选择 取适量筛选出的理想树脂,湿法装柱。按最佳吸附条件进行上样,以1 BV蒸馏水洗脱除杂,分别用20%、40%、60%、80%、95%乙醇溶液各 100.0 mL,以1.0 mL/min的速度进行洗脱,收集洗脱液,浓缩,甲醇定容,紫外分光光度计下测吸光度,计算解吸率。
1.7.6 洗脱剂流速的选择 取适量筛选出的理想树脂,湿法装柱。按最佳吸附条件进行上样,以1 BV蒸馏水洗脱除杂,分别用80%乙醇溶液各100.0 mL以不同流速(1.0、1.5、2.0、2.5、3.0 mL/min)进行洗脱,收集洗脱液,浓缩,甲醇定容,紫外分光光度计下测吸光度,计算解吸率。
1.7.7 洗脱剂用量的选择 取适量筛选出的理想树脂,湿法装柱。按最佳吸附条件进行上样,以1 BV蒸馏水洗脱除杂,再用80%乙醇溶液以2.5 mL/min的速度进行洗脱,每10 mL收集1份,浓缩,甲醇定容,紫外分光光度计下测吸光度,计算胡桃醌质量浓度,绘制洗脱曲线。
1.8 大孔树脂与硅胶柱联合纯化方法
取样品150.0 mg溶解于甲醇中,按最佳吸附条件上样,最佳解吸条件洗脱,收集洗脱液,在35℃条件下减压浓缩。向浓缩液中加入硅胶拌样使样品吸附在硅胶上,并烘干呈粉末状,干法上样,以石油醚和二氯甲烷(体积比1 ∶0,1 BV;体积比2 ∶1,3 BV;体积比1 ∶1,3 BV;体积比1 ∶2,3 BV;体积比0 ∶1,3 BV)进行洗脱,每10 mL收集1份,通过薄层检验,与标准品进行对照,合并含胡桃醌的组分,旋干称质量。
2 结果与分析
2.1 大孔树脂选择结果
从表1可以看出,6种大孔树脂对胡桃醌的吸附效果依次为HPD-300>HPD-100>D101>NKA-9>DM301>HPD-600,解吸效果依次为DM301>HPD-600>HPD-100>D101>NKA-9>HPD-300,结果表明,大孔树脂对胡桃醌的吸附和解吸选择性差异较大,综合考虑选择HPD-100为此次试验的最佳树脂。
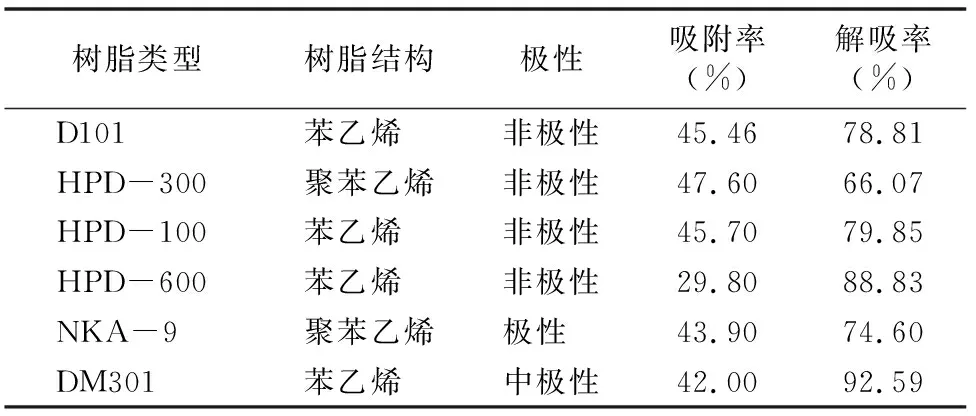
表1 6种大孔树脂静态吸附和解吸结果
2.2 动态吸附与解吸工艺
2.2.1 上样浓度的选择 从图3可以看出,胡桃醌吸附率随着上样浓度的增加先升高后降低,可能是因为浓度在低于36.07 mg/L时,单位表面积内树脂与胡桃醌接触量小,对胡桃醌的吸附未达到饱和状态,而在超过36.07 mg/L浓度后,上样液中杂质较多且树脂达到饱和态使吸附能力减弱,故选择36.07 mg/L为最佳上样浓度。

2.2.2 上样流速的选择 从图4可以看出,吸附率随着上样流速的增加,变化差距不大,在1.5 mL/min的流速下吸附率最大,在2.5 mL/min后吸附率开始明显降低,可能是因为上样速率过快而使上样液与树脂未充分接触,综合考虑选择1.5 mL/min为上样流速。
2.2.3 上样量的选择 从图5可以看出,当上样液体积达到50 mL时,流出液中胡桃醌的浓度约为初始浓度的1/10,在80 mL时趋于完全泄露的状态,此时树脂已吸附饱和,因而确定最大上样体积为50 mL。
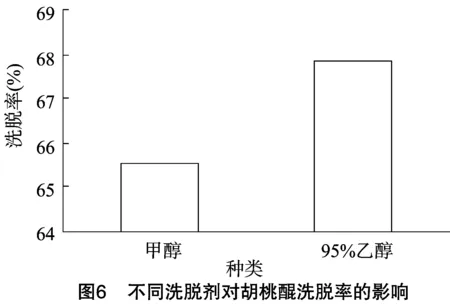
2.2.4 洗脱剂的选择 从图6可以看出,用95%乙醇进行洗脱,其解吸效果明显好于甲醇,故而选择95%乙醇为最佳洗脱剂。
2.2.5 洗脱剂体积分数选择 胡桃醌是一种易溶于乙醇、甲醇、氯仿等有机溶剂而较难溶于水的萘醌类化合物。从图7可以看出,当乙醇体积分数越大时,胡桃醌越容易从树脂上解吸下来,而当洗脱剂中乙醇体积分数超过80%时其解吸率开始减小,可能是因为80%乙醇体积分数适中,与胡桃醌极性相似,在这个体积分数下胡桃醌已大部分被洗脱下来,因而80%乙醇洗脱效果最佳。



2.2.6 洗脱剂流速选择 从图8可以看出,以2.5 mL/min的洗脱速率进行洗脱效果最佳。因为洗脱速度太慢,可能会导致洗脱时间较长,而洗脱速度太快,又可能会使洗脱剂与树脂接触时间不够,使胡桃醌洗脱不下来[12]。

2.2.7 洗脱量的选择 从图9可以看出,当洗脱剂用量达到150 mL时,流出液中胡桃醌的浓度接近0,故将此点作为洗脱终点。
2.3 纯化后核桃枝中胡桃醌的HPLC分析
将纯化前后的胡桃醌及标准品溶解后进行HPLC分析,其HPLC图谱及纯化前后含量对比见表2、图10。

从图10、表2可以看出,经过HPD-100大孔树脂和硅胶柱联合纯化后的胡桃醌周围杂质峰数目及高度明显减少,纯度提高了60%,表明此方法对胡桃醌的纯化效果较好。

表2 胡桃醌纯化前后含量比较

3 结论与讨论
大孔树脂是一种选择性好、吸附容量大且相对稳定的聚合物吸附剂,广泛应用于多酚、黄酮、生物碱、醌类等天然产物的分离纯化。本研究结果表明,HPD-100型大孔树脂纯化胡桃醌的最佳条件参数为:上样浓度36.07 mg/L,上样流速1.5 mL/min,上样量为50 mL;洗脱剂浓度为80%乙醇,洗脱速率2.5 mL/min,洗脱体积150 mL。联合硅胶柱纯化后,胡桃醌纯度提高了60%。本试验结果与王炎研究结论[13]比较,采用联合柱层析法来纯化胡桃醌,同时用HPLC来检测胡桃醌纯化前后的含量,客观说明该试验方法的可行性和试验结果的可靠性,且该法成本低廉,可在核桃枝中胡桃醌的纯化研究中进行开发和利用。
:
[1]侯 栋,高 哲,何童森,等. HPLC测定核桃青皮中胡桃醌的含量[J]. 中国实验方剂学杂志,2012,18(15):70-72.
[2]曹 军,刘建生. 胡桃醌体外抗胰腺癌细胞机制的初步研究[J]. 中国当代医药,2011,18(10):22.
[3]卢 阳,李 薇,崔久嵬,等. 胡桃醌对人结肠癌HCT-8细胞黏附及基质金属蛋白酶活性的影响[J]. 吉林大学学报,2012,38(1):89.
[4]刘 迪. 胡桃醌对大肠杆菌蛋白质表达影晌作用的研究[D]. 沈阳:沈阳农业大学,2016:60.
[5]皮新梅. 青龙衣化学成分及杀虫活性的研究[D]. 北京:北京化工大学,2014:51.
[6]郭 瑜,郝慧娟,王晓闻,等. 核桃壳中胡桃醌提取工艺研究[J]. 食品工业,2014,35(9):58-61.
[7]冯 迟,王舒雅,高 俊,等. 核桃楸青果皮中胡桃醌的提取工艺[J]. 江苏农业科学,2016,45(5):340-342.
[8]马 乐,张有林,韩军岐,等. 大孔树脂对核桃青皮中胡桃醌的分离纯化[J]. 食品与发酵工业,2016,42(1):108-113.
[9]许绍惠,唐婉屏,韩忠环. 核桃楸毒性成分研究[J]. 沈阳农业大学学报,1986,17(2):34-39.
[10]刘宛玲,肖建辉,黄占旺,等. 大孔树脂分离纯化麦胚黄酮研究[J]. 食品工业科技,2017,38(2):293-296.
[11]刘晓庆,李广林,瞿 亮,等. AB-8型大孔树脂纯化桦褐孔菌三萜的工艺研究[J]. 食药用菌,2017,25(1):40-45.
[12]巫玲丽,张 利. 大孔吸附树脂纯化菜芙蓉黄酮工艺研究[J]. 食品研究与开发,2017,38(2):66-69.
[13]王 炎. 青龙衣胡桃醌类成分富集[J]. 国际药学研究杂志,2017,44(1):60-64.

