紫茎泽兰叶浸提液对4种冰草的化感作用
鲁京慧
(河北旅游职业学院,河北承德 067000)
化感作用是指植物或微生物(供体)向周围环境中释放特定的化学物质,影响其他植物、微生物和动物(受体)生长发育的现象,在群落的形成和演替中起着重要作用,普遍存在于各类生态系统,是整个生态系统化学关系网的一部分[1-3]。供体植物在周围环境中能够释放化感物质,抑制其他受体植物种子的生长发育,从而对群落中物种的组成和分布格局产生影响,化感作用大多数表现为有害的抑制作用,但种间相互有益的促进作用也是客观存在的[4-8]。近年来,化感作用的研究日益深入和广泛,多种植物的化感效应得到评价、开发和利用,化感作用已成为有害生物控制、增加作物产量和促进环境可持续性发展的重要途径之一,在自然界中,化感物质积累到一定量后,就会抑制其他植物种子萌发和幼苗生长,从而影响植物的竞争力[9-14]。
紫茎泽兰(EupatoriumadenophorumSpreng.)是菊科泽兰属多年生草本植物,为我国西南地区的主要外来入侵植物,对全球自然和农业生态系统造成了严重危害[9-14],入侵后造成物种多样性和生态系统过程发生改变[15-19]。禾本科植物在生态系统中占据重要地位,紫茎泽兰与禾本科植物之间通过次生物质(化感物质)为媒介相互作用和识别[9]。目前,国内外学者关于入侵植物化感作用研究较多,但紫茎泽兰对禾本科植物的化感作用还鲜有报道[16-19]。紫茎泽兰耐贫瘠,入侵后排挤当地植物,表现出较强的竞争优势,并且种子产量高,适应光和养分变化的能力强,其繁殖及扩散能力强,它的入侵带来了一些颇具争议的生态环境问题[15-19]。其中,紫茎泽兰的化感作用是引起这种现象颇受关注的生态问题,紫茎泽兰的化感作用对周围环境和其他植物影响的具体表现形式是抑制还是促进仍有待深入探讨[15-19]。鉴于此,本试验以4种典型冰草为受体,以紫茎泽兰为供体,开展紫茎泽兰叶浸提液对不同禾本科植物的生理响应及化感研究,从化感作用方面研究紫茎泽兰对于揭示其危害机制、广泛蔓延特性和紫茎泽兰的田间防治有着重要的指导意义,并且为深入探讨紫茎泽兰对于禾本科植物的化感作用与其入侵关系提供数据支撑。
1 材料与方法
1.1 试验材料
2013年7月,在紫茎泽兰生长期采摘其叶片作供体。供试材料采于在四川省凉山州地区,紫茎泽兰植株高约1.5~2.5 m,疯狂生长已形成单优群落,采集大量的成熟叶片。采集的紫茎泽兰成熟叶片带回河北师范大学资源与环境科学学院,在室温条件下晾干,将紫茎泽兰叶片剪成<2 cm的小段放入烧杯中浸泡,浸泡过程中不断搅动,加蒸馏水配成0.01、0.02、0.03、0.04 g/mL浓度溶液,在室温25 ℃下放置36 h,每12 h摇动5 min,用2层滤纸抽滤3次后得紫茎泽兰叶浸提母液,将母液贮存于冰箱4 ℃冷藏。
受体为蒙古冰草、扁穗冰草、蒙农杂交冰草、沙生冰草种子,购于河北省农业科学院。选取健壮饱满、无损伤、无虫害的种子,用65%乙醇消毒5 min后,蒸馏水冲洗干净,100 ℃水 5 min 处理,放置24 h。供试受体种子用3 g/L高锰酸钾溶液浸泡消毒10 min后,蒸馏水冲洗2~3次。
1.2 试验方法
在河北师范大学资源与环境科学学院实验室内,采用培养皿滤纸法进行4种冰草种子萌发和幼苗生长试验。选取上述预处理后籽粒饱满、大小均匀、色泽一致的种子,整齐排列在清洗、消毒、放有双层滤纸的培养皿中(发芽床,直径 9 cm),每个培养皿60粒,加入15 mL各浓度紫茎泽兰叶提取液,对照(CK)选用去离子水,每个浓度梯度设置3组重复,每天定时向培养皿中补充相应处理溶液,每3 d更换1次滤纸。
培养条件:每天光照时间为09:00—19:00,光强 3 000 lx,恒温25 ℃,相对湿度75%~80%。连续培养观察并逐日记录种子萌发数目,以胚根冲破种皮达1 mm为发芽标准,待连续3 d无萌发时测量根长、苗高、鲜质量(精确到 0.01 g),计算各处理种子的萌发率、萌发指数,将种子萌发数和根长、苗高测定值换算成对照抑制百分率。
通过种子发芽和幼苗生长试验分析紫茎泽兰叶提取液的化感作用,并取受体幼苗的根和幼叶测定其生理生化指标。
对照抑制百分率=(1-处理/对照)×100%;
萌发率=种子发芽数/供试种子数×100%;
萌发指数GI=(Gt/Dt),Gt表示在第t天种子的发芽数;Dt代表相应的发芽天数;
采用 Williamson[20]化感指数(RI):
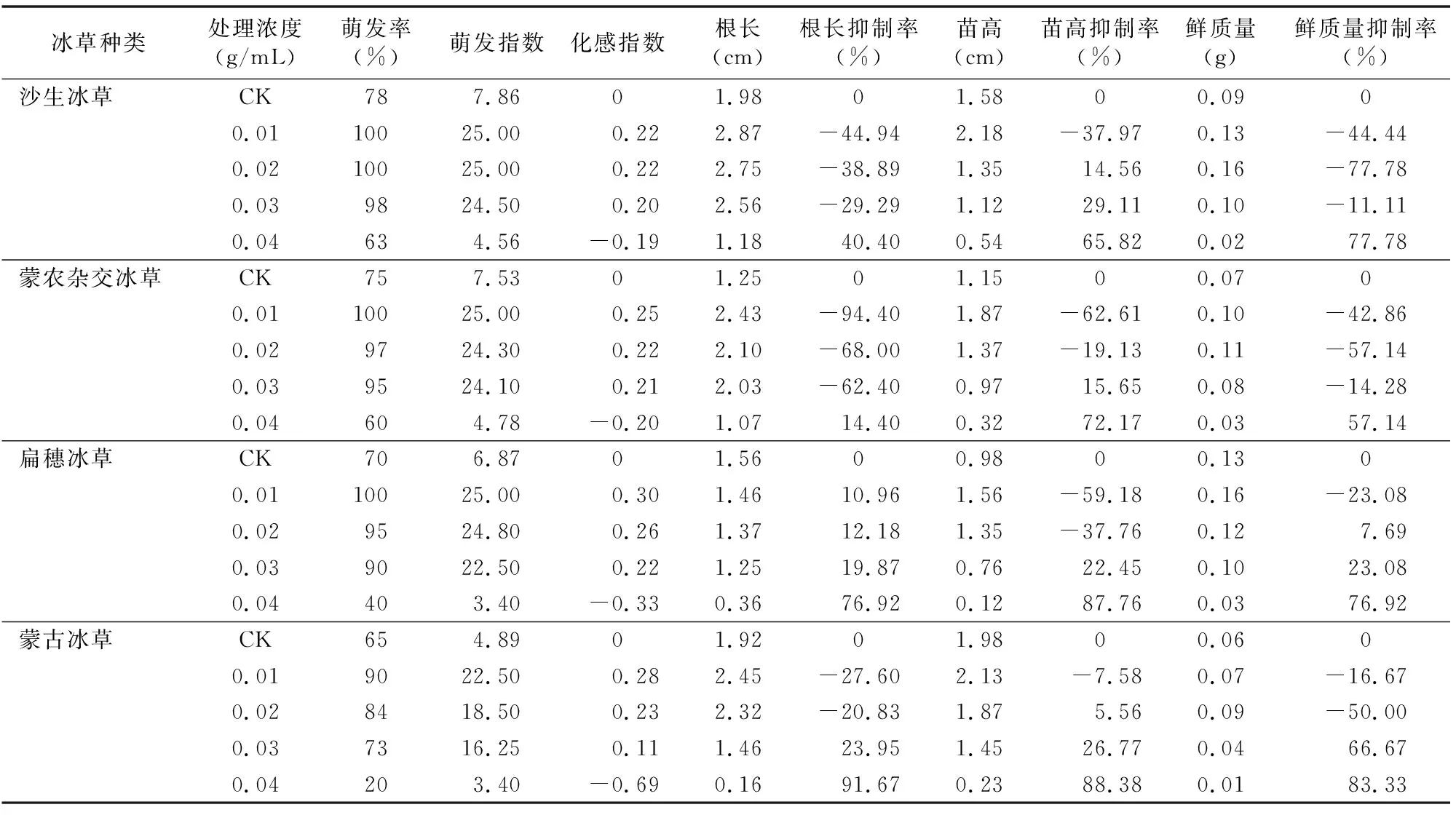
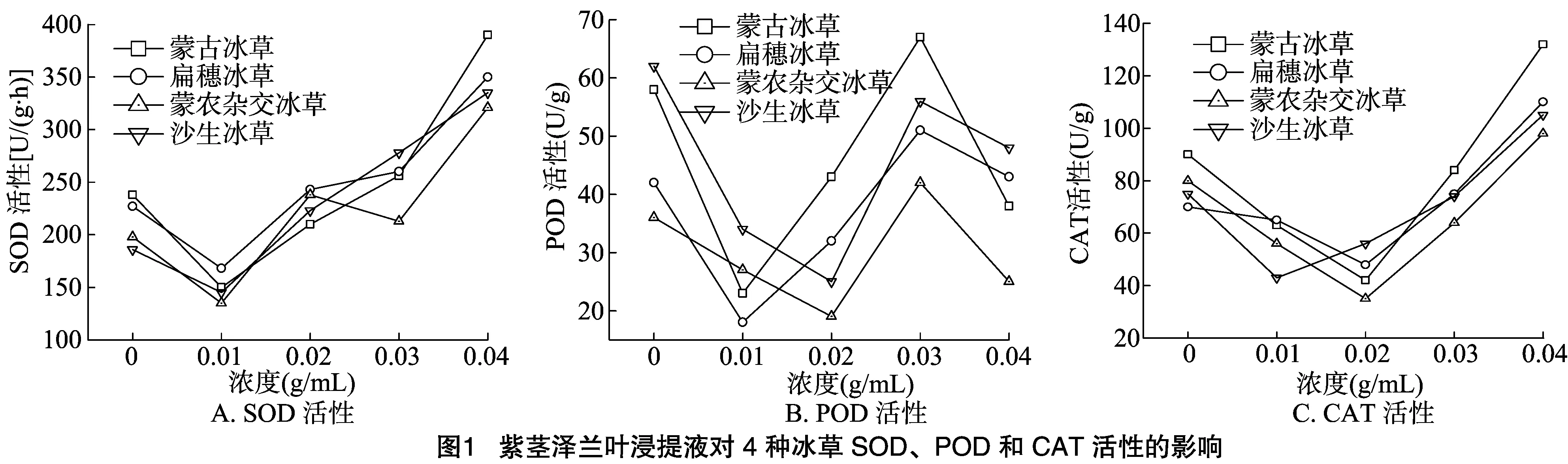
RI=1-C/T(T≥C);RI=T/C-1(T 式中:C为对照值,T为处理值。当RI<0时,表示抑制作用;RI>0时,表示促进作用。RI的绝对值大小代表化感作用的强弱。 采用愈创木酚法测定过氧化物酶(POD)活性;氮蓝四唑(NBT)光还原法测定超氧化物歧化酶(SOD)活性;硫代巴比妥酸(TBA)法测定丙二醛(MDA)含量;四氮唑法测定根系活力(TTC);过氧化氢分解法测定过氧化氢酶(CAT)活性[21];多酚氧化酶(PPO)活性测定采用分光光度计[22];液氮分离纯化测定苯丙氨酸解氨酶(PAL)活性[23]。 1.4 数据分析 采用Excel 2003.0和SPSS 18.0统计分析软件分别对数据进行单因素方差分析,在置信水平为95%(P<0.05)的基础上采用LSD多重比较,采用Origin 7.5软件绘图。 从表1可以看出,紫茎泽兰叶浸提液对不同受试作物的化感作用不同,4种受体植物各项测定指标均随浓度的增加呈先提高后降低趋势,0.01、0.02 g/mL紫茎泽兰叶浸提液处理下4种受体植物各指标绝大部分高于对照,其中对根长的促进效应最为显著,浓度0.04 g/mL各指标均低于对照,表现为化感抑制作用。紫茎泽兰叶浸提液浓度由0~0.03 g/mL,4种冰草种子萌发率的化感效应指数均为正,并且随浓度的增加逐渐降低,当浸提液浓度达到0.04 g/mL时,4种冰草种子萌发率的化感效应指数均为负,沙生冰草为-0.19,孟农杂交冰草为-0.20,扁穗冰草为-0.33,蒙古冰草为-0.69;当浸提液浓度为0.01~0.02 g/mL时,各项指标均达最大,并且对根长、苗高、鲜质量起到促进作用,当浸提液浓度达到 0.04 g/mL 时,紫茎泽兰叶浸液对4种冰草根长、苗高、鲜质量的抑制作用最大,其中对鲜质量的抑制率沙生冰草为77.78%,蒙农杂交冰草为57.14%,扁穗冰草为76.92%,蒙古冰草为83.33%。蒙古冰草受紫茎泽兰叶浸提液的影响最明显。 2.2 紫茎泽兰叶浸提液对4种冰草SOD、POD、CAT活性的影响 SOD的主要功能是清除氧自由基,防止其对细胞膜系统伤害的一种很重要的抗氧化酶。从图1-A可以看出,4种冰草SOD活性随紫茎泽兰叶浸提液浓度的增加呈先降低后升高的变化趋势,呈“N”字形变化规律。当浸提液浓度为 0.01 g/mL 时,4种冰草SOD活性均低于对照,说明4种冰草在此浓度范围内均未受到胁迫。当浸提液浓度高于 0.02 g/mL 时,随着浸提液浓度增加,4种冰草SOD活性急剧增加并且均高于对照。浸提液浓度达到0.04 g/mL时,与对照相比,4种冰草SOD活性分别增加了140.23%、135.92%、121.78%、110.56%,即紫茎泽兰叶浸提液对4种冰草的化感抑制效应增强,为了抵御这种胁迫而启动SOD保护酶体系的保护作用,因此SOD活性升高。 表1 紫茎泽兰叶水浸提液对不同冰草种子萌发的影响 POD在植物体内主要作用之一就是催化H2O2降解,可抑制逆境条件下细胞膜脂过氧化作用,降低细胞膜遭受伤害。从图1-B可以看出,紫茎泽兰叶浸提液浓度在0.01~0.02 g/mL 时,4种冰草POD活性低于对照,随着浸提液浓度的增加,4种冰草POD活性升高,浸提液浓度达0. 03 g/mL时,4种冰草POD活性达到最高点,这可能是由于植株受到胁迫后调动了POD保护酶体系所致;而随着浸提液浓度的继续升高,化感胁迫作用已经超出POD的保护范围,此时POD活性急剧降低,当浸提液浓度达到0.04 g/mL时,与对照相比,4种冰草SOD活性分别降低了38.36%、31.56%、34.23%、25.68%。 CAT可清除体内的H2O2,是植物体内重要的活性氧清除剂之一。从图1-C可以看出,随着紫茎泽兰叶浸提液浓度的增加,4种冰草CAT 活性呈现先降低后升高的变化趋势,呈“V”字形变化规律。当浸提液浓度在0.01~0.02 g/mL时,4种冰草CAT活性均低于对照,化感效应表现为促进作用,浸提液浓度达到0.02 g/mL时,蒙古冰草、扁穗冰草、蒙农杂交冰草CAT均达最低,而沙生冰草在浸提液浓度为 0.01 g/mL 时最低;随着浸提液浓度的继续增加,4种冰草生长受到抑制,CAT活性持续升高;在浸提液浓度高于 0.03 g/mL 时,4种冰草CAT活性均明显高于对照,以此抵御这种化感胁迫。 2.3 紫茎泽兰叶浸提液对4种冰草MDA含量和TTC的影响 植物器官在逆境条件下或衰老时,往往发生膜脂过氧化作用,MDA作为膜脂过氧化作用的最终产物,是膜质过氧化程度的指标之一,用于表示细胞膜脂过氧化程度和植物对逆境条件反应的强弱。从图2-A可以看出,4种冰草MDA含量随紫茎泽兰叶浸提液浓度的增加呈明显上升,当浸提液浓度小于0.02 g/mL时,4种冰草在保护酶系的保护范围内,MDA含量较对照低,化感效应表现为促进作用;当质量浓度大于0.02 g/mL时,化感抑制效应使得膜脂过氧化程度增强,同时保护酶系的综合保护能力降低。MDA含量逐渐增加,标志着细胞受伤害的程度加剧。总体看来,4种冰草MDA含量的增幅不大,表明其受到伤害的程度较小,当浸提液浓度为0. 04 g/mL时,4种冰草MDA含量明显高于对照,此时冰草种子受到严重伤害,也可能是因为种子随着时间延长受到病菌侵染霉变,内部毒害物质上升所致。 从图2-B可以看出,4种冰草TTC与MDA变化趋势一致,不同浓度的紫茎泽兰叶浸提液对4种冰草TTC有不同程度的抑制作用。当浸提液浓度为0. 01 g/mL时,4种冰草TTC随浸提液浓度的增加呈显著下降,与对照比较,分别下降了10.56%、30.72%、32.29%、38.75%,表明浸提液对4种冰草种子内部反应较为剧烈,其物质和能源的转化率要低于对照,从而在一定范围内降低了种子的成苗率和抗逆性。当浸提液浓度大于0. 02 g/mL时,4种冰草TTC随浸提液浓度的增加显著提高,并且均高于对照,抑制作用及强度越强,这可能是由于化感效应使根系活力增强以抵御外界的胁迫,在酶的作用下,种子中大量的淀粉、脂肪、蛋白质水解提供幼苗生长需要的物质和能源,物质转化率越高对幼苗生长越有利,并可以提高成苗率和幼苗的抗逆性,对植株正常生长具有促进作用。 从图3-A可以看出,随着紫茎泽兰叶浸提液浓度的升高,4种冰草PAL活性与PPO变化规律基本保持一致。当浸提液浓度为0.01 g/mL时,4种冰草PAL活性达到最低,这可能是由于浸提液在低浓度化感效应为促进作用,植株次生代谢状况趋于平衡,因此PAL活性较低;当浸提液浓度大于 0.01 g/mL 时,4种冰草PAL随浸提液浓度的增加呈逐渐提高趋势,在此过程中,4种冰草体内次生代谢趋缓,从而引发PAL活性升高,以加速次生代谢,保证幼苗的正常生长。 从图3-B可以看出,随着紫茎泽兰叶浸提液浓度的升高,4种冰草PPO活性先降低后提高,呈“V”字形变化规律。相同浸提液浓度下,4种冰草PPO活性大小基本表现为蒙古冰草>扁穗冰草>蒙农杂交冰草>沙生冰草;当浸提液浓度为0.04 g/mL时,4种冷草分别高出对照63.58%、52.17%、62.35%、54.43%。 化感作用作为植物的一种竞争手段,存在于多种生态系统中,主要通过植物地上部分的挥发、根际分泌、雨水淋洗、植株残体的腐解以及花粉等途径向环境中释放化感物质,从而对周围生物产生直接或间接的有害或有利的影响[1-3,9-13]。本研究表明,紫茎泽兰叶片的化感物质对不同受体植物具有不同效应,并且作用强度也不尽相同,4种冰草种子萌发表现为低浓度下促进萌发、高浓度下抑制萌发的双重化感效应,其中尤以沙生冰草和蒙农杂交冰草最为敏感,与众多学者的研究结果[10-13,24]一致,表明紫茎泽兰中存在化感物质并且具有较高的活性。与对照相比,4种冰草的鲜质量、根长、苗高均不同程度地受到了紫茎泽兰化感作用的影响。紫茎泽兰叶浸提液的抑制作用降低了4种冰草根表面的吸收面积和地上部分光合面积,从而降低了根的吸收效率和地上部分的光合同化率,具体表现在4种冰草鲜质量均低于对照,化感物质对根长的抑制使4种冰草根系变小,吸收养分能力下降,光合能力变弱,降低了4种冰草对资源的有效利用。本研究还发现,在4种冰草种子萌发早期紫茎泽兰叶浸提液化感作用较弱,加之生物量较低,化感物质释放总量有限,随4种冰草发育时间的延长,紫茎泽兰化感作用增强,更多的化感物质积累到受体植物体内从而抑制了种子萌发和幼苗生长。 化感作用是植物普遍存在的现象,主要干扰受体植物的一些高级代谢过程和生长调节系统。植物化感作用首先是对细胞膜的伤害,将化感物质胁迫的信号传送到细胞内,从而对激素、离子吸收等产生影响[4,6-8,10-12]。激素、离子吸收以及水分状况的变化会对植物产生抑制作用,从现有的资料来看,化感作用几乎能影响植物生理生化的每一个方面,大多数化感物质是影响植物的细胞膜。CAT活性随浸提液浓度的增加呈先提高后降低趋势,种子吸胀过程中,生理活动恢复加强,不可避免地与体内生物大分子蛋白质、核酸和脂类等起反应且产生破坏其结构和功能的H2O2等自由基,CAT可把H2O2分解为H2O和O2,以清除H2O2的毒害作用[25-29]。现在普遍认为植物受到胁迫后,保护酶活性下降,而本研究当紫茎泽兰叶浸提液浓度高于0. 02 g/mL时,4种冰草CAT活性均明显高于对照,浸提液浓度为0.04 g/mL时4种冰草CAT 活性达到最高,表明高浓度紫茎泽兰叶浸提液引起种子代谢紊乱,造成无氧呼吸上升,大量消耗贮藏物质,使得CAT活性明显增强。 MDA是膜脂过氧化产物,其含量是膜脂过氧化程度的一个重要标志,而且与细胞膜的损害程度直接相关,可以反映植物遭受逆境伤害的程度。同时,MDA本身也是一种有害物质,它能强烈地与细胞内各种成分发生反应,引起酶和膜的严重损伤,导致膜结构及生理完整性的破坏[12-14,25-26]。紫茎泽兰叶浸提液浓度达到0. 02 g/mL以后4种冰草MDA含量均高于对照,并且随浸提液浓度的升高MDA含量增加越高,其中沙生冰草MDA含量最低,其他3种冰草均较高,说明紫茎泽兰叶浸提液使4种冰草细胞的膜脂过氧化程度增高,膜透性增大,对逆境条件反应增强,表明在紫茎泽兰叶浸提液化感作用下蒙农杂交冰草、扁穗冰草、蒙古冰草膜脂过氧化程度较为明显,进一步说明沙生冰草和蒙农杂交冰草对逆境的抵抗能力最强,其次是扁穗冰草,最弱的是蒙古冰草。TTC活力在低浓度浸提液处理下低于对照,高浓度浸提液处理下明显上升,与MDA变化趋势一致,主要是由于紫茎泽兰叶浸提液胁迫通过抑制、清除内源活性氧酶的活性,导致活性氧的积累和膜脂过氧化加剧,致使4种冰草根系细胞膜受到伤害。4种冰草在低浓度紫茎泽兰叶浸提液下MDA含量低于对照,能够引起保护酶活性下降,减弱机体清除自由基能力;随着浸提液浓度的增加,MDA含量增加,在化感作用下,4种冰草细胞膜受到破坏,造成植株生理代谢紊乱,伴随着SOD、POD和CAT 保护酶系统的启动,PPO和PAL活性升高,以抵御外界的胁迫,最终导致低浓度的促进和高浓度的化感抑制作用。这可能由于低浓度浸提液能激发保护酶活性保护4种冰草不受伤害,而高浓度浸提液胁迫下各种酶活性急剧降低[10-14,24-26],表明在浸提液下虽然保护酶活性加强,但其调节能力依然有限,这也是受体植物对紫茎泽兰化感作用适应的生理调节反应。 : [1]Maqbool N,Wahid A,Farooq M,et al. Allelopathy and abiotic stress interaction in crop plants[M]. Berlin:Springer Heidelberg,2013:451-468. [2]Inderjit,Wardle D A,Karban R,et al. The ecosystem and evolutionary contexts of allelopathy[J]. Trends in Ecology & Evolution,2011,26(12):655-662. [3]Murrell C,Gerber E,Krebs C,et al. Invasive knotweed affects native plants through allelopathy[J]. American Journal of Botany,2011,98(1):38-43. [4]Farooq M,Jabran K,Cheema Z A,et al. The role of allelopathy in agricultural pest management[J]. Pest Management Science,2011,67(5):493-506. [5]张红玉. 紫茎泽兰入侵过程中生物群落的交互作用[J]. 生态环境学报,2013,22(8):1451-1456. [6]万方浩,刘万学,郭建英,等. 外来植物紫茎泽兰的入侵机理与控制策略研究进展[J]. 中国科学(生命科学),2011,41(1):13-21. [7]林文雄,何海斌,熊 君,等. 水稻化感作用及其分子生态学研究进展[J]. 生态学报,2006,26(8):2687-2694. [8]杨国庆,万方浩,刘万学. 入侵杂草紫茎泽兰的化感作用研究进展[J]. 植物保护学报,2009,35(5):463-468. [9]彭少麟,邵 华. 化感作用的研究意义及发展前景[J]. 应用生态学报,2001,12(5):780-786. [10]钟 声,段新慧,奎嘉祥. 紫茎泽兰对16种牧草发芽及幼苗生长的化感作用[J]. 草业学报,2007,16(6):81-87. [11]郑 丽,冯玉龙. 紫茎泽兰叶片化感作用对10种草本植物种子萌发和幼苗生长的影响[J]. 生态学报,2005,25(10):2782-2787. [12]李 美,高兴祥,高宗军,等. 艾蒿对不同植物幼苗的化感作用初探[J]. 草业学报,2010,19(6):114-119. [13]周艳丽,程智慧,孟焕文. 大蒜根系分泌物对不同受体蔬菜的化感作用[J]. 应用生态学报,2007,18(1):81-86. [14]于兴军,于 丹,马克平. 不同生境条件下紫茎泽兰化感作用的变化与入侵力关系的研究[J]. 植物生态学报,2004,28(6):773-780. [15]李会娜,刘万学,戴 莲,等. 紫茎泽兰入侵对土壤微生物、酶活性及肥力的影响[J]. 中国农业科学,2009,42(11):3964-3971. [16]于文清,刘万学,桂富荣,等. 外来植物紫茎泽兰入侵对土壤理化性质及丛枝菌根真菌(AMF)群落的影响[J]. 生态学报,2012,32(22):7027-7035. [17]鞠瑞亭,李 慧,石正人,等. 近十年中国生物入侵研究进展[J]. 生物多样性,2012,20(5):581-611. [18]鲁 萍,桑卫国,马克平. 外来入侵种紫茎泽兰研究进展与展望[J]. 植物生态学报,2005,29(6):1029-1037. [19]李 博,马克平. 生物入侵:中国学者面临的转化生态学机遇与挑战[J]. 生物多样性,2010,18(6):529-532. [20]Williamson G B,Richardson D. Bioassays for allelopathy:Measuring treatment responses with independent controls[J]. Journal of Chemical Ecology,1988,14(1):181-187. [21]余叔文. 植物生理与分子生物学[M]. 北京:科学出版社,1992. [22]程春龙,李俊清. 植物多酚的定量分析方法和生态作用研究进展[J]. 应用生态学报,2006,17(12):2457-2460. [23]杨 宁,李翠霞,李志忠,等. 诱导子对百里香再生植株中苯丙氨酸解氨酶活性的影响[J]. 西北植物学报,2012,32(2):330-335. [24]周志红,骆世明,牟子平. 番茄(Lycopersicon)的化感作用研究[J]. 应用生态学报,1997,8(4):445-449. [25]张秀玲. 盐对夏至草种子萌发以及盐胁迫解除后种子萌发能力恢复的影响[J]. 植物生理学通讯,2008,44(3):436-440. [26]张 伟,龚久平,刘建国. 秸秆还田对连作棉田土壤酶活性的影响[J]. 生态环境学报,2011,20(5):881-885. [27]朱宇林,谭 萍,陆绍锋,等. 桉树叶水浸提液对4种植物种子化感作用的生物测定[J]. 西北林学院学报,2011,26(1):134-137. [28]余 婷,孟焕文,温艳斌,等. 白三叶根系分泌物对5种草坪草的化感作用[J]. 草地学报,2013,21(4):729-736. [29]梁 静,程智慧,徐 鹏,等. 白三叶腐解液对5种草坪草的化感作用研究[J]. 草地学报,2011,19(2):257-263,287.1.3 测定指标
2 结果与分析
2.1 紫茎泽兰叶浸提液对不同植物种子萌发的影响

2.4 紫茎泽兰叶浸提液对4种冰草PAL、PPO活性的影响

3 讨论与结论

