接种AM真菌对西北马铃薯生长和土壤改良的效应
毕银丽, 蔡 云, 刘 生, 全文智, 郑娇龙, 孙 欢, 龚云丽, 胡晶晶, 郭 楠
[1.中国矿业大学(北京)煤炭资源与安全开采国家重点实验室,北京 100083; 2.北京合生元生态环境工程技术有限公司,北京 100192]
马铃薯(SolanumtuberosumL.)是我国西北地区主要粮食作物之一,因其耐旱、产量高、易储存等优势被广泛种植于黄土高原丘陵沟壑区。但是,该区域沟壑纵横、地形破碎、植被稀疏、水土流失异常严重、生态环境脆弱、土壤贫瘠、干旱少雨,严重限制了当地的农业生产。而马铃薯生长须要吸收大量营养,当地农民通过大量施用化肥来获得较高产量。研究表明,虽然使用化学肥料能够有效提高农业用地氮、磷、钾养分含量,但长期连续施肥致使土壤开始板结退化,特别是氮营养的淋失和磷的固定降低了土壤养分的有效性[1],制约作物生长,造成养分资源浪费且马铃薯品质下降,急须进行综合的治理改良,缓解土壤结构破坏、品质低下等问题。因此,越来越多的研究开始重视微生物在农业生产中的调控作用。
丛枝菌根(arbuscular mycorrhiza,AM)真菌是土壤中真菌菌丝与植物营养根系形成的共生体,它能与多种重要的经济作物形成互惠互利的共生体[2],提高宿主植物对矿物质营养的利用率并缓解干旱胁迫[3]。丛枝菌根真菌能够促进植物对土壤难移动矿物质离子的吸收和利用[4],改善土壤结构[5],提高土壤肥力,从而提高作物的产量与品质。赵青华等发现,茶树接种AM真菌后茶叶中可溶性蛋白和可溶性糖含量增加,茶多酚、咖啡碱、氨基酸和水浸出物含量提高,酚氨比降低,茶叶品质显著提高[6]。Gholamhoseini等研究表明,干旱胁迫下,AM真菌可增加向日葵的产量,提高籽粒油含量[7]。Baslam等研究发现,AM真菌可以促进生菜生长,提高生菜产量,并增加叶片维生素、矿物质含量[8-9]。王林闯等发现,AM真菌能改善甜椒品质,降低甜椒中硝酸盐含量,增加总糖、维生素C、粗蛋白含量[10]。此外,Yu等发现,低磷条件下,AM真菌能提高甘薯块茎β-胡萝卜素含量,表明AM真菌能帮助吸收植物生长期所需要的大部分磷,将生物活性磷储存于真菌菌丝体内[11]。接菌处理土壤中有效磷、有效氮含量的增加可能与磷酸酶、脲酶的活性提高有关[12]。相关的野外调查数据也证实,AM真菌的发育与土壤pH值、有机碳含量、碱解氮含量、速效磷含量、脲酶活性和碱性磷酸酶活性关系密切[13]。黄土高原地区丛枝菌根真菌对根际土壤理化性质也存在相似的影响,有利于提高根际土壤中矿物质养分离子的活性[14]。目前,AM真菌对于马铃薯生长及其土壤肥力的研究报道较少,而针对西北黄土高原地区的野外田间应用AM真菌来促进马铃薯生长与品质改善的相关研究几乎未见报道。本试验比较常规施肥处理,通过监测马铃薯生长周期中生长状况、品质、土壤养分等指标参数,来分析AM真菌对马铃薯生长、品质的改善及土壤养分的改良影响,揭示AM真菌生物技术在该区域的应用潜力和效果,为西北黄土高原区绿色有机农作物生产提供技术支撑和理论指导,具有重要的现实生态意义与价值。
1 材料与方法
1.1 地点概况
试验地点位于黄土高原腹地的陕西省米脂县印斗镇对岔村(109°52′E、37°48′N,平均海拔1 049 m)。年最高、最低气温分别是38.2、-25.5 ℃,年平均气温8.5 ℃,≥10 ℃积温 3 470 ℃,年日照时数2 716 h,无霜期162 d,年平均降水量 420 mm,为典型的温带大陆性气候。该地区主要气候特点是降水稀少、光照充足、蒸发量大、地表干燥、大风频繁、植被稀疏,极易发生风蚀和沙尘暴。
1.2 试验材料
供试植物为陇薯3号马铃薯。
供试菌剂由中国矿业大学(北京)微生物复垦实验室用沙土盆栽扩繁培养,生长3个月后将受真菌侵染的根段和含有菌丝、孢子的土壤作为摩西管柄囊霉(Funneliformismosseae,简称F.m)菌剂,孢子含量为38.5个/g。
1.3 试验设计
本试验于2016年在陕西省米脂县印斗镇对岔村黄绵土上进行,试验共设置3个处理,即接菌(+M)、施肥(+F)和对照(CK)。接菌组接菌量为100 g/穴,采用穴施方法接菌;施肥组施肥量为氮肥487 kg/hm2和磷肥83 kg/hm2,在沟底一次性均匀施入,对照组不施用任何肥料或菌剂。2016年5月30日对试验地进行中耕松土,以旋耕耙犁地后进行播种,种植时用牛牵引犁地穿沟,沟深15 cm,将马铃薯繁殖块茎按照20~25 cm的株间距和行间距播于沟底,将作物两侧聚垄覆土保墒。种植完成后,用耙磨平。田间管理均采用传统的大田管理措施。每个处理对应小区面积均为667 m2,各小区间设置地埂便于区分。
播种前,测定田间0~20 cm表层土壤基本理化性质,其中pH值为8.14,电导率(EC)为207.90 μS/cm,有机质含量1.36 g/kg,速效钾含量139.47 mg/kg,速效磷含量 8.03 mg/kg,田间最大饱和持水量17.15%。
1.4 采样与指标测定
马铃薯生长周期为4个月,分别于马铃薯花期和成熟期采样。成熟期时,每个处理随机选取10株,测定株高、顶端第2张完全舒展鲜叶叶绿素含量,采用便携式叶绿素测定仪SPAD-502 Plus获得相对叶绿素值SPAD值。采用样方法计产,挖取整株马铃薯将地上部分、根系、块茎,分别称质量。采集块茎后,将植株平放于地面,在自然状态下测量其主根长和展度(即左右展幅),记录侧根数[15]。分别对各株所有马铃薯块茎进行计数,测定块茎质量和直径,并带回实验室用于品质分析。
采用Phillips和Hayman法染色,玻片镜检测定侵染根段数,再用公式计算菌根侵染率:菌根侵染率=菌根段数/被检根段数×100%[16]。菌丝密度采用真空泵微孔滤膜抽滤-网格交叉法测定[17]。维生素C含量采用2,6-二氯酚靛酚滴定法测定;可溶性糖含量和粗纤维含量采用蒽酮比色法测定;马铃薯可溶性蛋白含量采用考马斯亮蓝G-250染色法测定[18-19]。
采用“S”形布点法采集土壤样品,一部分低温(4 ℃)保存,用于土壤微生物和菌丝密度测定;另一部分自然风干过筛,用于测定土壤理化性状。土壤EC和pH值用 1 ∶1 水浸提液法测定,速效磷采用碳酸氢钠浸提钼锑抗比色法测定,有效钾含量采用NH4OAC浸提-火焰光度法[20];磷酸酶活性采用改进的Tabatabai和Brimner法测定[21],以1 h内1 g土壤释放的对硝基酚含量代表磷酸酶活性。
1.5 数据统计与分析
所有试验数据用Microsoft Excel 2010进行均值和标准差计算并作图;利用统计分析软件SAS 8.0(SAS institute,Cary,NC,2003)进行方差分析,同时采用最小显著差数法(LSD)进行多重比较,显著性差异水平为0.05。
2 结果与分析
2.1 不同处理对马铃薯根系侵染率和土壤菌丝密度的影响
从图1和图2可以看出,接种AM真菌可显著提高马铃薯花期和成熟期根系侵染率和土壤菌丝密度。同一生长时期,3个处理下的马铃薯根系侵染率和土壤菌丝密度均表现为接菌>对照>施肥,其中成熟期的马铃薯根系侵染率和土壤菌丝密度高于花期下的相应处理,土壤菌丝密度差异显著。由于土壤中存在着一定数量的土著菌根真菌,对照与施肥处理下的马铃薯根系也一定程度被侵染,但显著低于接菌处理,说明通过人工接种的方法可以强化外来AM真菌在宿主植物根系上的定殖。
2.2 不同处理对马铃薯生长的影响
不同处理对马铃薯植株生长状况的影响各不相同,从表1可以看出,接菌处理、施肥处理与CK相比,显著增加了地上部干质量和降低了根冠比(P<0.05),同时提高了地下根系干质量,接菌处理与施肥处理间均未达到显著性差异。与CK相比,接种AM真菌提高了马铃薯根系主根长,但未达到显著差异;相反,施肥处理降低了马铃薯根系主根长和展度。同时,接种AM真菌相比施肥处理和CK提高了马铃薯根系的侧根数,差异显著。此外,接菌处理和施肥处理下的叶片叶色值显著高于CK。


2.3 不同处理对马铃薯产量与品质的影响
不同处理间马铃薯块茎直径等级分布和产量差别较大(表2)。不同处理对马铃薯块茎产量影响很大,接菌处理在CK基础上增产4 747 kg/hm2,增产率达14.01%;相比于施肥处理,接菌处理增产效果略低,但差异性未达到显著水平。接种丛枝菌根真菌对于提高该区域马铃薯块茎产量有一定潜力。块茎直径在2~4、4~6 cm范围时,接菌处理马铃薯所占比例低于对照和施肥处理,其中在2~4 cm范围差异显著;直径在6~8 cm等级范围,接菌处理和对照均显著高于施肥处理,接菌处理在此等级范围所占比例最高,为58.3%;块茎直径大于8 cm时,接菌处理>施肥处理>对照,各组之间差异显著,接菌处理占统计总数的16.7%,对照处理则没有统计到该直径等级的马铃薯块茎。可以看出,接种丛枝菌根真菌能够促进马铃薯块茎生长,增加大块茎马铃薯数量。

表1 不同处理对马铃薯植株生长状况的影响
注:同列数据后不同小写字母表示不同处理之间差异显著(P<0.05)。下同。

表2 不同处理对马铃薯块茎的大小及其分布频率的影响
接菌处理马铃薯单个块茎平均质量显著高于其他2个处理(图3),比对照和施肥处理分别显著高出25.96%、30.79%。相比于对照和接菌处理,施肥处理增加了马铃薯的产量,但其马铃薯块茎平均质量小于对照和接菌处理,可见施肥处理只是增加了小块茎马铃薯的数量,降低了马铃薯的品相。

维生素C(vitamin C)是一种水溶性维生素,水果和蔬菜中浓度丰富,在氧化还原代谢反应中起调节作用。可溶性蛋白和可溶性糖是人体必需的的营养物质,其浓度可以反映果实的品质。接菌显著增加了马铃薯块茎中可溶性蛋白的浓度,且对可溶性糖和粗纤维的合成有一定的促进作用(表3)。不同处理间的可溶性蛋白含量、可溶性糖浓度和粗纤维浓度均表现出以下规律:接菌处理>施肥处理>对照,其中接菌处理可溶性蛋白浓度达2.91 mg/kg,分别比对照和施肥处理显著提高了12.79%和12.36%;接菌处理马铃薯可溶性糖和粗纤维浓度分别为2.93 mg/kg、14.69 g/kg,均显著高于对照浓度,但与施肥处理差异不显著。接菌处理马铃薯块茎中维生素C浓度最高,但与对照和施肥处理间差异不显著。可见人工接种AM真菌,对于提升马铃薯品质具有积极影响。
2.4 不同处理对土壤养分改良效应
从表4可以看出,试验田土壤pH值为7.99~8.16,呈弱碱性。相比于对照和施肥处理, 接菌处理土壤 pH值在马铃薯各生长时期始终维持在较为稳定的水平,且呈下降趋势,有利于为植物生长创造更加稳定的根际环境。各处理不同时期EC均为播前>花期>成熟期,说明随着植物的生长,土壤中的养分离子不断被消耗,EC呈下降趋势,施肥处理成熟期土壤EC下降最多。与花期相比,接菌处理成熟期有效磷浓度有增加的趋势,且成熟期接菌处理有效磷浓度显著高于其他2种处理,分别是对照和施肥处理的1.74、2.26倍,说明接种丛枝菌根在成熟期有效地提高了马铃薯根际土壤中有效磷的浓度,降低了土壤养分亏损。有效钾浓度的变化规律与有效磷相似,成熟期有效钾浓度都存在不同程度的减少,施肥处理降幅最大,达105.65 mg/kg,接菌处理降幅最小。接菌处理成熟期土壤有效钾浓度显著高于施肥处理。马铃薯成熟期时根际土壤磷酸酶活性与该时期有效磷浓度呈相同趋势:接菌处理>对照处理>施肥处理,但差异不显著。接种丛枝菌根真菌对土壤理化性状有明显改善效果,接菌提高了成熟期马铃薯根际土壤中有效磷和有效钾浓度,提高了土壤电导率,表现出综合的土壤培肥效果。

表3 不同处理对马铃薯块茎品质的影响
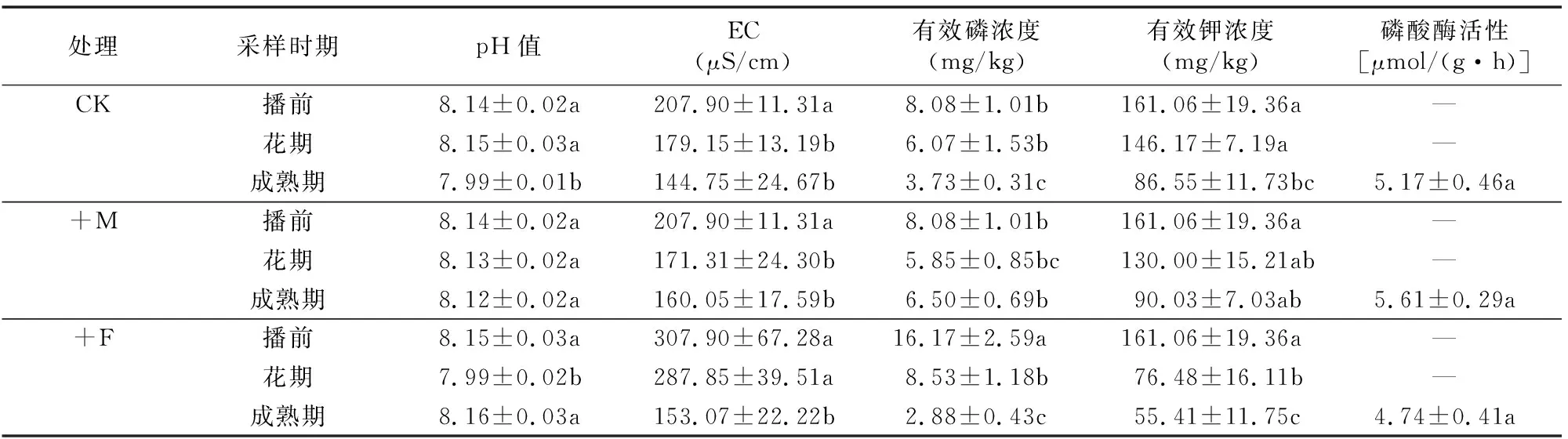
表4 接菌处理对花期和成熟期马铃薯根际土壤因子的影响
3 讨论
AM真菌可以侵染80%以上的有花植物根系,促进植物生长[22]。AM真菌显著增加植物根系侧根数,这可能是由于菌根孢子自身含有微量生长素,且菌根可以诱导根系内源多胺和激素代谢[23],因而能改善植物根系形态,也能改善马铃薯的品相。AM真菌对作物株高、侧根数、叶绿素浓度等指标的影响,最终体现在作物的产量与品质上。AM真菌能增加植株侧根数量,提高根系吸收能力,从而促进地上部分的生长,为高产打下基础[24]。且发达的根系有助于植物更好地吸收水分和营养物质,从而提高果实品质。马铃薯植株生长旺盛期和块茎迅速膨大期,需要叶片积累大量光合产物并转移到根茎[25]。接菌处理能促进植物地上部分生长,提高叶面积和SPAD值,使植物合成更多碳水化合物并将其向块茎中转移,从而提高作物产量。磷对马铃薯营养生长、块茎形成和淀粉积累有重要作用[26]。AM真菌促进了作物对磷营养的吸收,促进了作物的生长,改善了叶绿素含量[27],有利于更多的光合产物运输到地下块茎中积累,提高单个块茎的质量和直径。施用化肥能够起到促进作物生长的效果,但由于其养分供应不持续性,如在作物生长的前期可能过分地促进枝叶徒长,在块茎有机物积累阶段又会出现营养亏缺的现象,从而导致单株所产的块茎数量较多,单个块茎的质量和直径较小。AM真菌通过建立互惠共生体来满足植株对养分的需求,均衡植株营养,提高农产品品质。接菌处理提高了块茎中可溶性糖和维生素C浓度,其可溶性蛋白和粗纤维浓度均显著增加,这与吴建新等对草莓接菌处理影响其品质的研究成果[28]相一致。接种AM真菌能够改善植物对营养的吸收和利用,以此来获得较好的增产和提高品质的效果[29]。接菌处理显著提高了植株地上部干质量,使植株地上部分发达,更有利于进行光合作用,有利于维生素C的积累。相对于传统农业的施肥处理,接种AM真菌不仅提高了农产品产量,还改善了马铃薯品质,对于提高当地农业生产的可持续性有着巨大的潜力。
土壤-AM真菌-根系三者形成的有机整体对根际微环境和土壤质量存在深刻影响[30-31]。先前的研究发现,AM真菌能够提高宿主对难溶性磷的利用[32],岳辉等研究发现,接种AM真菌增加了根际土壤有效磷浓度[33],本试验结果与其一致。接种AM真菌在增加马铃薯产量的同时提高了成熟期土壤中速效养分浓度,这可能是由于马铃薯生长过程中吸收了土壤中大量有效磷,导致土壤中磷浓度降低,触发了AM真菌将磷向有效态的转化,从而提高了土壤有效磷浓度。施肥处理产量最高,但施肥处理马铃薯植株对土壤中有效磷、有效钾吸收量较高,土壤养分严重亏损,不利于持续性农业生产。以往的研究多是对AM真菌在贫瘠土壤中促进植物生长和土壤改良进行报道。本研究发现,在长年施肥连作土壤环境下,AM真菌对改善植物营养状况和土壤质量有较好的效果,AM真菌与植物形成互惠共生体,调节植物生长和营养状况,促进土壤中营养元素转化为有效态,改善土壤肥力,减小土壤养分亏损,有利于农田土壤的可持续利用。
4 结论
接种AM真菌可以促进马铃薯生长、改善品质,改良土壤养分,对于西北黄土高原区绿色有机农业具有重要的应用价值与潜力。取得的主要结论如下:(1)AM真菌和马铃薯形成良好互惠共生关系,接菌处理显著增加了马铃薯植株地上部干质量和侧根数,降低根冠比,促进植物生长与产量提高,促进了磷、钾养分的积累,改良了土壤性状,为其高产打下基础。(2)接种AM真菌提高了马铃薯品相与品质,具有明显的菌根效应。接菌后单个马铃薯块茎质量和直径均有显著增加,直径>8 cm马铃薯块茎显著高于施肥和对照。相比于对照处理,接菌处理均显著提高马铃薯块茎可溶性糖含量、可溶性蛋白含量和粗纤维浓度,同时接菌处理下的可溶性蛋白质含量也显著高于施肥处理。
:
[1]胡 宇. 施肥对不同连作年限马铃薯生长及土壤养分的影响[D]. 兰州:甘肃农业大学,2009.
[3]Smith S E,Read D F. Mycorrhizal symbiosis[M]. 3rd ed. London:Academic,2008:51-63.
[4]刘 茵. 菌根及丛枝菌根概述[J]. 生物学教学,2010,35(8):8-10.
[5]Fang S,Gao X,Deng Y,et al. Crop root behavior coordinates phosphorus status and neighbors:from field studies to three-dimensionalinsitureconstruction of root system architecture[J]. Plant Physiology,2011,155(3):1277-1285.
[6]赵青华,孙立涛,王 玉,等. 丛枝菌根真菌和施氮量对茶树生长、矿质元素吸收与茶叶品质的影响[J]. 植物生理学报,2014,50(2):164-170.
[7]Gholamhoseini M,Ghalavand A,Dolatabadian A,et al. Effects of arbuscular mycorrhizal inoculation on growth,yield,nutrient uptake and irrigation water productivity of sunflowers grown under drought stress[J]. Agricultural Water Management,2013,117(1):106-114.
[8]Baslam M,Esteban R,García-Plazaola J I,et al. Effectiveness of arbuscular mycorrhizal fungi (AMF) for inducing the accumulation of major carotenoids,chlorophylls and tocopherol in green and red leaf lettuces[J]. Applied Microbiology and Biotechnology,2013,97(7):3119-3128.
[9]Baslam M,Garmendia I,Goicoechea N. Enhanced accumulation of vitamins,nutraceuticals and minerals in lettuces associated with arbuscular mycorrhizal fungi (AMF):a question of interest for both vegetables and humans[J]. Agriculture,2013,3(1):188-209.
[10]王林闯,贺超兴,张志斌. AM真菌对不同栽培基质甜椒生长及产量品质的影响[J]. 中国蔬菜,2010(16):32-37
[11]Yu T,Gabriel-Neumann E,Ngwene B,et al. Effects of single and mixed inoculation with two arbuscular mycorrhizal fungi in two different levels of phosphorus supply onβ-carotene concentrations in sweet potato (IpomoeabatatasL.) tubers[J]. Plant and Soil,2013,372(1/2):361-374.
[12]徐海燕,雷世梅,熊 伟,等. 丛枝菌根化枳橙根际微生态环境的研究[J]. 西南大学学报(自然科学版),2012,34(10):65-71.
[13]贺学礼,陈 程,何 博. 北方两省农牧交错带沙棘根围AM真菌与球囊霉素空间分布[J]. 生态学报,2011,31(6):1653-1661.
[14]冯欣欣,唐 明,龚明贵,等. 黄土高原狼牙刺丛枝菌根与球囊霉素的空间分布[J]. 西北农林科技大学学报(自然科学版),2011,39(6):96-102.
[15]李合生. 植物生理生化实验原理与技术指导[M]. 北京:高等教育出版社,2000:134-137.
[16]蔡邦平,陈俊愉,张启翔,等. 中国梅丛枝菌根侵染的调查研究[J]. 园艺学报,2008,35(4):599-602.
[17]Abbott L K,Obson A D,Boer G D. The effect of phosphorus on the formation of hyphae in soil by the vesicular-arbuscular mycorrhizal fungus,Glomusfasciculatum[J]. New Phytologist,1984,97(3):437-446.
[18]陆文静,李奕松. 植物生理学实验教程[M]. 北京:中国林业出版社,2012:13-19.
[19]蔡庆生. 植物生理学实验[M]. 北京:中国农业大学出版社,2013:25-30.
[20]鲍士旦. 土壤农化分析[M]. 北京:中国农业出版社,2005:256-273.
[21]赵兰坡,姜 岩. 壤磷酸酶活性测定方法探讨[J]. 土壤通报,1986,17(3):138-141.
[22]蔡邦平,陈俊愉,张启翔,等. 中国梅丛枝菌根侵染的调查研究[J]. 园艺学报,2008,35(4):599-602.
[23]Wu Q S,He X H,Zou Y N,et al. Arbuscular mycorrhizas alter root system architecture ofCitrustangerinethrough regulating metabolism of endogenous polyamines[J]. Plant Growth Regulation,2012,68(1):27-35.
[24]冯 烨,郭 峰,李宝龙,等. 单粒精播对花生根系生长、根冠比和产量的影响[J]. 作物学,2013,39(12):2228-2237.
[25]李文婷. 马铃薯产量形成的源库关系及水氮对其的调控[D]. 咸阳:中国科学院研究生院(教育部水土保持与生态环境研究中心),2016.
[26]徐洪岩,王建红,王立春,等. 磷对马铃薯品种克新21号产量构成因子及淀粉性状的影响[J]. 中国种业,2014(1):49-51.
[27]顾 冕,陈爱群,徐国华. 植物缺磷及菌根信号转导网络[J]. 南京农业大学学报,2012,35(5):133-146.
[28]吴建新,王幼珊,左 强,等. 接种丛枝菌根真菌对草莓基质育苗生长及果实品质的影响[J]. 北方园艺,2011(15):49-50.
[29]Hart M M,Forsythe J A. Using arbuscular mycorrhizal fungi to improve the nutrient quality of crops; nutritional benefits in addition to phosphorus[J]. Scientia Horticulturae,2012,148(1):206-214.
[30]杜俊卿. 接种丛枝菌根真菌对不同绿化植物根际微环境的影响[J]. 江苏农业科学,2017,45(18):149-152.
[31]宰学明,张焕仕,纪易凡,等. 引种滨梅菌根侵染特性研究[J]. 江苏农业科学,2016,44(11):238-240.
[32]Ngwene B,Boukail S,Söllner L,et al. Phosphate utilization by the fungal root endophyte Piriformo sporaindica[J]. Plant and Soil,2016,405(1/2):1-11.
[33]岳 辉,毕银丽,Zhakypbek Y,等. 接种菌根对神东矿区采煤沉陷地的生态修复效应[J]. 科技导报,2012,30(36):56-60.

