孕期针对性补充叶酸对血清HCY水平的影响
许雅娟,洪 腾,翟闪闪,柳 蕊,任利单,余艳茹,班彦杰,冉利敏,胡璐璐,罗晓华,刘月华,韩 宁
郑州大学第三附属医院产科 郑州 450052
同型半胱氨酸(homocysteine,HCY)是人体内一种含硫氨基酸,是蛋氨酸和半胱氨酸代谢过程的中间产物,具有重要的生理功能[1]。近年来发现,血液中HCY浓度升高,容易导致血管内皮损伤[2],与习惯性流产、妊娠高血压疾病、胎盘早剥、胎儿生长受限、胎儿畸形、死胎、早产、低体重儿等的发生密切相关[3]。叶酸为HCY代谢提供甲基,被认为是目前高同型半胱氨酸血症致病的潜在治疗药物之一[4],且孕期使用安全。本研究探讨不同遗传体征的孕妇口服叶酸对血清HCY的影响,为临床预防高同型半胱氨酸血症提供依据。
1 对象与方法
1.1研究对象选取2015年7月到2017年9月来我院定期围产保健、18~35岁、汉族、单胎、自然受孕,且确认为宫内早孕的孕妇。纳入标准:入组时均为健康孕妇;无妊娠并发症、无不良孕产史;能够按要求随访,并定期接受健康饮食指导。排除标准:曾行胃肠手术或患有严重的消化系统疾病、肝肾功能不全者;患有冠心病、糖尿病、甲状腺疾病、恶性肿瘤、血液系统或免疫系统疾病等;近期应用影响叶酸和维生素B12吸收的药物如抑酸药质子泵抑制剂及H2受体阻滞剂、避孕药及阿司匹林等;曾经妊娠发生过神经管缺陷或一级亲属妊娠曾发生神经管缺陷;严重贫血、严重硬皮病等疾病以及应用氨甲蝶呤、一氧化氮、抗癫痫药、利尿药、烟酸等药物;有吸烟、饮酒等不良嗜好等。按照以上标准,共1 900人纳入本研究。经伦理委员会批准,所有研究对象均认真阅读并签署知情同意书。对所有纳入者均进行孕期营养膳食指导。采用问卷调查方式采集研究对象的年龄、身高、体重等一般资料。随访过程中,失访228人,中途退出240人,最终纳入1 432人。根据谢幸等[5]编著的第8版《妇产科学》定义早孕期(0~13+6周)、中孕期(14~27+6周)、晚孕期(28周以后)。
1.2遗传体征和血清HCY水平的检测采集研究对象口腔黏膜上皮细胞,采用荧光定量PCR、DNA测序等方法检测5,10-亚甲基四氢叶酸还原酶(methylene tetrahydrofolate reductase,MTHFR)基因C677T、A1298C和蛋氨酸合成还原酶(methionine synthetic reductase,MTRR)基因A66G多态性,根据各基因位点功能、纯合、杂合及出现频率,对叶酸利用能力进行风险分级,其中零级为未发现风险,表明叶酸利用能力正常;一级和二级为低风险,表明叶酸利用能力略差;三级、四级和五级为中风险,表明叶酸利用能力较差;六级和七级为高风险,表明叶酸利用能力很差。根据叶酸利用能力分为4组,最终未发现风险组340人、低风险组330人、中风险组358人、高风险组404人。未发现风险组分为口服0.4 mg叶酸组170人和未干预组170人;低、中、高风险组分成0.4 mg叶酸组(低风险组160人、中风险组186人、高风险组204人)和0.8 mg叶酸组(低风险组170人、中风险组172人、高风险组200人)。采用直接化学发光法及酶法检测孕妇早、中、晚孕期血清HCY水平。
1.3统计学处理采用SPSS 21.0处理数据,各组早、中、晚孕期血清HCY水平的比较采用重复测量数据的方差分析,多组之间两两比较采用Bonferroni法。检验水准α=0.05。
2 结果
2.1未发现风险孕妇孕期血清HCY水平的变化
未干预组在早孕期水平最高,中孕期降低,晚孕期水平再次升高;0.4 mg叶酸组中、晚孕期血清HCY水平低于早孕期,且在早、中、晚孕期均低于未干预组(P<0.05)。见表1。
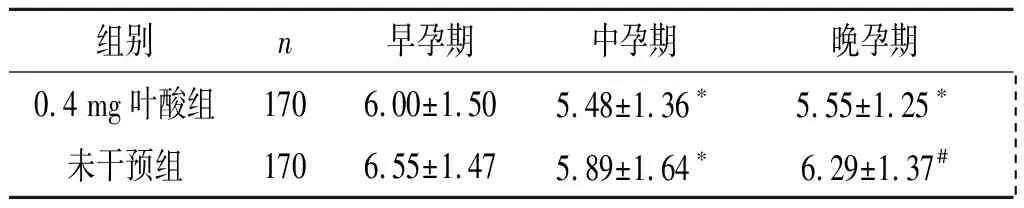
表1 未发现风险孕妇孕期血清HCY水平的变化 μmol/L
F组间=52.874,P<0.001;F时间=12.510,P<0.001;F交互=7.326,P=0.001;*:与早孕期比较,P<0.017;#:与中孕期比较,P<0.017
2.2低风险孕妇孕期血清HCY水平的变化口服0.4 mg和0.8 mg叶酸的低风险孕妇中、晚孕期血清HCY水平均低于早孕期;0.4 mg和0.8 mg叶酸组血清HCY水平在早、中、晚孕期差异均无统计学意义。见表2。
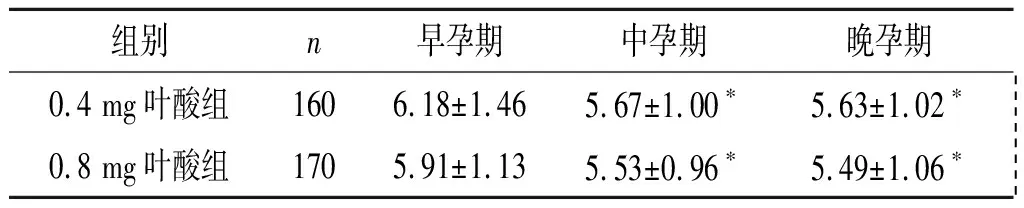
表2 低风险孕妇孕期血清HCY水平的变化 μmol/L
F组间=5.148,P=0.024;F时间=15.342,P<0.001;F交互=0.299,P=0.742;*:与早孕期比较,P<0.017
2.3中风险孕妇孕期血清HCY水平的变化0.4 mg叶酸组中孕期降低,晚孕期升高;0.8 mg叶酸组中、晚孕期降低;0.4 mg叶酸组在早、中、晚孕期均高于0.8 mg叶酸组。见表3。
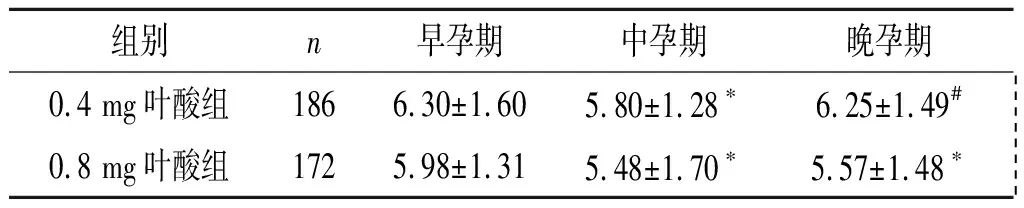
表3 中风险孕妇孕期血清HCY水平的变化 μmol/L
F组间=23.292,P<0.001;F时间=9.789,P<0.001;F交互=1.800,P=0.167;*:与早孕期比较,P<0.017;#:与中孕期比较,P<0.017
2.4高风险孕妇孕期血清HCY水平的变化0.4 mg
叶酸组中孕期降低,晚孕期升高;0.8 mg叶酸组在中、晚孕期降低;0.4 mg叶酸组在早、中、晚孕期均高于0.8 mg叶酸组。见表4。
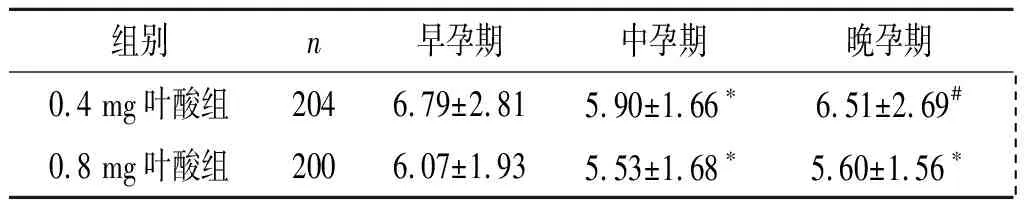
表4 高风险组孕妇孕期血清HCY水平的变化 μmol/L
F组间=29.413,P<0.001;F时间=13.080,P<0.001;F交互=1.939,P=0.146;*:与早孕期比较,P<0.017;#:与中孕期比较,P<0.017
3 讨论
HCY是蛋氨酸和半胱氨酸代谢过程的中间产物,本身不参与蛋白合成[1]。其代谢有两条途径:①蛋氨酸循环: 约50%HCY在蛋氨酸合成酶催化作用下, 以亚甲基四氢叶酸为甲基供体, 重新生成蛋氨酸,MTHFR、MTRR及丝氨酸羟甲基转移酶是蛋氨酸循环中的重要酶, 遗传性酶缺陷可导致高同型半胱氨酸血症。②分解代谢:当半胱氨酸缺乏或蛋氨酸合成过多时, HCY与丝氨酸在胱硫醚β合成酶作用下形成胱硫醚, 然后在胱硫醚裂解酶作用下形成半胱氨酸, 最后生成丙酮酸、硫酸和水。
血清HCY水平的影响因素包括遗传因素、营养因素和饮食因素。本研究中各组孕妇入组时均进行定期健康饮食指导且依从性好。研究[6-8]发现血清叶酸和HCY呈负相关,补充叶酸可降低血清HCY水平。有研究[9]显示:机体正常状态时,女性妊娠期血清HCY水平应当低于非妊娠期,且HCY水平于妊娠中期达最低。本研究中4个风险组孕妇中孕期血清HCY水平均较早孕期降低,这可能与血液稀释、白蛋白下降、肾脏功能增强等有关,同时,早孕期的叶酸补充及雌激素水平增高也会使中孕期HCY水平降低[10];而晚孕期遗传体征不同,叶酸补充剂量不同,血清HCY变化也不同。未发现风险组中未干预孕妇和中、高风险组中口服0.4 mg叶酸的孕妇晚孕期血清HCY水平较中孕期升高,这可能与妊娠晚期胎儿快速生长、甲基化和转甲基化作用加强而叶酸摄入量不足有关;而低、中、高风险组服用0.8 mg叶酸的孕妇中、晚孕期血清HCY水平均低于早孕期并维持在较低水平。
本研究结果显示未发现风险组补充0.4 mg叶酸的孕妇血清HCY水平均低于未干预者,说明未发现风险的孕妇孕期也应预防性补充叶酸。由于中、高风险者对叶酸的利用能力差,应增加叶酸的补充量;此外,晚孕期胎儿生长发育对叶酸的需求量也增多,因此中晚期应增加叶酸的补充量,防止晚孕期血清HCY升高,减少妊娠期并发症。
孕期叶酸的绝对或相对不足是引起高同型半胱氨酸血症的直接原因,MTHFR C677T、A1298C 和MTRR A66G 基因突变可导致关键酶活性降低,导致HCY向蛋氨酸转化受阻及DNA低甲基化,HCY在体内蓄积,形成高同型半胱氨酸血症[11]。体内HCY 积累产生大量的活性氧,严重损伤血管内皮细胞,可能引起胎盘血管病变、凝血系统异常等[12],孕早期可能导致流产[13]、胚胎停育[14],孕中晚期可能并发妊娠期高血压疾病、妊娠期糖尿病、早产、胎儿生长受限等[15]。所以根据孕妇叶酸利用能力,适量补充叶酸,定期监测血清HCY水平,可预防高同型半胱氨酸血症的发生,对妊娠期并发症的预防有重要意义。
总之,孕期血清HCY升高与妊娠并发症密切相关。不同遗传体征个体孕期对叶酸的利用能力存在差异,对叶酸的需要量亦不相同。科学补充叶酸、定期监测血清HCY水平可以预防妊娠后期血清HCY升高,进而改善妊娠结局。
[1] 张晓燕,牛秀敏.同型半胱氨酸与妊娠[J].中华妇产科杂志,2003,38(5):316
[2] LASKOWSKA M,LASKOWSKA K,OLESZCZUK J.Differences in the association between maternal serum homocysteine and ADMA levels in women with pregnancies complicated by preeclampsia and/or intrauterine growth restriction[J].Hypertens Pregnancy,2013,32(1):83
[3] BERGEN NE,JADDOE VW,TIMMERMANS S,et al.Homocysteine and folate concentrations in early pregnancy and the risk of adverse pregnancy outcomes: the Generation R Study[J].BJOG,2012,119(6):739
[4] 程丝,冯娟,王宪.高同型半胱氨酸血症治疗研究进展[J].生理科学进展,2011,42(5):329
[5] 谢幸,苟文丽.妇产科学[M].8版.北京:人民卫生出版社,2013.
[6] 黄华,梁红梅,罗奇智,等.孕妇血清同型半胱氨酸、叶酸、维生素B12水平与妊娠高血压综合征关系探讨[J].国际检验医学杂志,2014,35(21):2869
[7] 吴越.MTRR基因多态性与口服叶酸治疗HHcy疗效的关系[D].郑州:郑州大学,2015.
[8] KIM MW,HONG SC,CHOI JS,et al.Homocysteine, folate and pregnancy outcomes[J].J Obstet Gynaecol,2012,32(6):520
[9] 张玲,王鹓,陈祥云,等.血浆同型半胱氨酸水平与妊娠期高血压疾病的关系[J].山东医药,2015,55(25):33
[10]孙曼,宋薇薇.同型半胱氨酸与妊娠相关疾病关系研究进展[J].中国实用妇科与产科杂志,2016,32(8):814
[11]MANDAVIYA PR,STOLK L,HEIL SG.Homocysteine and DNA methylation: a review of animal and human literature[J].Mol Genet Metab,2014,113(4):243
[12]黄泳华,罗中明,朱伟淑,等.同型半胱氨酸、叶酸、维生素B_(12)与妊娠高血压综合征发病的关系[J].中华妇产科杂志,2002,37(4):19
[13]BAILEY LB,BERRY RJ.Folic acid supplementation and the occurrence of congenital heart defects, orofacial clefts, multiple births, and miscarriage[J].Am J Clin Nutr,2005,81(5):1213S
[14]何可人,姚吉龙,刘庆芝,等.孕早期血清 HCY 及叶酸水平与原因不明自然流产的关系[J].中国计划生育和妇产科,2015,7(3):27
[15]李克深,孙延芝,陈黎明,等.妊娠高血压综合征患者亚甲基四氢叶酸还原酶基因多态性与血浆中同型半胱氨酸水平测定[J].中华妇产科杂志,2000,35(4):205

