大豆11S球蛋白热力学特性和溶液性质与表面疏水性关系研究
李 丹,魏冬旭,贾 烨,刘春雷,江连洲
(1.宁德师范学院,福建宁德 352100;2.黑龙江出入境检验检疫局,黑龙江哈尔滨 150001;3.杭州娃哈哈集团有限公司,浙江杭州 310018;4.东北农业大学 食品学院,黑龙江哈尔滨 150030)
蛋白质的表面疏水性是由于部分疏水基团暴露于蛋白质表面引起的,是影响分子间相互作用的主要因素,是衡量蛋白质功能性质的关键指标之一。蛋白质的表面疏水性与蛋白质的理化性质和结构特性等密切相关。差示扫描量热法(DSC)是一种研究热性质的有效手段,变性温度(Td)反应蛋白质的热稳定性,变性焓(ΔH)是疏水作用和蛋白质结构紧密性的重要指标[1]。溶解性是大豆蛋白质可应用性的重要参数,是大豆蛋白质最重要的功能特性之一,溶解性差,通常伴随着功能特性较差[2]。溶液性质是大豆蛋白质实际应用中的重要性质之一,是大豆蛋白质功能特性的基础。溶液中可溶性聚集物的分子量及其分布以及流体动力学半径及其分布反映蛋白质的聚集程度。ξ-电位反映蛋白质表面电荷情况,与表面疏水性共同作用,影响蛋白质溶液的稳定性[3]。
近年来,大量研究表明大豆蛋白质的理化性质和结构特性随大豆品种和产地的不同而有所差异[4-6],而关于大豆蛋白质的表面疏水性与其理化性质和结构特性的关系研究报道不多,且研究大多数是以SPI(大豆分离蛋白)为对象,从纯品大豆11S球蛋白的角度来研究品种差异对大豆蛋白表面疏水性的影响,探讨大豆蛋白质热力学特性和溶液性质与表面疏水性的关系,在国内外鲜有报道。本研究选择我国常用的、具有区域代表性的11个大豆品种制备的11S球蛋白为实验对象,探讨大豆11S球蛋白热力学特性和溶液性质与表面疏水性的关系,以期为今后开发大豆蛋白质特定功能性产品而进行的分子设计和重组提供重要的理论指导。
1 材料与方法
1.1 材料与仪器
大豆 东农42,东北农业大学大豆研究所;黑农46、合丰55 黑龙江省农业科学院大豆研究所;冀豆12 河北省农林科学院粮油作物研究所;皖豆28 安徽省农业科学院作物研究所;福豆234 福建省农业科学院作物研究所;ANS(1-苯胺基-8-萘磺酸) Sigma公司;KH2PO4、K2HPO4、NaCl、β-巯基乙醇 为优级纯,其余试剂为国产分析纯;标准蛋白(甲状腺球蛋白、醛缩酶、牛血清白蛋白、卵白蛋白、腺苷酸激酶、激血球素) 上海康朗生物科技有限公司。
AKTA-蛋白质纯化仪 美国GE公司;HiLoad 16/60 Superdex 200 prep grade凝胶预装柱 美国GE公司;PE Pyris6差示扫描量热仪 美国PULUS TA.XT公司;Zeta Plus电位及激光粒度分析仪 美国布鲁克海文仪器公司;722型可见分光光度计 上海光谱仪器有限公司。
1.2 实验方法
1.2.1 大豆前处理 不同品种大豆样品粉碎后过40目筛,用正己烷脱脂,得脱脂大豆粉,以脱脂豆粉为原料制备大豆11S球蛋白,用凯氏定氮和SDS-PAGE电泳综合分析其纯度均在95%以上[7],备用。
1.2.2 表面疏水性的测定 采用ANS荧光探针法,具体参照李丹[8]和刘春雷等[9]的方法测定大豆蛋白的表面疏水性。
1.2.3 热力学特性分析 利用PE Pyris 6-DSC热力分析仪测定不同品种大豆11S球蛋白的热力学特性[10]。称取5 mg的样品放入铝盒中,再向其中加入10 μL的pH7.6的磷酸盐缓冲液,压盘密封,室温条件下放置6 h。温度扫描范围:20~120 ℃;升温速率:10 ℃/min;在120 ℃保持1 min;随后从120 ℃降温至20 ℃,降温速率:30 ℃/min。记录此过程中样品的变性温度(Td)和变性焓变(ΔH)。
1.2.4 溶解性的测定 参考Samoto等[11]的方法。将200 mg样品分散于20 mL去离子水中,室温下磁力搅拌30 min,室温离心(10000×g,20 min)。上清液经适度稀释,采用Lowry法测定蛋白质含量,吸光度横坐标,蛋白质浓度为纵坐标,标准曲线如图1所示。
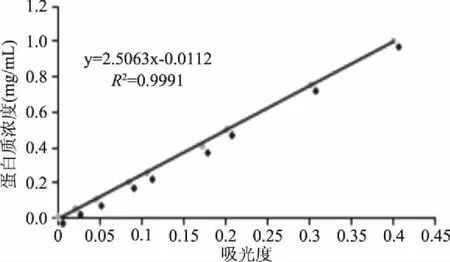
图1 Lowry法蛋白含量测定试剂盒标准曲线
样品溶解度(%)=上清液蛋白质量浓度/(样品质量浓度×样品蛋白质含量)×100
1.2.5 蛋白质溶液性质的测定
1.2.5.1 溶液的平均分子量分布的测定 采用体积排阻-凝胶色谱(SEC-HPLC)研究不同品种大豆11S球蛋白的分子量分布。应用AKTA-蛋白质纯化仪和HiLoad 16/60 Superdex 200 prep grade凝胶预装柱,采用紫外检测器在280 nm处检测。流动相为pH7.6的磷酸盐缓冲液(2.6 mmol/L KH2PO4,32.5 mmol/L K2HPO4,0.4 mol/L NaCl,10 mmol/Lβ-巯基乙醇,离子强度0.5,pH7.6),在使用前经0.22 μm水系醋酸纤维素滤膜真空抽滤处理。通过预实验,最终确认参数条件为流速1 mL/min,限制压强0.3 MPa,柱温25 ℃。进样浓度10 mg/mL,进样量1 mL,进样前样品过0.22 μm水系醋酸纤维素滤膜处理。
选择6种标准蛋白进行标准曲线的绘制,分别为:甲状腺球蛋白,分子量为669 kDa;醛缩酶,分子量为158 kDa;牛血清白蛋白,分子量为67 kDa;卵白蛋白,分子量为43 kDa;腺苷酸激酶,分子量为32 kDa;激血球素,分子量为17 kDa。标准曲线以洗脱体积为横坐标,分子量的自然对数为纵坐标,如图2所示。
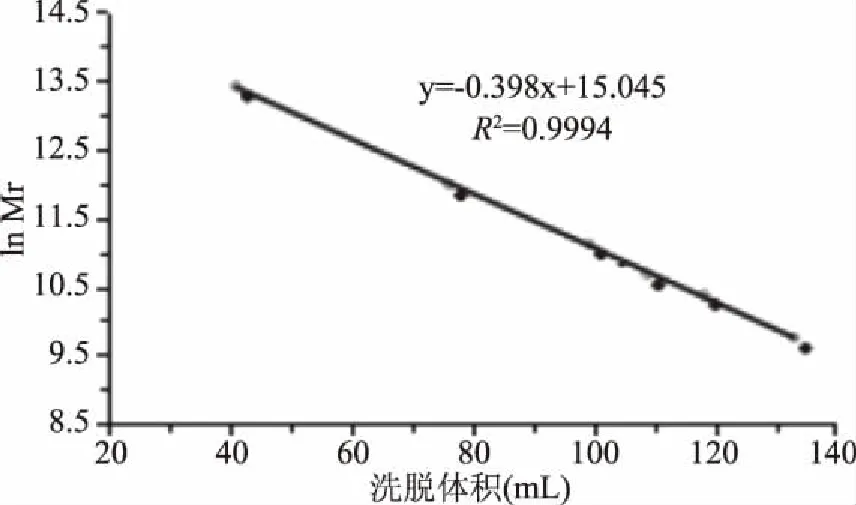
图2 标准蛋白SEC-HPLC标准曲线
1.2.5.2 流体动力学半径及其分布的测定 采用Zeta Plus粒度分析仪测定不同品种大豆11S球蛋白的流体动力学半径及其分布。将样品用pH7.6的磷酸盐缓冲液配制成浓度为0.2%的蛋白溶液,过0.45 μm水系醋酸纤维素滤膜,室温下进行测量,取三次测量的平均值。
1.2.5.3 ζ-电位的测定 采用Zeta Plus Zeta-电位仪测定不同品种大豆11S球蛋白溶液的ζ-电位。将样品用pH7.6的磷酸盐缓冲液配制成浓度为0.2%的蛋白溶液,上样体积为1 mL,测定温度为25 ℃。重复测量6次取平均值。
1.3 数据处理
单项实验重复3次,结果表示为均值±标准差。采用SPSS V18.0软件对数据进行单因素方差分析和相关性分析,如果方差分析差异性显著(p<0.05),则使用Duncan进行多重比较。采用Origin 8.0软件等进行图谱分析处理和图表制作。
2 结果与分析
2.1 表面疏水性分析
如图3所示,6个品种大豆11S球蛋白的表面疏水性指数在1432.73~1623.00之间,东农42>合丰55>黑农46>冀豆12>皖豆28>福豆234。可见,品种差异对大豆11S球蛋白的表面疏水性影响极显著(p<0.01),这可能与不同品种大豆11S球蛋白的结构特性和理化性质差异有关。

图3 不同品种大豆11S球蛋白的表面疏水性
2.2 热力学特性与表面疏水性的关系
由表1可知,6个品种大豆11S球蛋白之间的Td存在显著性差异(p<0.01),福豆234>皖豆28>冀豆12>合丰55>黑农46>东农42;品种之间变性焓存在显著性差异(p<0.01),福豆234>皖豆28>冀豆12>黑农46>合丰55>东农42。可见,品种差异对大豆11S球蛋白的热力学特性影响极显著。相关性分析表明:大豆11S球蛋白的表面疏水性与Td值呈显著负相关(p=0.010),相关性系数为-0.918;与变性焓ΔH值呈显著负相关(p=0.012),相关性系数为-0.908。分析其原因为:大豆11S球蛋白的热变性温度与变性焓较大时,其热稳定性较高,使其完全变性所需要的能量较大,说明稳定其高级结构的氢键数量较多,分子结构紧密、构象稳定,暴露于分子表面的疏水性氨基酸残基较少,使其具有较低的表面疏水性。
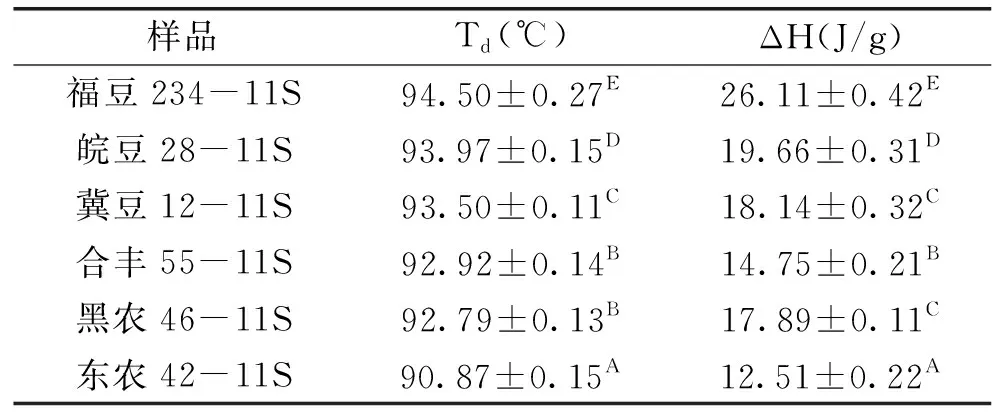
表1 不同品种大豆11S球蛋白的DSC分析结果
2.3 溶解性与表面疏水性的关系
如图4所示,6个品种的大豆11S球蛋白均具有良好的溶解性,溶解度在85.69%~90.41%之间,福豆234>皖豆28>冀豆12>黑农46>合丰55>东农42,品种差异对大豆11S球蛋白的溶解性影响极显著(p<0.01)。相关性分析表明:大豆11S球蛋白的溶解性与表面疏水性呈极显著负相关(p=0.003),相关性系数为-0.953。分析其原因为:影响蛋白质溶解性的主要相互作用为疏水相互作用和离子相互作用。表面疏水性反映了蛋白质疏水相互作用的大小,表面电荷反映了离子相互作用的大小。Bigelow指出电荷、表面疏水性是决定蛋白质溶解性的两个主要的特性,电荷越高、表面疏水性越低,蛋白质溶解性越好[12]。表面电荷的多少取决于蛋白质自身带电荷情况和溶液的离子强度,因此在低离子强度时,大豆11S球蛋白的溶解性受表面疏水性的影响较大。

图4 不同品种大豆11S球蛋白的溶解性
2.4 溶液的平均分子量及其分布与表面疏水性的关系
如图5所示,6个品种大豆11S球蛋白溶液的分子量分布相似,均为一个主峰和三个小峰。通过标准蛋白SEC-HPLC标准曲线进行计算,主峰分子量约为370.49~376.43 kDa,与11S球蛋白在中性pH条件下的分子量相符[13],约占总量的83.00%;第一个小峰分子量约为594.21~640.13 kDa,是11S球蛋白的二聚体15S[14],约占总量的3.00%~5.00%;第二个小峰分子量约为468.73~474.93 kDa,是11S球蛋白的单聚体[14],约占总量的11.00%~14.00%;第三个小峰分子量约为148.27~149.57 kDa,是大豆7S球蛋白[15],是大豆11S球蛋白制备过程中存留的杂质,约占总量的1.30%~1.70%,因含量极少,在基线以下,故可忽略不计。

图5 不同品种大豆11S球蛋白溶液的分子量分布图谱
分析结果显示,6个品种大豆11S球蛋白溶液中可溶性聚集物的平均分子量依次为东农42(397.73 kDa)>合丰55(395.74 kDa)>黑农46(395.43 kDa)>冀豆12(394.99 kDa)>皖豆28(393.43 kDa)>福豆234(392.88 kDa)。相关性分析表明:大豆11S球蛋白溶液可溶性聚集物的平均分子量与表面疏水性呈极显著正相关(p=0.005),相关性系数为0.945。分析其原因为:大豆11S球蛋白的表面疏水性越小,即蛋白质表面的疏水相互作用越弱,溶液中形成的大分子聚集物越少,可溶性聚集物体积也越小,表现为平均分子量越小。
2.5 流体动力学半径及其分布与表面疏水性的关系
如图6所示,6个品种大豆11S球蛋白的流体动力学半径分布相似,均呈现双峰分布。分析结果显示:峰1粒子较小,为天然大豆11S球蛋白分子;峰2粒子相对较大,为大豆11S球蛋白分子在溶液中形成的聚集体。6个品种大豆11S球蛋白溶液粒子的多分散性指数均较小,依次为东农42(0.41)>合丰55(0.40)>黑农46(0.39)>冀豆12和皖豆28(0.37)>福豆234(0.31),说明样品溶液粒径分布均匀[16]。6个品种大豆11S球蛋白溶液的平均粒子直径依次为东农42(143.20 nm)>合丰55(98.90 nm)>黑农46(74.40 nm)>冀豆12(66.80 nm)>皖豆28(51.20 nm)>福豆234(40.00 nm)。相关性分析表明:大豆11S球蛋白溶液可溶性聚集物的平均直径与表面疏水性呈显著正相关(p=0.007),相关性系数为0.930。这是因为大豆11S球蛋白的表面疏水性越小,蛋白质分子之间的吸引力疏水相互作用越小,蛋白质分子相互聚集的程度越小,形成的可溶性聚集物粒子越小且越均匀,从而表现出平均直径越小。

图6 不同品种大豆11S球蛋白的流体动力学半径分布图
2.6 ξ-电位与表面疏水性的关系
如图7所示,中性pH条件下,6个品种大豆11S球蛋白溶液的ξ-电位均为负值,且差异性极显著(p<0.01),绝对值依次为皖豆28(30.77 mV)>福豆234(30.19 mV)>冀豆12(29.02 mV)>黑农46(28.89 mV)>合丰55(27.67 mV)>东农42(23.09 mV)。相关性分析表明:大豆11S球蛋白的ξ-电位绝对值(即表面电荷)与表面疏水性呈显著负相关(p=0.034),相关性系数为-0.845,说明大豆11S球蛋白具有较高表面疏水性时,其溶液的ξ-电位绝对值较小,即蛋白质表面电荷较少。这可能是由于大豆11S球蛋白表面疏水性较高时,暴露于蛋白质表面的疏水基团数量较多,使蛋白质表面的极性氨基酸尤其是带电荷氨基酸相对减少,表面电荷量减少,从而使得ξ-电位绝对值较小。
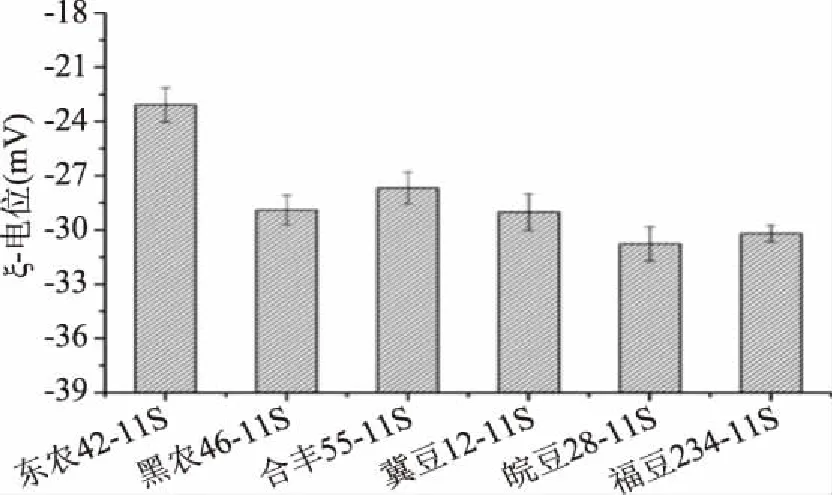
图7 不同品种大豆11S球蛋白的ξ-电位
3 结论
大豆11S球蛋白的表面疏水性与其热力学特性具有显著相关性,具体表现为:大豆11S球蛋白的表面疏水性与其变性温度呈显著负相关,相关性系数为-0.918;与其变性焓呈显著负相关,相关性系数为-0.908。大豆11S球蛋白溶液在低离子强度时,其溶解度受大豆11S球蛋白表面疏水性的影响较大,两者呈极显著负相关,相关性系数为-0.953。大豆11S球蛋白的溶液性质与其表面疏水性具有显著相关性,具体表现为:大豆11S球蛋白溶液可溶性聚集物的平均分子量与其表面疏水性呈显著正相关,相关性系数为0.945;平均直径与表面疏水性呈显著正相关,相关性系数为0.930;ξ-电位绝对值(即表面电荷)与表面疏水性呈显著负相关,相关性系数为-0.845。
[1]Lakemond C M M,Dejonth H H J,Hessing M,et al.Heat denaturation of soy glycinin:Influence of pH and ionic strength on molecular structure[J].Journal of Agricultural and Food Chemistry,2000,48(6):1991-1995.
[2]Guan X,Yao H Y,Chen Z X.Some functional properties of oat bran protein concentrate modified by tuypsin[J].Food Chemistry,2007,101:163-170.
[3]Matsudimi N,Ishimura Y,Kato A.Improvement of gelling properties of ovalbumin by heating in dry state[J].Agricultural and Biological Chemistry,1991,55(3):879-881.
[4]Wang Wenyi,Bringe N A,Berhow M A,et al.β-Conglycinins among sources of bioactives in hydrolysates of different soybean varieties that inhibit leukemia cellsinvitro[J]. Journal of Agricultural and Food Chemistry,2008,56(11):4012-4020.
[5]Natarajan S,Xu Chenping,Bae H,et al. Proteomic and genetic analysis of glycinin subunits of sixteen soybean genotypes[J]. Plant Physiology and Biochemistry,2007,45(6/7):436-444.
[6]Fehr W R,Hoeck J A,Johnson S L,et al.Genotype and environment influence on protein components of soybeans[J]. Crop Science,2003,43(2):511-514.
[7]李丹,刘春雷,江连洲. 纯品7S和11S蛋白结构与表面疏水性的相关性研究[J]. 食品研究与开发,2015,36(7):5-9,22.
[8]李丹,江连洲. 大豆7S和11S蛋白中氨基酸组成与表面疏水性的相关性研究[J]. 中国油脂,2015,40(3):25-29.
[9]刘春雷,孙立斌,李相昕,等. 大豆7S和11S蛋白二级结构与表面疏水性相关性的研究[J]. 食品科学,2015,36(17):28-32.
[10]许彩虹.大豆球蛋白糖基化接枝改性及其热聚集行为研究[D].广州:华南理工大学,2010.
[11]Samoto M,Maebuchi M,Miyazaki C,et al.Abundant proteins associated with lecithin in soy protein isolate[J].Food Chemistry,2007,102(1): 317-322.
[12]Bigelow C C.On the average hydrophobicity of proteins and the relation between it and protein structure[J].Journal of Theoretical Biology,1967,16(2):187-211.
[13]Badley R A,Atkinson D,Hauser H,et al.The structure,physical and chemical properties of the soy bean protein glycinin[J].Biochimica Et Biophysica Acta,1975,412(2):214-228.
[14]刘翀.大豆蛋白分级分离机理的研究[D].广州:华南理工大学,2009.
[15]Hou D J,Chang K C.Structural characteristics of glycinin purified from soybeans stored under various conditions[J].Journal of Agricultural and Food Chemistry,2004,52:3792-3800.
[16]张忠慧.尿素变性大豆蛋白的分子结构及胶粘机理研究[D].无锡:江南大学,2008.

