非典型脑膜瘤74例临床预后分析
陈福业 周汉 丰育功 张丽云 李环廷 栗世方 郭品 张洪亮
(1青岛大学, 2青岛大学附属医院神经外科,山东 青岛 266003)
脑膜瘤是成年人最常见的原发脑肿瘤之一,占所有脑肿瘤的33%左右,人群中的发病率约为6/100 000。约90%的脑膜瘤为良性,全切除预后良好。而非典型脑膜瘤约占脑膜瘤总数的5%~7%[1],尽管手术中肿瘤全切(SimpsonⅠ~Ⅱ级)或术后早期放疗,但仍有较高的复发率。术后早期放疗是非典型脑膜瘤重要的辅助治疗方法,一些研究表明患者能从术后放疗中获益。美国国立综合癌症网络(National Comprehensive Cancer Network, NCCN)指南2015版中对于全切除或部分切除的WHOⅡ级脑膜瘤推荐术后放疗。但到目前为止,临床上对于怎样的非典型脑膜瘤患者进行术后放疗仍未达成一致意见[2]。因此,本研究回顾性分析2008年至2016年青岛大学附属医院收治的74例非典型脑膜瘤患者的临床资料,以探讨该病的临床表现、影像学特点、治疗方法及预后相关影响因素。
对象与方法
一、一般资料
收集2008年至2016年青岛大学附属医院神经外科收治的74例非典型脑膜瘤患者的临床资料,其中症状为头疼者31例,视力下降者10例,轻度偏瘫者17例,癫痫发作者5例,其他表现者11例。其中原发肿瘤66例,继发8例。术前功能状态评分标准(Karnofsky performance status, KPS) 60~100分,中位得分90分。住院天数7~40 d,平均14.6 d。
二、影像学检查
患者术前均行颅脑MRI及CT检查。其中起源于大脑凸面者35例,镰旁窦旁者11例,鞍区者12例,其他部位者16例。肿瘤最大直径2~10 cm,平均6.1 cm。其中脑侵袭者26例,骨侵袭着18例。单发肿瘤67例,多发7例。非典型脑膜瘤患者术前影像检查见(图1)。
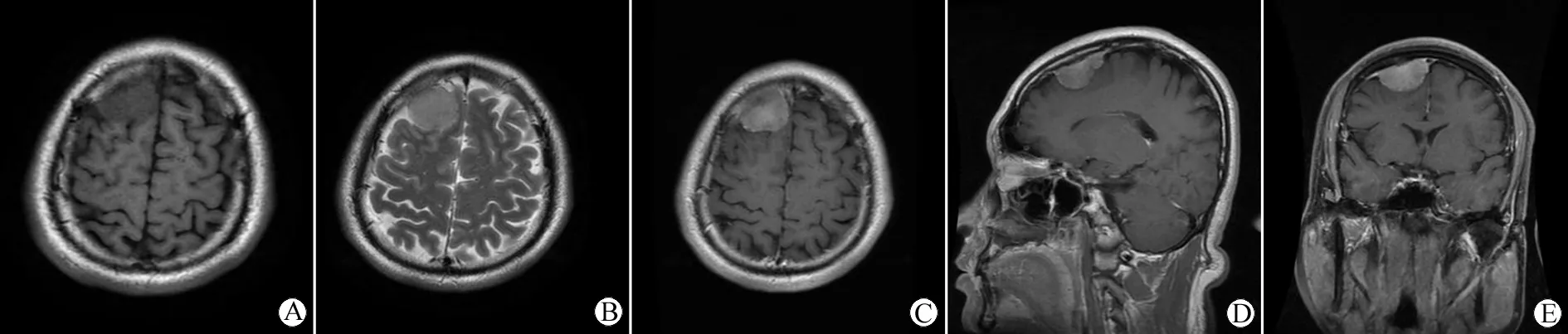
图1 非典型脑膜瘤术前颅脑MR
Fig 1 Pre-operative brain MRI of atypical meningioma
A: Axial T1WI MRI: the tumor was located in the right amount, irregular shape; B: Axial T2WI MRI: tumor was equal signal with peritumoral edema and irregular boundaries; C: Axial T1MRI enhanced scan: the tumor was low or equal signal, enhanced visible uneven enhancement; D: Coronal enhancement scan; E: Sagittal enhancement scan.

图2 非典型脑膜瘤患者术后病理检查(HE, ×400)
Fig 2 Pathological examination of atypical meningioma patients (HE, ×400) >The tumor cells were rich in flaky growth, nucleolus and mitotic figures were obvious and the nucleus had atypia visible focal necrosis with a higher nuclear ratio.
三、病理检查
患者术后病理结果可见增殖指数(proliferation index, Ki67)为:2%~30%,平均10.1%。以下为“非典型脑膜瘤”术后病理图片(图2、3)。
四、手术治疗
本组患者全部在全麻下行显微手术肿瘤切除术。术前根据其影像检查设计合理的手术入路,以完全显露肿瘤及受侵犯组织为目的。术中见肿瘤多数质地脆,色灰红,血供丰富,与周围组织分界尚清晰,可分块切除。对于受侵的硬脑膜及颅骨骨质切除范围应至少超出病变0.5 cm;如颅骨切除缺损者,应行颅骨缺损修补术;颅底骨质切除者应行颅底重建术。根据术中受累静脉窦的位置、有无闭塞以及与周围引流静脉的关系,侧支循环建立情况,对受累的静脉窦硬膜行电灼保留、切除、修复或重建等。本组均采用显微技术来锐性分离切除肿瘤及受累颅骨、脑组织。按照Simpson肿瘤切除程度分级,全切为SimpsonⅠ~Ⅱ级,部分切除为Simpson Ⅲ~Ⅳ级。本组患者中SimpsonⅠ~Ⅱ级切除者62例,占83.8%;SimpsonⅢ~Ⅳ切除者12例,占16.2%。所有患者术后每3个月、6个月,1年,2年进行MRI或CT复查。肿瘤进展的定义为肿瘤全切除后影像学检查肿瘤复发,肿瘤部分切除后体积较前增大。无进展生存期(progression-free-survival, PFS)的定义为:肿瘤切除后至影像学上肿瘤进展的时间。总存活期(overall survival, OS)定义:肿瘤切除后至患者死亡的时间。

图3 非典型脑膜瘤患者免疫组化染色示肿瘤细胞 (×200)
Fig 3 Immunohistochemistry of tumor cells in patients with atypical meningiomas (×200)
A: GFAP+; B: PR+; C: ki-67 about 7%; D: vimentin+; E: EMA+.
表1 本组患者OS的单变量COX生存分析
Tab 1 Univariate COX survival analysis of OS in this group

FactorHRP95%CILowerlimitUpperlimit Sex(malevsfemale)0.2710.5780.5061.463 Age(≥60vs<60)0.2920.2990.4171.308 Sicklesinusvsother0.3050.3550.4151.371 Hemiplegiavsother0.3700.3650.3461.478 KPS(≥80vs<80)0.4160.0030.1280.655 Simpson(Ⅰ~ⅡvsⅢ~Ⅳ)0.3980.5530.5802.765 Size(≥5vs<5cm)0.2740.2860.4371.277 Brainattack(yesvsno)0.3420.9710.5181.981 Boneinvasion(yesvsno)0.4010.0091.3006.268 Radiotherapy(yesvsno)0.3360.5520.4231.583 Primary(yesvsno)0.4620.3240.2571.567 Ki67(≥10%vs<10%)0.4450.0011.90710.912
结 果
一、随访结果
本组患者术后进行放疗共36例,术后放疗为普通外放射治疗,放疗剂量约为50~60 Gy。未放疗者38例。PFS为9~110个月,中位PFS为71.8个月;1年、2年、5年、8年的PFS率分别为89.1%,79.5%,70.5%,50.5%;OS为20~110个月,平均82.2个月;1年、2年、5年、8年的OS率分别为98.2%,94.5%,90.1%,87.5%。本研究采用SPSS 17.0统计软件。计算PFS和OS曲线用Kaplan-Meier统计方法。单因素分析采用Log-rank法,多因素COX分析用forwardlog-rank法。P<0.05为差异有统计学意义。
表2 本组患者PFS的单变量COX生存分析
Tab 2 Single-variable COX survival analysis of PFS in this group

FactorHRP95%CILowerlimitUpperlimit Sex(malevsfemale)0.2760.6900.6501.918 Age(≥60vs<60)0.2970.3410.7412.376 Sicklesinusvsother0.3100.9620.5531.863 Hemiplegiavsother0.3910.5210.3611.675 KPS(≥80vs<80)0.4200.080.1450.753 Simpson(Ⅰ~ⅡvsⅢ~Ⅳ)0.4580.7810.4632.790 Size(≥5vs<5cm)0.2920.5380.4711.482 Brainattack(yesvsno)0.3430.4710.6532.510 Boneinvasion(yesvsno)0.4800.011.91812.576 Radiotherapy(yesvsno)0.3610.1950.7863.242 Primary(yesvsno)0.4940.9640.3892.691 Ki67(≥10%vs<10%)0.4850.0031.60610.757
二、预后影响因素的单因素分析
首发症状为骨侵袭者有更高的复发风险(风险比hazard ratio, HR=0.480;P=0.01);KPS≥80分者较<80分者的OS更长(HR=0.416;P=0.03)。Ki67≥10%者复发率较高(HR=0.494;P=0.02),而且较Ki67<10%者的OS短(HR=0.445;P=0.01)。全切除组较部分切除组的OS更长(HR=6.04;P=0.026),但全切除组的PFS与部分切除组比较,差异无统计学意义(HR=2.03;P=0.141)。其他临床和治疗因素如:性别、年龄、肿瘤位置、大小,有无偏瘫、是否脑侵袭、是否原发、多发占位、术后放疗对于PFS及OS的影响无统计学意义(P>0.05,见表1、2)。
三、预后影响因素的多因素分析
对于非典型脑膜瘤,以骨侵袭为首发症状患者的PFS明显短于其他首发症状表现者[HR:0.389,95%置信区间(confidence interval, CI):2.613~12.009,P=0.031];Ki67≥10%的复发风险高(HR:0.382,95% CI:2.616~11.692,P=0.024);影响OS的唯一因素为术前KPS得分,术前KPS得分≥80分的患者死亡风险率更低(HR:0.320,95% CI:0.254~0.890,P=0.040),见表3、4。
表3 本组患者PFS的COX多因素生存分析
Tab 3 COX multivariate survival analysis of PFS in the group

FactorHRP95%CILowerlimitUpperlimit KPS(≥80vs<80)0.3280.0740.2180.788 Boneinvasion(yesvsno)0.3890.0312.61312.009 Ki67(≥10%vs<10%)0.3820.0242.61611.692
表4 本组患者OS的COX多因素生存分析
Tab 4 COX multivariate survival analysis of OS in the group

FactorHRP95%CILowerlimitUpperlimit KPS(≥80vs<80)0.3200.0400.2540.888 Boneinvasion(yesvsno)0.3440.1621.2824.929 Ki67(≥10%vs<10%)0.3740.0832.0158.731
讨 论
按照2007年世界卫生组织(WHO)脑膜瘤分级标准,将脑膜瘤分为三组:I级(良性肿瘤)II级(非典型脑膜瘤)和III级(恶性脑膜瘤)。WHO II级非典型脑膜瘤不常见,占所有脑膜瘤的4.7%~20.0%[3]。非典型脑膜瘤MRI表现:①信号不均匀,可见囊性和坏死;②肿瘤边界不规则,可呈分叶状;③肿瘤水肿常见;④肿瘤周围可见骨性破坏,显示肿瘤的侵袭性;⑤可能存在肿瘤包裹颅内动脉征象[4]。非典型性脑膜瘤的好发部位是大脑镰、矢状窦、大脑凸面等,应该与胶质瘤相鉴别;侧脑室非典型脑膜瘤形状不规则,呈分叶状,可见囊变、坏死,可以和脉络丛乳头状瘤,淋巴瘤鉴别;鞍区脑膜瘤应与海绵状血管瘤、颅咽管瘤相鉴别。术前影像分析对手术有指导意义,可以确定手术切除的范围和程度,制定合理的手术策略。2016年欧洲神经肿瘤协会(EANO)对脑膜瘤诊断和治疗的指南中关于WHO Ⅱ级非典型脑膜瘤包括①每高倍视野下(HPF)细胞有丝分裂率为4~19个,②存在脑侵袭,③有以下三种特异性组织学表现之一:细胞呈片状生长,自发性坏死的细胞增多,核仁大、核质比增大[5]。其中将脑侵袭作为诊断非典型脑膜瘤的独立因素,在评价脑实质侵犯时要强调肿瘤组织和脑组织之间无软脑膜,而不能把肿瘤与软脑膜有粘连而未进入脑组织内当成所谓“脑实质侵犯”。
非典型脑膜瘤是一种生物学行为介于良性和恶性之间的肿瘤,并且其预后较差。与良性脑膜瘤相比较,非典型脑膜瘤患者大约有8倍的复发率,其预后不良的组织学特点大多表现为细胞活性的增加,有丝分裂计数增高,细胞分化差和存在脑骨侵袭等。研究表明脑侵袭的非典型脑膜瘤显示了较高的复发率,骨侵袭是提示患者预后不良的危险因素[6,7]。本研究发现存在脑及骨侵袭患者提示预后不良,差异有统计学意义。因此对于存在脑骨侵袭患者推荐术后辅助放疗。在本组患者中,以骨侵袭为首发症状的患者较其他首发症状患者的PFS短(P=0.01),术前KPS≥80分的患者较KPS<80分患者的OS更长(P=0.031)。关于用细胞增殖指数Ki67来区分脑膜瘤良恶性,文献报道的Ki-67指数范围:良性脑膜瘤为0.7%~2.2%,非典型脑膜瘤为2.1%~9.3%,恶性脑膜瘤为11%~16.3%;区分良性和非典型脑膜瘤的临界值范围为3.0%~4.2%[8]。Ki67指数升高的水平与非典型脑膜瘤复发和较低的总生存时间(OS)有相关性,当Ki67≥10%肿瘤表现为较高的侵袭性和复发率。本研究显示Ki-67指数范围2%~30%,平均10.1%,其中以10%为界来预判肿瘤的复发风险,其差异有统计学意义。
无论何种类型的脑膜瘤,手术全切除者较部分切除者有更高的肿瘤控制率[9],在本组研究中虽然全切除组的PFS与部分切除组比较,差异无统计学意义(HR=2.03;P=0.041),但全切除组较部分切除组的OS更长(P=0.026)。因此对非典型脑膜瘤尽可能行SimpsonⅠ级手术切除。对于全切的患者术后是否放疗并无统一的意见[10]。本组患者资料统计分析发现,首发症状为偏瘫、继发肿瘤、脑骨侵袭、Ki67≥10%为非典型脑膜瘤复发的高危因素,对于这种非典型脑膜瘤的治疗应该在尽可能手术全切除的基础上再进行辅助放射治疗。对于手术中部分切除的脑膜瘤患者,术后早期更应该积极的采取普通放射治疗,因为放疗可以增加非典型脑膜瘤患者的OS和PFS[11]。在本组研究中,术后放疗的患者与未放疗患者的PFS和OS的差异无统计学意义(P>0.05),表明放疗并未能使全部非典型脑膜瘤患者受益。目前非典型脑膜瘤治疗的基本原则为,术中部分切除者术后推荐放疗,对于完全切除者首发症状为偏瘫、继发肿瘤、脑骨侵袭、Ki67≥10%之一者推荐放疗,但仍需要大样本的研究来证实。
参考文献
1WIEMELS J, WRENSCH M, CLAUS E B. Epidemiology and etiology of meningioma [J]. J Neurooncol, 2010, 99(3): 307-314.
2HARDESTY D A, WOLF A B, BRACHMAN D G, et al. The impact of adjuvant stereotactic radiosurgery on atypical meningioma recurrence following aggressive microsurgical resection [J]. J Neurosurg, 2013, 119(2): 475-481.
3YANG S Y, PARK C K, PARK S H, et al. Atypical and anaplastic meningiomas: prognostic implications of clinicopathological features [J]. J Neurol Neurosurg Psychiatry, 2008, 79(5): 574-580.
4WU Q W, YAN R F, LI Q, et al. Magnetic resonance image manifestations of the atypical meningioma [J]. Asian Pac J Cancer Prev, 2013, 14(11): 6337-6340.
5HO D M, HSU C Y, TING L T, et al. Histopathology and MIB-1 labeling index predicted recurrence of meningiomas: a proposal of diagnostic criteria for patients with atypical meningioma [J]. Cancer, 2002, 94(5): 1538-1547.
6YU S Q, WANG J S, JI N, et al. Clinical characteristics and therapeutic strategies of atypical meningioma [J]. Chin Med J (Engl), 2011, 124(7): 1094-1096.
7殷尚炯, 曹藏柱, 程月飞, 等. 非典型脑膜瘤的生存分析 [J]. 中华神经外科疾病研究杂志, 2017, 16(4): 329-333.
8NAKASU S, LI D H, OKABE H, et al. Significance of MIB-1 staining indices in meningiomas: comparison of two counting methods [J]. Am J Surg Pathol, 2001, 25(4): 472-478.
9PASQUIER D, BIJMOLT S, VENINGA T, et al. Atypical and malignant meningioma: outcome and prognostic factors in 119 irradiated patients. A multicenter, retrospective study of the Rare Cancer Network [J]. Int J Radiat Oncol Biol Phys, 2008, 71(5): 1388-1393.
10KLINGER D R, FLORES B C, LEWIS J J, et al. Atypical meningiomas: recurrence, reoperation, and radiotherapy [J]. World Neurosurg, 2015, 84(3): 839-845.
11HUG E B, DEVRIES A, THORNTON A F, et al. Management of atypical and malignant meningiomas: role of high-dose, 3D-conformal radiation therapy [J]. J Neurooncol, 2000, 48(2): 151-160.

