辣椒疫霉效应分子RxLR22034的表达纯化及晶体生长
李秀奇冯锐黄振岭杨灿灿张修国朱春原
辣椒疫霉效应分子RxLR22034的表达纯化及晶体生长
李秀奇1,冯锐1,黄振岭1,杨灿灿1,张修国1,朱春原2*
1. 山东农业大学植物保护学院, 山东 泰安 271018 2. 山东农业大学生命科学学院, 山东 泰安 271018
辣椒疫霉()作为一种重要的植物病原卵菌,侵染寄主植物时能够分泌RxLR效应分子,从而激活或抑制植物的防卫反应,引起植物病害的产生。为了深入研究辣椒疫霉效应分子与植物互作的机制及致病机理,本文从辣椒疫霉菌株SD33中克隆得到了RxLR22034效应分子,以大肠杆菌(DE3)为宿主,进行了原核表达与纯化,确定了该基因高效表达条件。通过亲和层析及分子筛层析纯化获得高纯度蛋白,借助坐滴法培养优化获得RxLR22034蛋白晶体,X射线衍射获得2.7Å的蛋白晶体数据,为后续解析RxLR效应分子蛋白三维结构,从结构生物学角度探知辣椒疫霉RxLR效应分子生理生化功能奠定了基础。
辣椒疫霉菌; RxLR效应分子; 原核表达; 晶体生长
疫霉菌是农业生产的重要威胁,目前已经发现疫霉菌有160多种,可侵染数千种植物,每年导致的作物产量损失超过几百亿美元[1]。辣椒疫霉()辣椒疫霉侵染导致,是一种重要的土传病害,其寄主范围较广,可引致辣椒、番茄、茄子、黄瓜、南瓜等多种重要蔬菜作物的疫病[2,3]。据统计,每年由辣椒疫霉造成的经济损失达数十亿美元。
因辣椒疫霉寄主范围广泛、可侵染模式植物拟南芥和本氏烟、便于操作等,已经成为卵菌研究的重要模式种[4]。RxLR效应子是近年被广泛研究的一类的胞内效应子[5]。卵菌几乎所有病原菌在与寄主互作过程中,都向寄主细胞分泌大量RxLR效应子干扰寄主植物细胞的正常生理代谢和功能,据统计辣椒疫霉向寄主分泌的RxLR效应子已鉴定到200多个。对这些效应子的功能和毒性机制的研究对防治辣椒疫霉病害意义重大[6]。
RxLR效应因子N-端多为保守的RxLR基序,该基序负责将效应蛋白转运于宿主细胞[7,8],RxLR基序两侧的30~60个氨基酸具明显的保守性,而C-端区域氨基酸变异性较大,后来的研究发现该区域具一定的W、Y、L保守域[9]。近来,除开展有关植物病原菌效应蛋白结构解析其调控寄主细胞生理变化及其致病分子机制的信息积累外,还解析了7个卵菌RxLR效应分子结构,分别是4、2、11、54、1、13和5[10-15],有关植物病原卵菌效应蛋白分子结构生物学研究信息积累较少。本研究从辣椒疫霉SD33菌株中克隆鉴定了1个辣椒疫霉效应分子RxLR22034,通过生物信息学比对分析,正确预测了RxLR22034结构特征,然后立足蛋白原核表达纯化技术,获得了高纯度蛋白,借助坐滴法优化培养获得RxLR22034蛋白晶体,经X-ray衍射收集了一套2.4Å的数据,为后续解析该效应分子三维结构及其揭示其致病分子机理奠定了基础。
1 材料与方法
1.1 供试菌株和载体
供试辣椒疫霉()SD33菌株由山东省蔬菜病虫生物学重点实验室分离鉴定。大肠杆菌菌株()Rosetta(DE3)购买自北京全式金生物技术有限公司;表达载体pET-28a(+)购买自Novagen公司产品。
1.2 RxLR98344效应分子基因克隆
1.2.1 引物设计基于生物信息学软件比对分析,根据RxLR22034基因和pET-28a特点,采用NOTI和NDEI酶切位点,设计一对特异性引物RxLR22034-F:5’-ATAAGAATGCGGCCGCATGCGTCTAAGTGTGATCCT-3’;RxLR22034-R:5’-GGAATTCCATATGTTATGGTCGATGCTTTCCG-3’,另在下游引物酶切位点后面去掉目的基因终止密码子以产生融合his标签融合蛋白,引物由上海铂尚生物有限公司合成。利用Signal P 4.1 Server(http://www.cbs.dtu.dk/services/Signal P/)数据库预测基因信号肽及其结构特征。
1.2.2 RxLR22034基因克隆利用CTAB法提取辣椒疫霉SD33菌株总DNA,以SD33菌株总DNA为模板,以RxLR22034-F和RxLR22034-R为引物扩增RxLR22034基因开放读码框。PCR反应体系:50 L,含10x EasyTaq Buffer 5 L,dNTP 4 L,引物(10 mol/L)各1 L,模板DNA 2 L,EasyTaq酶0.5 L,无菌水36.5 L。PCR反应条件:94 ℃预变性4 min,变性94 ℃ 30 s,退火58 ℃ 50 s,延伸72 ℃ 30 s,共32个循环,72 ℃总延伸10 min。
1.3 表达载体构建
将PCR扩增产物进行琼脂糖凝胶电泳检测,并利用DNA凝胶回收试剂盒对目的条带进行回收纯化,根据目的基因引物和克隆载体上选择使用的限制性内切酶位点,分别为Not1、Nde1,对目的片段和载体进行双酶切。利用DNA凝胶回收试剂盒对酶切产物进行回收纯化,纯化之后用Solution I连接酶进行目的片段和载体的连接。将连接产物转入带有Kana抗性的菌株(DH5α),经菌液PCR筛选和测序验证正确后,提取重组质粒备用。
1.4 RxLR22034重组蛋白的表达纯化
1.4.1 重组蛋白的试表达将测序正确的pET28a-RxLR22034重组质粒用转入(DE3)菌株中,涂布于具有Kana抗性的LB固体培养基上,37 ℃培养12 h。挑取生长良好的单克隆至1 mL含有0.1 μg/mL卡那霉素的LB培养液中,37 ℃,振荡培养4 h,取800 μL菌液加入终浓度为1 mmol/L的IPTG诱导表达,振荡培养3 h。诱导结束后各取80 µL菌液,与诱导前的对照菌液共离心,12000 rpm,2 min;弃上清,各加入40 μL的2×Binding Buffer和40 μL的2×Loading Buffer混匀;煮沸15 min,离心12000 rpm,1 min;15% SDS-PAGE凝胶电泳分析。根据电泳结果,将有条带的剩余菌液200 μL接种于5 mL带有Kana抗性的新鲜LB培养基中,37 ℃,振荡培养12 h,取840 μL菌液加入160 μL50%灭菌甘油,于-20 ℃冰箱保存。对已保存的表达较好的菌株进行活化后,按1:100比例接种到含有50 mg/L Kan的1 L LB培养基中,37 ℃180 rpm震荡培养至OD600为0.6~0.8。待培养基的温度降至16 ℃,加入1 mL 1 M的IPTG,16 ℃ 120 rpm过夜培养,离心收集菌体于-20 ℃保存待用。
1.4.2 重组蛋白的纯化将菌体重悬于50 mL缓冲液(20 mmol/L Tris-HCl pH8.5,300 mmol/LNaCl)中,加入10%甘油和0.5%吐温-20,超声破碎,4 ℃14000 r/min离心30 min后,去沉淀。将上清液挂镍柱。镍柱预先用buffer A(20 mmol/L Tris-HCl pH8.5,300 mmol/LNaCl,30 mmol/L咪唑)平衡,挂3~4遍,用500 mL buffer A洗杂蛋白,再用buffer B (20 mmol/L Tris-HCl pH8.5,300 mmol/L NaCl,300 mmol/L咪唑)洗脱目的蛋白,将洗脱的目的蛋白用浓缩管浓缩至1 mL。分子筛预先用buffer c(20 mmol/L Tris-HCl pH8.5,300 mmol/L NaCl)平衡,将浓缩的蛋白上样,收集主要目标峰蛋白,SDS-PAGE检测纯度,并将蛋白用液氮保存于-80 ℃下保存,以备培养晶体使用。
1.5 重组蛋白晶体培养及优化
本实验蛋白晶体的培养,采用坐滴气象扩散法,初次筛选采用Hampton Research Crystal ScreenⅠ、Crystal Screen Ⅱ、Salt RxTM1、PEG/lon Screen TM、PEG/lon 2 Screen TM、Index TM和Natrix TM蛋白晶体生长试剂盒进行蛋白晶体筛选。采用进口48孔晶体培养板,池液150 L,蛋白液和池液以1:1比例混合,置于10 ℃恒温晶体培养箱,2周后于显微镜下观察晶体生长情况,后根据粗筛条件进行晶体优化,挑取生长质量较好的蛋白晶体,用液氮冻存,进行X射线衍射分析并收集数据。
2 结果与分析
2.1 辣椒疫霉RxLR22034基因克隆及基因序列结构分析
辣椒疫霉RxLR22034基因序列分析,该基因全长558 bp,编码185个氨基酸,预测分子量为21.04 KD。利用SignalP4.1 Server预测RxLR22034基因无信号肽和跨膜区(见图1)。以基因组DNA为模板,用引物RxLR22034-F和RxLR22034-R扩增该基因编码区序列,电泳检测结果(图2),表明扩增产物为558 bp,与基因组中RxLR22034基因大小一致。
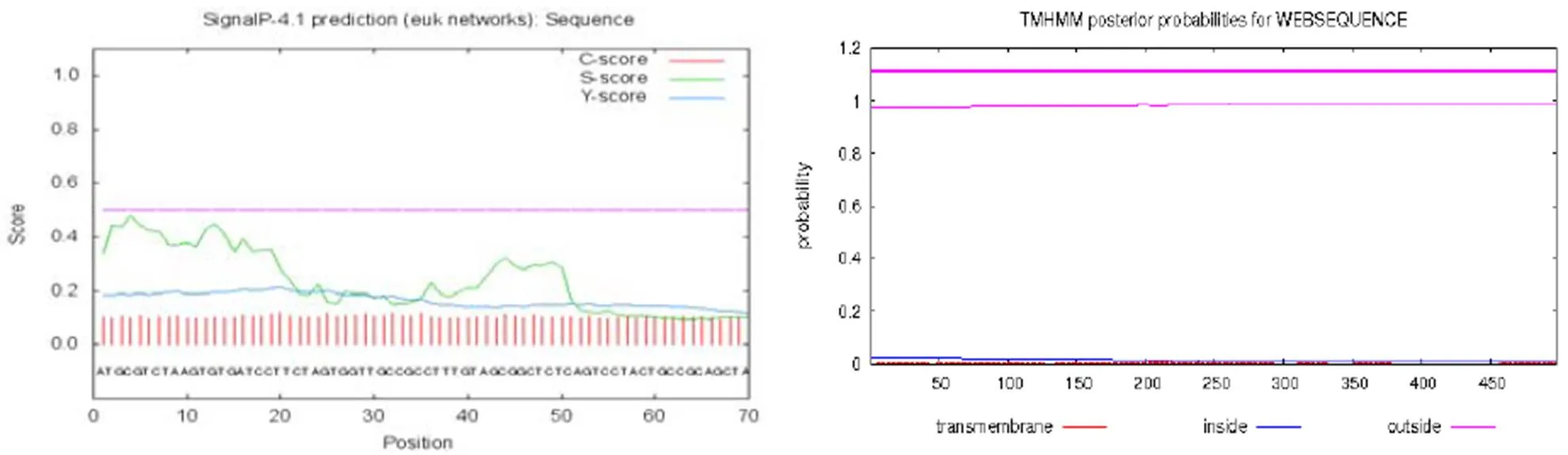
图1 效应分子RxLR22034信号肽预测与跨膜区预测
2.2 RxLR22034蛋白表达
回收PCR产物,用Not I和Xho I双酶切回收产物和表达载体pET-28a。以22034-F和RxLR22034-R为引物,PCR扩增22034-pET28a重组质粒菌落跑胶获得约558 bp的特异性条带(图3),送样测序。利用DNAman软件进行序列比对分析,测序结果正确,原核表达载体构建成功。重组质粒22034-pET28a转入大肠杆菌(DE3)表达菌株,诱导后,结果显示在37 ℃条件下,经0.5 mmol/L的IPTG诱导宿主菌于21KD处有大量蛋白表达(图3)。
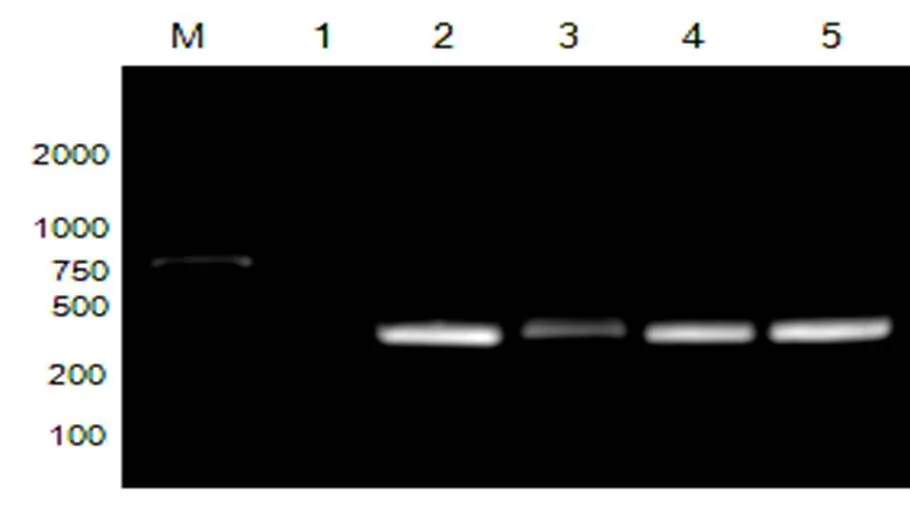
图2 RxLR22034基因PCR扩增结果
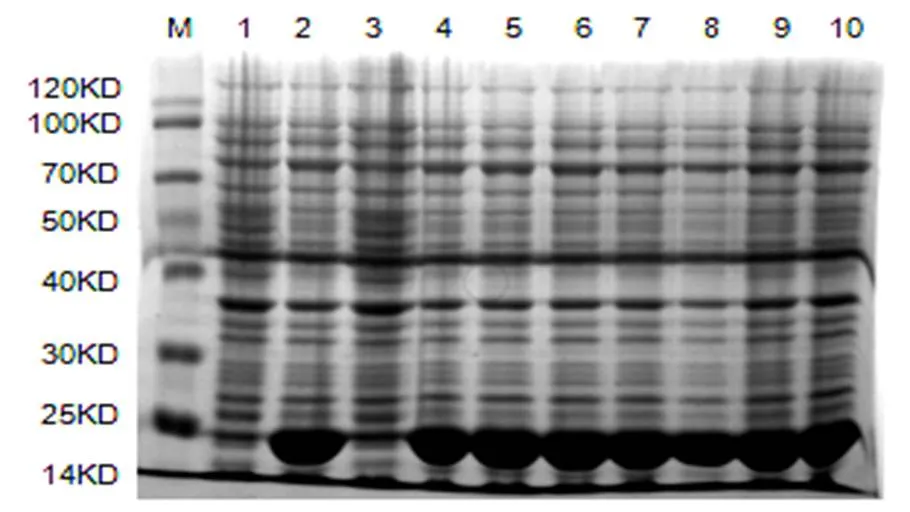
图3 RxLR22034诱导表达结果
M: Marker, 1~7:基因RxLR22034 M: Marker,1:CK,2~10:加入IPTG后的诱导结果
M:Marker, 1~7: The gene ofxLR22034 M:marker,1:CK,2~10 with IPTG induced expression.
2.3 RxLR22034蛋白纯化
收集RxLR22034融合蛋白菌体,经细胞破碎,进行镍柱亲和层析,取样进行SDS-PAGE电泳检测(图4)。将融合蛋白浓缩至1 mL,过分子筛层析,分部收集的蛋白进行SDS-PAGE检测,结果显示在21 KD处有蛋白(图5)。
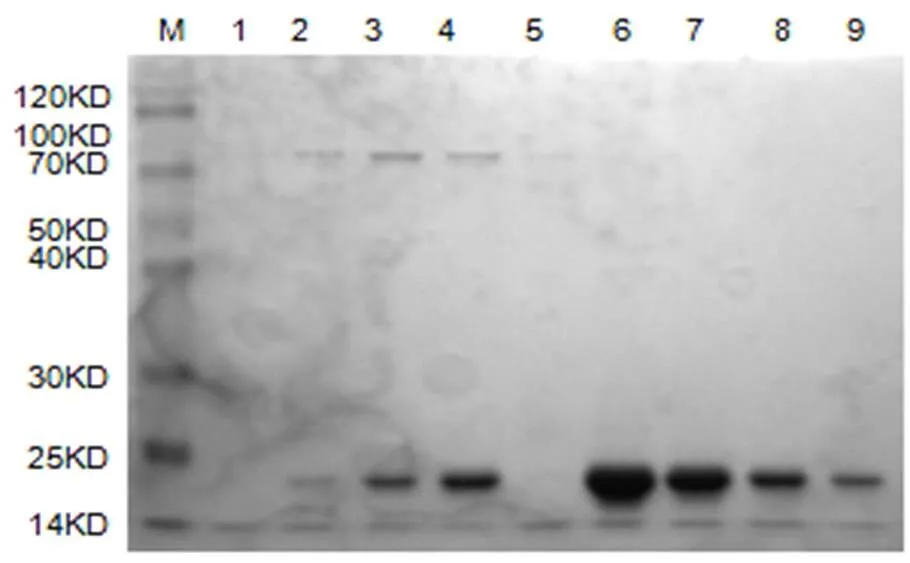
图4 RxLR22034蛋白分子筛纯化后的SDS-PAGE电泳

图5 RxLR22034蛋白分子筛层析纯化
Fig.5 Purification of RxLR22034 by size exclusion chromatography
2.3 RxLR22034蛋白晶体筛选及衍射数据收集
收集分子筛层析洗脱获得的目的蛋白,浓缩并进行晶体初筛,采用坐滴法16 ℃生长1周后,可观察到晶体生长(图6),晶体生长条件:0.03 M Citric acid,0.07 M BIS-TRIS propane/pH 7.6,20%PEG3350。然后将晶体送上海同步辐射光源进行了X衍射及数据收集和初步处理(图7)。目前由于还缺乏该蛋白晶体的相位信息,后续正在试图进行该蛋白的硒代衍生物制备,以期获得衍射效果好的硒代蛋白晶体,并有望最终解析其三维结构。
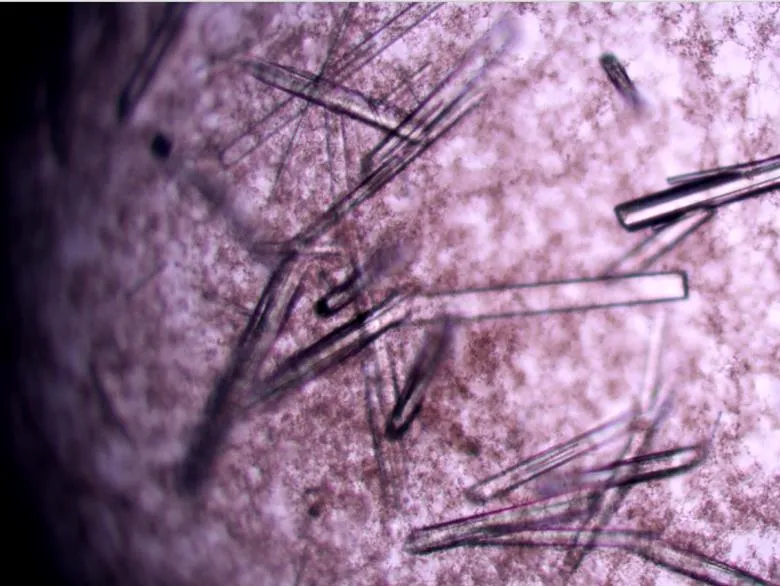
图6 RxLR22034蛋白晶体

图7 RxLR22034晶体X射线衍射图
3 讨论
对于众多用生物化学和生物物理学进行的实验研究来讲,成功获得高纯度高浓度可溶性蛋白溶液是至关重要的一步。本研究选取了辣椒疫霉全基因组中一个RxLR效应蛋白,该基因在辣椒疫霉全基因组中序列号为22034,由此将其命名为RxLR22034。本研究从参试辣椒疫霉菌SD33克隆鉴定了RxLR22034基因,然后进行蛋白表达纯化,获得高纯度蛋白,后续进行晶体优化培养,获得高质量的晶体,综合分析本研究实验技术发现,目的蛋白纯度大于90%以上,适宜进行晶体筛选,并利于成功获得蛋白晶体。
在蛋白纯化和晶体筛选过程中,我们发现当蛋白纯度达到90%以上,浓度达到10 mg/mL,适合进行蛋白晶体筛选,并利于获得蛋白晶体。晶体生长的临界条件是溶液达到一个适宜的过饱和度,才会生成少数的晶核,随着溶液过饱和度逐渐降低,最后溶液和晶体处于平衡状态,晶体就停止生长。本研究结果对后续开展硒代蛋白晶体培养,以及X射线衍射分析提供了可靠的实验技术准备。在此基础上,进一步的晶体优化和硒代培养,有望解析其全长三维结构,预期利于立足RxLR22034蛋白三维结构,深入探讨辣椒疫霉效应分子蛋白与辣椒寄主互作的分子机制,从而为设计植物抗疫病策略奠定理论基础。
近年来卵菌RxLR效应蛋白与植物互作机理研究,已逐渐成为分子植物病理学研究热点科学问题,通过解析RxLR蛋白三维结构,立足蛋白三维结构特性,深入开展其功能机制研究,预期有望探明辣椒疫霉与植物互作的分子机制。因此,针对性的开展卵菌效应蛋白表达、纯化,获得高纯度蛋白及其晶体培养,获得高较高质量的晶体,为真正意义上解析其三级结构提供重要的技术准备,对于深入开展效应蛋白结构生物学具有重要的意义。
4 结论
本研究从JGI公布的辣椒疫霉基因组中成功克隆得到效应分子RxLR22034基因,随后对该基因进行了蛋白的原核表达、纯化,得到较高纯度的RxLR22034母体和硒代蛋白,并对其进行了晶体培养,将RxLR22034蛋白晶体在上海光源中心进行X-ray衍射收集数据,并收集到了一套高质量的RxLR22034母体蛋白衍射数据。为下一步解析RxLR22034三维结构打下基础,为将来阐明RxLR效应因子的致病机理、多寄主侵染机理以及与寄主共进化特点等提供了理论依据。
[1] 郑小波.疫霉菌及其研究技术[M].北京:中国农业出版社,1997
[2] 张海英,刘永刚,吕和平,等.河西地区辣椒疫病菌的形态特征及其致病力的初步研究[J].西北农业学报,2008,17(1):74-76
[3] 王晓敏,巩振辉,逯红栋,等.辣椒疫霉菌孢子诱导技术研究[J].西北农业学报,2006,15(2):59-62
[4] Kamoun SA. Catalogue of the effector secretome of plant pathogenic Oomycetes[J]. Annu Rev Phytopathol, 2006,44:41-60
[5] Lamour KH, Stam R, Jupe J,. The Oomycete broad-host-range pathogen[J]. Molecular plant Pathology, 2012,13(4):329-337
[6] Du Y, Mpina MH, Birch PR,RxLR effector AVR1 interacts with exocyst component Sec5 to manipulate plant immunity[J]. Plant Physiology, 2015,169(3):1975-1990
[7] Dou DL, Kale SD, Wang X,. RxLR mediated entry ofeffector Avr1b into soybean cells does not require pathogen-encoded machinery[J]. Plant Cell, 2008,20(7):1930-1947
[8] Whisson SC, Boevink PC, Moleleki L,A translocation signal for delivery of Oomycete effector proteins into host plant cells[J]. Nature, 2007,450(7166):115-118
[9] Win J, Komoun S.Adaptive evolution has targeted the C-terminal domain of the RxLR effectors of plant pathogenic Oomycetes[J]. Plant Signaling & Behavior, 2008,3(4):251-253
[10] Boutemy LS, King SR, Win J,. Structures ofRxLR Effector Proteins: a conserved but adaptable fold underpins functional diversity[J]. J Biol Chem, 2011,286(41):35834-35842
[11] Yaeno T, Li H, Chaparro-Garcia A,. Phosphatidy linositol monophosphate-binding interface in the Oomycete RxLR effector AVR3a is required for its stability in host cells to modulate plant immunity[J]. Proc Natl Acad Sci USA, 2011,108(35):14682-14687
[12] Maqbool A, Hughes RK, Dagdas YF,. Abbas Maqbool Structural Basis of Host Autophagy-related Protein 8 (ATG8) Binding by the Irish Potato Famine Pathogen Effector Protein PexRD54[J]. J Biol Chem, 2016,291(38):20270-20282
[13] Chou S, Krasileva KV, Holton JM,. Hyaloperonospora arabidopsidis ATR1 effector is a repeat protein with distributed recognition surfaces[J]. Proc Natl Acad Sci USA, 2011,108(32):13323-13328
[14] Leonelli L, Pelton J, Schoeffler A,. Structural elucidation and functional characterization of the Hyaloperonospora arabidopsidis effector protein ATR13[J]. PLoS Pathog, 2011,7:e1002428
[15] Sun FR, Kale SD, Azurmendi HF,. Structural basis for interactions of theRxLR effector Avh5 with phosphatidylinositol 3-phosphate and for host cell entry[J]. Mol. Plant-Microbe Interact, 2013,26(3):330-344
The Expression, Purification and Crystal Growth of RxLR86034 from
LI Xiu-qi1, FENG Rui1, HUANG Zhen-Ling1, YANG Can-can1, ZHANG Xiu-guo1, ZHU Chun-yuan2*
1.271018,2.271018,
, an important phytopathogenic Oomycete, can infect host plants to secrete RxLR effector molecules, thus activating or inhibiting plant defense responses and causing plant diseases. In order to further study the mechanism and pathogenic mechanism of interaction betweeneffector and plant, In this paper, RxLR22034 effector molecule was cloned fromstrain SD33 and expressed in Escherichia coli(DE3). The expression of this gene was confirmed. The target protein was purified through using a two-steps purification strategy including nicked affinity and size exclusion chromatography (SEC). The high purify protein and well-diffracted crystals were obtained, which laid a foundation for the analysis of the structure. The crystals were obtained by sitting drop method and we obtained 2.4Å diffraction data using X-ray. Finally, we prepared the high quality protein of RxLR22034 gene which would be beneficial to further study on crystal structure of it.
; RxLR effector; prokaryotic expression; crystal growth
S436.418.1+2
A
1000-2324(2018)03-0383-05
2017-12-01
2018-02-12
国家自然科学基金青年基金(31500121);山东省优秀中青年科学家科研奖励基金(BS2015SW009)
李秀奇(1992-),女,在读硕士研究生,研究方向:植物病原卵菌蛋白结构生物学. E-mail:2292196007@qq.com
Author for correspondence. E-mail:zhuchunyuan@sdau.edu.cn

