基于乳腺钼靶侧斜位图像的近期乳腺癌风险预测研究
李颜娥 张 朋 范 明 Zheng Bin,2 厉力华*
1(杭州电子科技大学生命信息与仪器工程学院,杭州 310018)2(School of Electrical and Computer Engineering, University of Oklahoma, Tulsa, OK 74135, USA)
引言
乳腺癌是严重危害女性身心健康的恶性肿瘤,近年来妇女的乳腺癌发病率呈逐年上升趋势,已成为城市女性的头号杀手[1]。大量研究结果表明,通过早期诊断和治疗,可以很大程度上降低乳腺癌患者的死亡率,并能提高癌症治疗后的生活质量[2]。为了提高检测和有效治疗乳腺癌,中国正在积极推进乳腺普查工作,在各种乳腺癌普查和早期检测技术中,X光钼靶成像技术是目前公认的相对可靠有效可以普遍推广的普查方法[3]。但是,乳腺钼靶图像是一种将三维乳腺组织结构投影到二维空间的图像,极大地增加了医生正确诊断乳腺癌的难度[4]。同时,在普查的环境中往往会产生较高假阳性率,造成过诊断问题[5]。所以,对于全民统一的乳腺癌普查是一项高成本低产出的工作,需要耗费大量宝贵的医疗资源[6]。为改善乳腺癌普查成效,逐步废除全民统一的普查模式,建立个体化的乳腺癌普查模式已在癌症普查和流行病学研究领域逐步取得共识[7]。通过近期乳腺癌风险预测分析,高风险妇女需较频繁地普查,而大多数低风险妇女可降低检查频率,从而把有限医疗资源集中于近期高风险人群中,同时避免现行普查对低风险妇女带来的可能伤害。为实现个体化乳腺癌普查模式,建立以乳腺钼靶图像为基础的近期乳腺癌风险评估模型是有重大意义的。
传统的乳腺癌风险预测方法主要依赖乳腺癌风险因子,包括基因信息、家族史、年龄及乳腺密度等进行长期的乳腺癌风险预测[8],而乳腺癌是一个逐步发展的过程,传统乳腺癌风险预测模型不能提供近期乳腺癌风险概率[9]。近年来有学者开始对个体化乳腺癌风险预测进行研究,主要采用单侧乳腺钼靶图像特征进行分析[8, 10-14]。一些新的研究表明,在近期乳腺癌风险预测方面乳腺钼靶图像双侧不对称性特征表现显著高于单侧特征[15-19]。但目前只进行了全局区域双侧不对称性特征的研究,而双侧局部不对称性在临床乳腺癌诊断中起到重要作用。为此,前期研究了乳腺钼靶图像局部不对称性与乳腺癌近期风险的关联关系[20],以及乳腺钼靶图像局部区域结合全局区域的双侧不对称性特征与近期乳腺癌风险预测研究的关联性,并在头尾位图像中进行了研究。本课题则对乳腺钼靶图像侧斜位(mediolateral oblique, MLO)的局部结合全局双侧不对称性特征与近期乳腺癌风险预测的关联性进行了探讨研究。与其他采用双侧钼靶图像不对称性进行近期乳腺癌风险预测方法相比,本研究的主要改进和新意体现在:第一,在策略上,采用局部区域不对称性与全局区域不对称性相结合的方法,进行近期乳腺癌风险预测;第二,在特征选择上,提取了灰度图像、多方向Gabor滤波尺度响应,相位响应的目标区域空间差异性和结构相似性特征,以及可疑钙化点区域位置信息特征;第三,在数据上,采取高风险组样本的年龄与低风险组样本的年龄互相匹配,既减少了年龄这一重要风险因子带来的预测偏差,也能够进行不同年龄段的风险预测研究。该研究方法首先对双侧MLO位图像经过去皮肤、胸肌分割、乳头检测等预处理,分割出双侧局部对应区域及全局区域作为目标区域,然后提取灰度图像、多方向Gabor滤波尺度响应及相位响应的空间差异性、结构相似性,以及位置信息等85维影像特征。经去相关处理后,采用留一法及逐步回归进行特征选择,并建立基于广义线性模型(generalized linear model, GLM)的近期乳腺癌风险预测模型。本研究主要采用ROC曲线、优势比(adjusted odds ratio, OR)以及混淆矩阵分析灵敏度及特异性等对模型进行评价。研究结果表明,从乳腺钼靶侧斜位图像提取的局部及全局不对称性特征对近期乳腺癌风险预测,可提供潜在有效价值。
1 材料和方法
1.1 研究对象
本次研究所用数据皆来自俄克拉荷马大学,包括2006—2015年的556例样本。这些样本均有连续两年进行乳腺普查,前一年普查均为阴性,当前年患癌(高风险组)及阴性样本(低风险组)各278例,且两组样本的年龄逐一匹配。所有病例均为女性,年龄范围在37~87岁。本研究采用前一年数据作为研究对象,样本信息如表1所示。

表1 高风险组与低风险组样本信息
1.2 图像预处理
首先对乳腺钼靶侧斜位原始影像进行去皮肤、胸肌分割及乳头检测等预处理获取乳腺区域,然后对全局区域及局部区域包括水平带状区域、垂直带状区域和基元区域进行分割。
1.2.1去皮肤处理
本研究采用基于多方向Gabor滤波变换及Otsu阈值方法进行皮肤检测[21]。首先对原始图像去标签后进行灰度增强处理,在此基础上采用18方向Gabor滤波变换获取Gabor滤波尺度响应,然后对其进行Otsu阈值变换及面积滤波去除皮肤。
1.2.2胸肌检测
本研究采用基于霍夫变换的半自动方法进行胸肌检测[22]。具体方法如图1所示,对原始图像(见图1( a))进行去皮肤处理后,分割包含胸肌的感兴趣区域(ROI),如图1(b)所示。其中,N1为最左上侧像素点,N5为最左下侧像素点,N2为乳腺区域中距离N5最远的点,N3为N1与N5的中间点,N1、N2、N3与N4构成矩形区域。对该区域进行归一化及图像增强处理后,采用高斯滤波(σx=σy=4)方法进行去噪,然后求取ROI区域的Canny算子梯度,经形态学处理后进行霍夫变换并检测直线,如图1(d)所示。选择满足条件延长直线与N1和N2有一个交点且与N1和N5有一个交点的最长直线表示胸肌,如图1(e)所示。分割结果如图1(f)所示。

图1 胸肌检测。(a)原始图像;(b)感兴趣区域及控制点;(c)感兴趣区域;(d)感兴趣区域的霍夫变换;(e)检测出的胸肌线;(f)去除胸肌后图像
1.2.3乳头检测

1.3 目标区域分割
1.3.1带状区域
根据Tabar等提出的侧斜位图像水平标记及侧斜标记思想[11],本研究对图像进行了平行于胸肌方向的垂直带状分割与垂直于胸肌方向的水平带状分割。对原始图像预处理后,以乳头位置为基准点,胸肌方向为参考方向进行分割,如图2(a)所示。对于垂直带状区域,分别对左右乳腺图像沿胸肌方向将乳腺图像平均分割为9个带状区域,如图2(b)所示;取每个带状区域面积最大的矩形区域作为垂直带状目标区域,如图2(c)所示。对于水平带状区域,以乳头位置及垂直胸肌方向为参考将乳腺图像分为上下区域,分别对左右乳腺图像的上下区域沿垂直于胸肌方向各平均分为4.5个带状区域,每个图像上下区域共分为9个带状区域,如图2(d)所示;取每个带状区域面积最大的矩形区域作为水平带状目标区域,如图2(e)所示。

图2 带状区域分割。(a)原始图像;(b)垂直带状区域;(c)垂直带状矩形区域;(d)水平带状区域;(e)水平带状矩形区域

图3 基元区域分割。(a)原始图像;(b)乳腺区域;(c)高斯差分滤波图像;(d)基元区域
1.3.2基元区域
高斯差分(difference of gaussian, DoG)滤波可以将图片中感兴趣区域增强,在乳腺钼靶图像中常被用来检测可疑区域、乳腺肿块等[14]。对原始图像预处理后进行高斯差分滤波(带宽分别设为7和51)、阈值处理和形态学计算获得基元区域[21],如图3所示。
1.3.3全局区域
本研究采用乳腺区域的最大面积矩形区域作为全局区域[19],如图4所示。

图4 全局区域分割。(a)原始图像;(b)乳腺区域;(c)全局区域
1.4 影像特征提取
本研究针对带状区域提取空间差异性特征及结构相似性特征,针对基元区域提取其位置特征,针对全局区域提取空间差异性特征、结构相似性特征及密度紧凑度特征。双侧图像对应特征的差值绝对值作为不对称性特征进行统计分析。
1.4.1空间差异性特征提取
由于半方差函数可以描述区域的空间变化尺度和模式差异性,本研究采用半方差函数描述符进行乳腺钼靶图像局部区域的空间差异性分析。二维变异函数为
(1)
式中,um,0和um,h是空间坐标(x,y)处以步长h分离的两个向量对,f为灰度值。
Casti 等采用空间差异性计算乳腺钼靶图像双侧不对性[12],本研究引入该类特征进行近期乳腺癌风险预测研究。对于每对带状区域,设置最大步长hmax为两个区域中较小区域长度的一半,将hmax分为n等份,单元长度Δx=hmax/n,步长h分别设置为Δx,2Δx,...,nΔx,每个区域得到n个半方差值。以x轴表示不同观测步长(h),y轴表示半方差值,得到经验半方差图。采用球形最小二乘法对经验半方差拟合,得到拟合函数。以本研究采用数据中的某样本为例,对左右两侧乳腺钼靶图像的中心区域进行空间差异性分析,获得左右两侧图像的经验半方差图及对应的拟合函数,如图5各点及曲线所示。其中,实点菱形及实曲线分别为左侧乳腺钼靶图像经验半方差值和拟合曲线,空心方格及虚曲线分别为右侧乳腺钼靶图像经验半方差值和拟合曲线。3个符号s、a、r分别表示半方差图的3个重要特征:基台值、块金方差和变程。其中,基台值(sill,s)表示随机变量的方差,变程(range,r)反映了研究对象中某一区域化变量的变化程度,块金方差(nugget variance,a)表示微小变异。

图5 空间变异曲线
在带状区域中首先计算左右图像各带状区域的块金方差、基台值及变程,然后计算左右图像对应带状区域相应特征的差值绝对值,再提取其统计特征包括几何平均值和众数作为该样本不对称性特征。在全局区域中,首先计算左右图像全局区域的块金方差、基台值及变程,然后计算左右图像对应带状区域相应特征的差值绝对值,将差值绝对值作为该样本不对称性特征。在灰度图像、Gabor滤波尺度响应及Gabor滤波相位响应中均进行了这类特征提取,对带状区域共提取空间差异性特征36个,针对全局区域共提取空间差异性特征18个。
1.4.2结构相似性特征提取
结构相似度(structure similarity, SSIM)指数是将图像亮度、对比度和结构3个因素组合来描述两个图像的相似度,通常采用均值进行亮度估计,采用标准差进行对比度估计,采用协方差作为结构相似度估计[17]。给定大小为M×N的矩形图像对X和Y,二者间的SSIM计算公式为
(2)
式中,μx、μy为X和Y的均值,σx、σy为X和Y的方差,σxy为X和Y的协方差,K1、K2为常数。
针对每一样本,首先以左右对应区域中心位置为基准点获取大小相等区域。然后计算左右图像各带状区域的结构相似性指数SSIM,并计算SSIM的统计特征均差值的差值绝对值作为该样本不对称性特征。同时,在灰度图像、Gabor滤波尺度响应及相位响应对应区域均提取了该类特征。对全局区域,则计算左右图像SSIM的差值绝对值为该样本不对称性特征。对带状区域共提取结构相似性特征6个,针对全局区域共提取结构相似性特征3个。
1.4.3基元区域位置信息特征提取
本研究采用高斯差方法检测乳腺钼靶图像可疑区域,并提取位置信息特征进行近期乳腺癌风险预测研究。为方便建立坐标系进行位置信息表达,将图像旋转θ,其中θ为胸肌与垂直方向夹角,以乳头为原点,垂直于胸肌方向为x轴建立坐标系,以距离及角度表示区域中每个像素点的位置信息,如图6(b)所示。将左右乳腺区域以乳头为参考点,各自分成6个部分,乳头上侧分为1.5个等宽区域,下侧分为1.5个等宽区域,乳头位置至垂直胸肌分为等长两个区域,如图6(c)所示。分别计算左右两个图像每个部分的基元区域中各像素点的距离及角度的统计特征,左右对应部分的距离及角度统计特征的差值的绝对值作为不对称性特征。

图6 基元区域坐标系及子区域。(a)原始图像;(b)基元区域坐标系;(c)基元区域子区域
针对每一样本,首先计算左右图像各部分基元区域像素点与原点的距离及角度,然后计算这些像素点距离的最小值,角度的方差和范围,对左右图像对应部分的距离和角度统计特征的差值绝对值作为该样本不对称性特征,在6个部分中共提取该类特征18个,在整体基元区域提取该类特征3个。
1.4.4密度相关特征提取
针对预处理后的乳腺区域提取其紧密度特征。给定大小为M×N的矩形图像X,计算其密度紧凑度。左右图像的密度紧凑度差值的绝对值作为该样本的不对称性特征,有

1.5 特征选择及风险预测分析
本研究共提取了60维局部区域特征,25维全局区域特征。考虑到影像特征中冗余的现象,首先进行了去冗余处理,筛选掉相关性较大的特征。具体方法为:通过相关性分析筛选掉所有特征中相关系数较大的特征,当两个特征相关系数大于给定阈值(阈值设置为0.6[23-24])时,筛掉与其他特征相关性大的特征。本研究通过去冗余处理,筛选掉7个特征,保留78个两两相关性均小于0.6的特征。然后通过留一法和逐步逻辑回归进行特征选择,并利用广义线性模型(generalized linear model, GLM)建立近期乳腺癌风险预测模型。由于年龄和乳腺X线分型是乳腺癌重要风险因子,因此根据年龄段分为3个子集:年龄段1,37~49岁,共148例;年龄段2,50~65岁,共314例;年龄段3,66~87岁,共94例,分别进行近期乳腺癌风险预测分析。同时,由于该样本乳腺X线分型脂肪型(BIRADS 1)只有26例,而致密型(BIRADS 4)只有17例,因此本研究根据乳腺X线分型将样本分为2个子集:214例少量腺体型(BIRADS 2)和299例多量腺体型(BIRADS 3),对其进行了近期乳腺癌风险预测分析。本研究主要采用ROC曲线(AUC值)、优势比(odds ratio, OR)以及混淆矩阵分析灵敏度及特异性等,对模型进行评价。
2 结果
2.1 近期乳腺癌风险预测模型评价
对全局区域双侧不对性特征及局部区域双侧不对性特征,分别采用本研究建立的模型进行分析,其AUC值分别为0.527 3±0.024 3与0.632 6±0.023 3。将全局区域不对称性特征与局部区域不对称性特征相结合,进行近期乳腺癌风险预测,AUC值提高为0.666 7±0.022 6,如表2及图7所示。
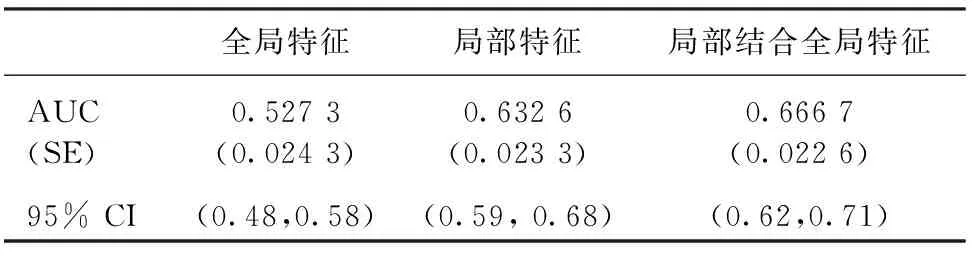
表2 全局不对称性特征、局部不对称性特征及二者相结合的风险预测AUC值及95% 置信区间

图7 对全局不对称性特征、局部不对称性特征及二者相结合的ROC曲线
本研究采用留一法和逐步逻辑回归进行特征选择,针对556个样本共进行了556次特征选择,在这些特征选择中被选择的特征共23个,其中包括8个局部区域不对称性特征和5个全局区域不对称性特征。针对这些特征,采用Weka软件组合树结构和Logistic回归模型LMT方法进行10折交叉验证分析,获得单特征风险预测的AUC值及灵敏度,如表3所示。选择次数高于500的被选择特征其灵敏度最低的特征为第6部分基元区域的角度范围不对称性特征,灵敏度为0.435 3;反之,灵敏度最高的特征为全局区域沿垂直方向的基台值,灵敏度为0.928 1。
对局部区域不对称性特征与全局区域不对称性特征相结合进行近期乳腺癌风险预测,获得每个样本的风险预测值,共556个风险预测值。将其按序从小到大排列后按序均分为5组,其中1~4组各111个样本,第5组为112个样本,对这5组样本分别计算各组中高风险样本个数及低风险样本个数,并将第1组作为基准值,后面4组分别以此为基准计算其优势比OR值及对应95%置信区间,结果如表4所示。其中,5组中最大的OR值为5.208 3,对应95%置信区间为[2.94, 9.22],对风险预测值进行回归分析,各组OR值随风险概率的增大而逐渐增大,增加趋势一致(P值为0.002 033 )。

表3 被选择特征及其性能表现

表4 局部区域特征结合全局区域特征获得的OR值
采用局部区域结合全局区域不对称性特征进行近期乳腺癌风险预测,获得每个样本风险预测值,由此计算得到混淆矩阵如表5所示。

表5 局部区域结合全局区域不对称性特征获得的风险预测值的混淆矩阵
从表5可以看到,采用局部区域不对称性与全局区域不对称性特征相结合进行近期乳腺癌风险预测,该模型特异性为0.690 6,灵敏度为0.521 6,准确率为60.61%,阳性预测值为0.627 7,阴性预测值为0.590 8。
2.2 基于年龄的乳腺癌风险预测模型评价
对局部区域特征联合全局区域特征进行近期乳腺癌风险预测,对获得样本风险预测值根据样本年龄分为3组,计算各组的AUC值,如表6所示,对应ROC曲线如图8所示。结果显示,样本年龄段37~49岁的AUC值达到0.681 0±0.043 2,高于样本年龄段50~65岁及66~87岁的AUC值,但采用R语言DeLong检验表明三者之间均无显著差异(P>0.05)。而样本年龄段50~65岁的AUC值与样本年龄段66~87岁的AUC值分别为0.671 6±0.030 0和0.678 2±0.054 7,二者接近一致。
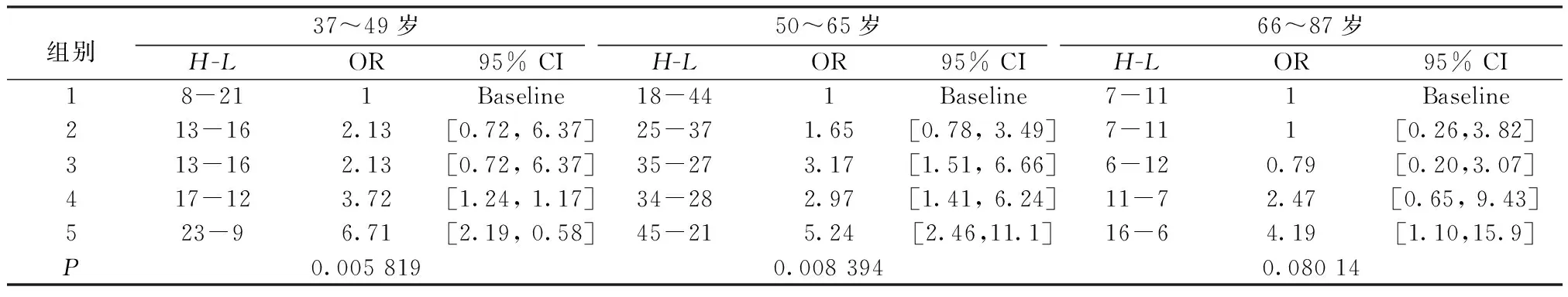
表7 不同年龄段的OR值及对应95% 置信区间

表6 不同年龄段的风险预测AUC值及95% 置信区间
对3个年龄段样本的风险概率值由小到大进行排列,分别将其均分为5组,分别计算OR值及对应95%置信区间,结果如表7所示。3个年龄段样本最大的OR值分别6.708 3,5.238 1及4.190 5,对应的95%置信区间分别为[2.186 3, 20.583 5],[2.463 6, 11.137 1]及[1.104 4, 15.900 6]。

图8 基于年龄段的近期乳腺癌风险预测ROC曲线
对每个年龄段的风险概率值分为5组后,计算各组OR值随风险概率的增大而进行变化的情况,年龄段37~49岁的样本集与年龄段50~65岁的样本集其增加趋势逐渐上升,P值分别为0.005 819和0.008 394,均小于0.05,而年龄段66~87岁的的样本集OR值趋势没有显著增加(P值为0.080 14),各年龄段样本集的OR值趋势走向如图9所示。

图9 基于年龄段的近期乳腺癌风险预测OR值趋势
对不同各年龄段的风险预测值计算对应混淆矩阵(分类阈值设为0.7),如表8所示。

表8 不同年龄段的风险预测混淆矩阵
由表8可以看出,对年龄段37~49岁的148例样本,其特异性为0.702 7,灵敏度为0.554 1,准确率为62.84%,阳性预测值为0.650 8,阴性预测值为0.611 8;对年龄段50~65岁的314例样本,其特异性和灵敏度分别为0.694 3和0.490 4,准确率为59.24%,阳性预测值为0.616 0,阴性预测值为0.576 7;对年龄段66~87岁的94例样本,其特异性为0.723 4,灵敏度为0.574 5,准确率为64.89%,阳性预测值为0.675 0,阴性预测值为0.629 6。
2.3 基于乳腺X线分型的乳腺癌风险预测模型评价
采用局部区域特征结合全局区域特征进行近期乳腺癌风险预测,对样本风险预测值根据乳腺密度分型将其分为2组,BIRADS2型及BIRADS3型,计算各组的AUC值,如表9所示,对应ROC曲线如图10所示。结果显示,样本BIRADS 3的AUC值达到0.694 4±0.03,高于样本BIRADS 2的AUC值(0.654 5±0.036 9)。

表9 不同乳腺密度分型的预测AUC值及95%置信区间

图10 基于乳腺密度分型的近期乳腺癌风险预测ROC曲线
对BIRADS 2和BIRADS 3样本的风险概率值分别由小到大进行排列,并分别将其均分为5组,各自计算OR值及对应95%置信区间,结果如表10所示。2组样本中最大的OR值分别3.720和7.257 4,对应的95%置信区间分别为[1.539 5,8.988 9]和[3.262 5,16.144 0]。
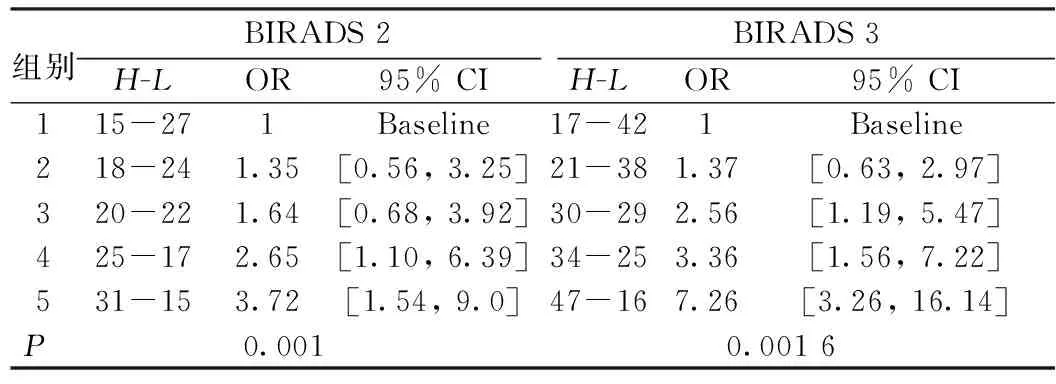
表10 不同乳腺密度分型的OR值及对应95% 置信区间
对样本集BIRADS 2和样本集BIRADS 3的风险概率值分为5组后,分别计算各组OR值随风险概率的增大而进行变化的情况,BIRADS 2的样本集与BIRADS 3的样本集其增加趋势逐渐上升,P值分别为0.001 0和0.001 6,均小于0.05,OR值趋势走向如图11所示。
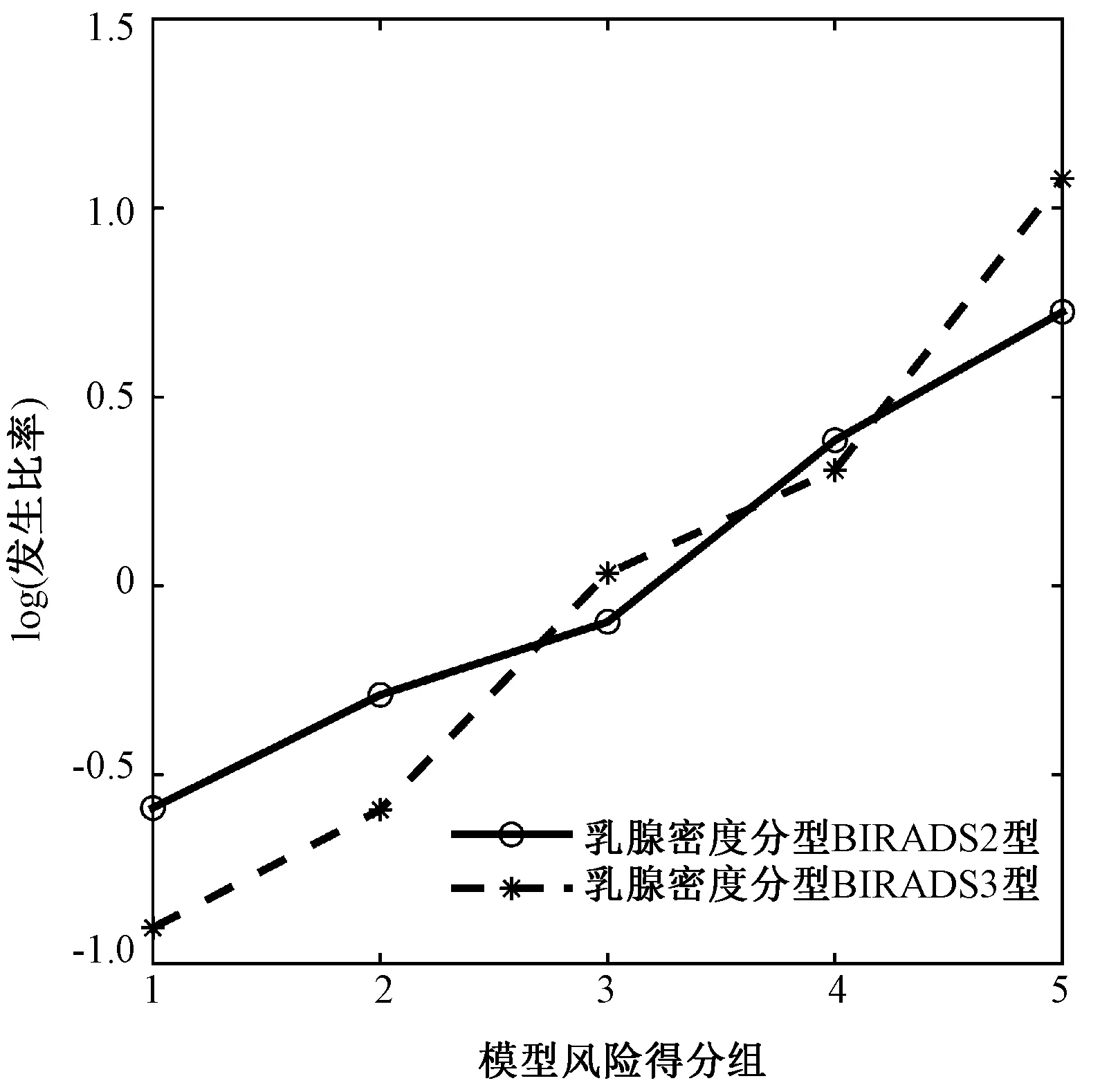
图11 基于乳腺密度分型的近期乳腺癌风险预测OR值趋势
对不同乳腺密度分型的风险预测值计算对应混淆矩阵(分类阈值设为0.7),如表11所示。表11为不同乳腺X线分型的风险预测混淆矩阵。对BIRADS 2的214例样本其特异性为0.676 2,灵敏度为0.522 9,准确率为59.81%,阳性预测值为0.626 4,阴性预测值为0.577 2。对BIRADS 3的299例样本其特异性为0.733 3,灵敏度为0.536 9,准确率为63.55%,阳性预测值为0.666 7,阴性预测值为0.614 5。

表11 不同乳腺X线分型的风险预测混淆矩阵
3 讨论
本研究对乳腺钼靶侧斜位图像的局部区域结合全局区域的双侧不对称性特征与近期乳腺癌风险预测的关联性进行了研究,并分别针对不同年龄段和不同乳腺X线分型子样本集进行了分析研究。与前人研究相比,本研究有几点不同之处,并且得到不同的研究结果。
1)尽管之前的研究探讨了双侧乳腺钼靶图像密度不对称性对近期乳腺癌风险的影响 且证明了双侧图像的不对称性特征比单图像特征更具有近期乳腺癌风险预测能力,但均是针对全局区域双侧不对称性进行探讨[19,25-27], 而在临床上双侧局部密度不对称性是放射学家进行乳腺钼靶阅片时重要的乳腺癌风险评估因子[28-29]。本研究则采用全局区域与局部区域双侧不对称性相结合的方法探讨了MLO位图像与近期乳腺癌风险预测的关联性。本文研究结果仅采用全局区域不对称性特征进行近期乳腺癌风险预测AUC值为0.527 3±0.024 3,单独采用局部区域不对称性特征相结合AUC值上升为0.632 6±0.023,结果与放射学家在临床实际阅片时采用局部双侧钼靶图像不对称性特征,比采用全局双侧钼靶图像不对称性特征有更高的性能相一致。本研究还显示全局区域不对称性特征与局部区域不对称性特征相结合进行近期乳腺癌风险预测AUC值得到显著提高,达到0.666 7±0.022 6。同时,通过对风险预测值进行回归分析发现,OR值随着风险的增加而显著增加(P值为0.002 033)。
2)由于风险预测模型依赖于训练和测试的数据集,不能将本研究结果与之前不同数据集研究结果进行比较。但是,不同于前人的近期乳腺癌风险预测研究方法[18, 25-27],本研究采用556例年龄匹配的FFDM数据集。利用年龄匹配的数据集可以减少由年龄这一重要风险因子带来的偏差[30]。 同时,本研究采用留一法逐步逻辑回归进行特征选择建立了一个基于广义线性模型(generalized linear model, GLM)的近期乳腺癌风险预测模型。采用留一法进一步减少了来自特征和测试样本带来的偏差。因此,本研究应该更具有可靠性和鲁棒性。
3)本研究探讨了风险预测模型在不同年龄段上的性能表现。对3个年龄段37~49岁,50~65岁,66~87岁,AUC值分别为0.681 0±0.043 2,0.671 6±0.030 0和0.678 2±0.054 7。虽然三者之间,样本年龄段37~49岁的AUC值最高,但这3个年龄段之间的AUC值并无显著差异(P>0.05)。结果表明,尽管年龄是乳腺癌的重要风险因子,但是本研究基于年龄段的近期乳腺癌风险预测研究结果则表明,乳腺组织模式从阴性到阳性的变化程度在不同年龄段之间并无显著差异。
4)本研究探讨了风险预测模型在不同乳腺X线分型中的性能表现。由于BIRADS1和BIRADS4样本数很少(分别为26例和17例,所占比例分别为4.68%和3.06%),本研究只探讨了BIRADS 2和BIRADS 3 的性能表现。BIRAD2和BIRAD3的AUC值分别为0.654 5±0.036 9和0.694 4±0.03。结果表明,风险预测AUC值从BIRADS2到BIRADS3有一个上升的趋势,与乳腺X线分型这一重要的乳腺癌风险因子进行钼靶密度评估时等级越高风险越大模式是一致的。
5)本研究探索了以乳腺钼靶MLO位影像为基础的个体化近期乳腺癌风险评估方法,这样可以把有限的医疗资源集中应用于那些少数具有近期高风险的人群中,以提高乳腺癌的早期预防和检测精度,同时又可以减少假阳性率。本研究模型在556个样本进行测试时其敏感性为0.521 6,特异性为0.690 6,则本研究模型能够识别大约30.94%(309/1 000)高风险的人群,剩下的69.05%(691/1 000)为低风险的人群。假设下一年普查中癌症检测率为0.3%(3/1000)[27],采用本研究模型则在这309个高风险人群中检测出3个癌症患者,癌症检测率提升为0.97%(3/309),比当前普查的癌症检测率0.3%高出3.2倍。在这种更低的癌症检测率下,较高的特异性是非常重要的,可以排除一大批低风险概率妇女避免频繁普查,同时降低了假阳性率[27]。
本研究表明,从乳腺钼靶侧斜位图像提取的局部特征及全局特征与近期乳腺癌风险预测存在一定的关联性,但本研究仍存在一定局限性。首先样本数量相对较少,导致结果可能存在一定偏差。其次,本研究所用图像样本要求连续两年进行乳腺钼靶图像普查,前一年检查结果为阴性,但是前次普查“阴性”结果只是通过图像判断,并没有进行病理检查验证。因此本研究所建立的模型仍需要采用更多样本数据进一步进行研究验证。
4 结论
前人研究证明了乳腺钼靶图像双侧不对称性可以用来预测近期乳腺癌风险,但均是针对全局区域不对称性进行的研究,且采用的均是年龄不匹配数据集[19, 24-26]。为此前期提出了局部区域结合全局区域提取双侧不对称性特征进行近期乳腺癌风险预测研究的方法,并在CC位进行了研究[31]。本研究则探讨了MLO位图像采用此方法进行近期乳腺癌风险预测的价值。与其他采用双侧钼靶图像不对称性进行近期乳腺癌风险预测方法相比,该研究的主要改进和新意体现在:第一,在策略上,采用局部区域不对称性与全局区域不对称性相结合的方法进行近期乳腺癌风险预测;第二,在特征选择方面,该研究提取了灰度图像、多方向Gabor滤波尺度响应及相位响应的目标区域空间差异性和结构相似性特征,以及可疑钙化点区域位置信息特征;第三,在数据上,该研究所采用的高风险组样本的年龄与低风险组样本的年龄互相匹配,这样既减少了年龄这一重要风险因子带来的预测偏差,也能够进行不同年龄段的风险预测研究。本研究结果表明,MLO位图像采用此方法可以有效帮助近期乳腺癌风险预测研究。由于本研究仍存在一定局限性,所建立的模型仍需要采用更多样本数据进一步进行研究验证。
[1] Siegel R, Naishadham D, Jemal A. Cancer statistics, 2013[J]. CA: A Cancer Journal for Clinicians, 2013, 63(1): 11-30.
[2] Tabár L, Vitak B, Chen HHT, et al. Beyond randomized controlled trials[J]. Cancer, 2001, 91(9): 1724-1731.
[3] Vainio H, Bianchini F, Heseltine E. IARC Handbook of Cancer Prevention, Volume 7: Breast Cancer Screening[M]. Lyon: IARC Press, 2002:1-248.
[4] Mandelson MT, Oestreicher N, Porter PL, et al. Breast density as a predictor of mammographic detection: comparison of interval and screen detected cancers[J]. Journal of the National Cancer Institute. 2000;92:1081-1087.
[5] Smith RA, Cokkinides V, Brooks D, et al. Cancer screening in the United States, 2011[J]. CA: A Cancer Journal for Clinicians, 2011, 61(1): 8-30.
[6] Buist DSM, Anderson ML, Haneuse SJPA, et al. Influence of annual interpretive volume on screening mammography performance in the United States[J]. Radiology, 2011, 259(1): 72-84.
[7] Schousboe JT, Kerlikowske K, Loh A, et al. Personalizing mammography by breast density and other risk factors for breast cancer: analysis of health benefits and cost-effectiveness[J]. Annals of Internal Medicine, 2011, 155(1): 10-20.
[8] Amir E, Freedman OC, Seruga B, et al. Assessing women at high risk of breast cancer: a review of risk assessment models[J]. Journal of the National Cancer Institute, 2010, 102(10):680-691.
[9] Gail MH, Mai PL. Comparing breast cancer risk assessment models [J]. Journal of the National Cancer Institute, 2010, 102(10):445-452.
[10] Casti P, Mencattini A, Salmeri M, et al. Automatic detection of the nipple in screen-film and full-field digital mammograms using a novel hessian-based method[J]. Journal of Digital Imaging, 2013, 26(5):948-957.
[11] Brem RF, Torrente J. Breast cancer: The art and science of early detection with mammography: Perception, interpretation, histopathologic correlation[J]. Jama the Journal of the American Medical Association, 2008, 300(300):1822-1822.
[12] Casti P, Mencattini A, Salmeri M, et al. Analysis of structural similarity in mammograms for detection of bilateral asymmetry[J]. IEEE Transactions on Medical Imaging, 2015, 34(2):662-671.
[13] Rafiee G, Dlay SS, Woo WL. Region-of-interest extraction in low depth of field images using ensemble clustering and difference of Gaussian approaches[J]. Pattern Recognition, 2013, 46(10):2685-2699.
[14] Jr CD, Baydush AH, Jr FC. Characterization of difference of Gaussian filters in the detection of mammographic regions[J]. Medical Physics, 2006, 33(11):4104-4114.
[15] Zheng B, Chang YH, Gur D. Computerized detection of masses in digitized mammograms using single-image segmentation and a multilayer topographic feature analysis[J]. Academic Radiology, 1995, 2(11):959-966.
[16] Ayres FJ, Rangayyan RM. Design and performance analysis of oriented feature detectors[J]. Journal of Electronic Imaging, 2007, 16(2):147-154.
[17] Wang Z, Bovik AC, Sheikh HR, et al. Image quality assessment: from error visibility to structural similarity[J]. IEEE Transactions on Image Processing, 2004, 13(4):600-612.
[18] Zheng B, Sumkin JH, Zuley ML, et al. Computer-aided detection of breast masses depicted on full-field digital mammograms: a performance assessment [J]. British Journal of Radiology, 2012, 85(1014):153-161.
[19] Tan M, Pu J, Cheng S, et al. Assessment of a four-view mammographic image feature based fusion model to predict near-term breast cancer risk[J]. Annals of Biomedical Engineering, 2015, 43(10):2416-2428.
[20] Li Yane, Fan Ming, Li Lihua, et al. Prediction of near-term breast cancer risk using local region-based bilateral asymmetry features in mammography[C]//SPIE Medical Imaging. Orlando: SPIE, 2017, 10138:101380L1-101380L8.
[21] Casti P, Mencattini A, Salmeri M, et al. Estimation of the breast skin-line in mammograms using multidirectional Gabor filters[J]. Computers in Biology & Medicine, 2013, 43(11):1870-1881.
[22] Ganesan K, Acharya UR, Kuang CC, et al. Pectoral muscle segmentation: A review[J]. Computer Methods & Programs in Biomedicine, 2013, 110(1):48-57.
[23] Hauskrecht M, Pelikan R, Malehorn DE, et al. Feature selection for classification of SELDI-TOF-MS proteomic profiles[J]. Applied Bioinformatics, 2005, 4(4): 227-246.
[24] Häberle L, Wagner F, Fasching PA, et al. Characterizing mammographic images by using generic texture features[J]. Breast Cancer Research, 2012, 14(2):1-12.
[25] Zheng Bin. Bilateral mammographic density asymmetry and breast cancer risk: a preliminary assessment[J]. European Journal of Radiology, 2012, 81(11): 3222-3228.
[26] Tan Maxine, Zheng Bin, Ramalingam P, et al. Prediction of near-term breast cancer risk based on bilateral mammographic feature asymmetry[J]. Academic Radiology, 2013, 20(12):1542-1550.
[27] Tan M, Zheng B, Leader JK, et al. Association between changes in mammographic image features and risk for near-term breast cancer development[J]. IEEE Transactions on Medical Imaging, 2016, 35(7):1719-1728.
[28] Smith RA, Andrews K, Brooks D, et al. Cancer screening in the United States, 2016: A review of current American Cancer Society guidelines and current issues in cancer screening[J]. CA: A Cancer Journal for Clinicians. 2016, 66: 95-114.
[29] Boyd NF. Mammographic density and the risk and detection of breast cancer[J]. New England Journal of Medicine, 2009, 356(3): 227-236.
[30] Martin LJ, Melnichouk O, Guo H, et al. Family history, mammographic density, and risk of breast cancer[J].Cancer Epidemiology, Biomarkers & Prevention, 2010, 19(2):456-463.
[31] Li Yane, Fan Ming, Cheng Hu, et al. Assessment of global and local region-based bilateral mammographic feature asymmetry to predict short-term breast cancer risk[J]. Physics in Medicine and Biology, 2018, 63(2):025004-025017.

