不同病因分型的穿支动脉供血区梗死患者的临床及影像学研究
刘翠翠,李文君,刘俊艳
穿支动脉供血区梗死指发生于基底节区、脑干等穿支动脉供血区域的脑梗死。导致穿支动脉急性闭塞的病因包括穿支动脉疾病(penetration artery disease,PAD)(包括穿支动脉入口内粥样硬化及穿支动脉脂质玻璃样变)、穿支动脉所起源的母体动脉-载体动脉斑块堵塞穿支动脉(parent artery plaque occluding penetrating artery,POPA)。PAD属于小血管病变,POPA为大动脉粥样硬化型卒中,二者病因不同,预后及二级预防策略迥异。经典低分子肝素治疗急性卒中试验(Trial of Org 10 172 in Acute Stroke Treatment,TOAST)病因分型对大动脉粥样硬化型卒中的诊断[1],以责任动脉粥样硬化性狭窄>50%作为诊断标准。然而,作为责任血管体积微小的不稳定动脉粥样硬化斑块难以经传统血管影像学检查明确诊断。而高分辨率磁共振管壁成像(high-resolution magnetic resonance imaging,HR-MRI)技术可检测出微小的动脉粥样硬化斑块,有助于穿支动脉供血区梗死的病因分型,利于卒中急性期治疗措施的选择及二级预防。基于此,本研究应用HR-MRI技术,根据中国缺血性卒中分型诊断(Chinese Ischemic Stroke Subclassification,CISS)[2],对穿支动脉供血区梗死灶的病因分型及临床特征进行研究。
1 资料与方法
1.1 研究对象 入组标准:纳入发病后2周内的豆纹动脉、脑桥旁正中动脉供血区急性缺血性卒中患者作为研究对象,所有患者均经弥散加权成像(diffusion weighted imaging,DWI)明确诊断,并经由常规血管影像学及HR-MRI完成卒中病因学分型。所有入组患者常规登记人口构成情况,并于入院24 h内完成血常规、血凝分析、生化全项、同型半胱氨酸及糖化血红蛋白水平测定等化验,部分患者完成血液的分子学检验,入院72 h内完成经颅多普勒超声(transcranial Doppler,TCD)、颈动脉超声、颅脑磁共振血管造影(magnetic resonance angiography,MRA)、磁共振成像(magnetic resonance imaging,MRI)、DWI等头颅影像学检查。并记录入院时及病后5 d内的美国国立卫生研究院卒中量表(National Institutes of Health Stroke Scale,NIHSS)评分用于进展性运动功能缺损的评估。
排除标准:①依据CISS分型标准,排除心源性、动脉源性栓塞,其他原因及未明原因所致卒中患者;②生命体征不平稳及具有严重的心、肺、肾等功能障碍不能耐受磁共振检查者;③体内有金属植入等各种磁共振检查禁忌证者。
1.2 HR-MRI成像技术方法及图像解读 使用3.0T磁共振扫描仪(Verio;Siemens,Erlangen,Germany)以及8通道头颅线圈对病变载体动脉即大脑中动脉或基底动脉进行HR-MRI扫描。其成像序列包括3种:T1加权、T2加权和质子加权,并应用饱和脉冲技术抑制血流信号,增加图像对比度。动脉粥样硬化斑块在HR-MRI图像上多表现为管壁偏心性增厚,或非均匀的环形增厚,动脉管壁最薄处直径不足最厚处直径的50%[3]。HR-MRI扫描结果由一名神经科专业医师及一名影像科医师共同判读,意见不一致时经协商达成统一。
动脉狭窄程度及重构指数(remodeling index,RI)的计算:在质子加权图像上,手动描绘病变及参考血管的内外壁,经半自动方法定量测量病变及参考血管的管腔及血管面积。其中病变血管为最大管腔狭窄截面,参考血管为狭窄截面近端或远端正常血管截面。各种参数的计算方法如下:

RI≥1.05为正性重构,RI≤0.95为负性重构,介于二者之间为零重构[3]。
1.3 分组方法 依据HR-MRI成像结果,将载体动脉存在粥样硬化斑块的患者定义为POPA组,载体动脉未发现粥样硬化斑块且不伴近端大血管狭窄及易损斑块者为PAD组。
1.4 进展性运动功能缺损诊断标准 进展性运动功能缺损(progressive motor dysfunction,PMD)指卒中发生后的5 d内NIHISS评分中的运动条目增加≥1分,或运动条目波动≥1分,并排除感染、血糖异常及心功能障碍等引起的病情加重[4]。
1.5 统计学处理 采用SPSS 21.0统计软件。统计描述:符合正态分布的计量资料应用不符合正态分布的计量资料采用中位数(四分位数间距)描述;计数资料用率表示。参数估计:两组间计量资料应用t检验分析,非正态分布的变量应用Mann-WhitneyU检验。计数资料应用Pearsonχ2检验或Fisher确切概率法进行分析。检验水准α为0.05。
2 结果
2.1 两组不同病因类型卒中患者的人口构成及临床 64例穿支动脉供血区梗死患者满足入组标准纳入本研究。经HR-MRI扫描检查,最终明确诊断为POPA者48例(75%)。POPA患者吸烟率显著高于PAD患者(50%vs18.8%),POPA患者病情容易进展,PMD发生率高于PAD组,比较差异有统计学意义(P=0.004)。两组患者其他人口构成情况、血管病危险因素、基线NIHSS评分比较差异无统计学意义(表1)。
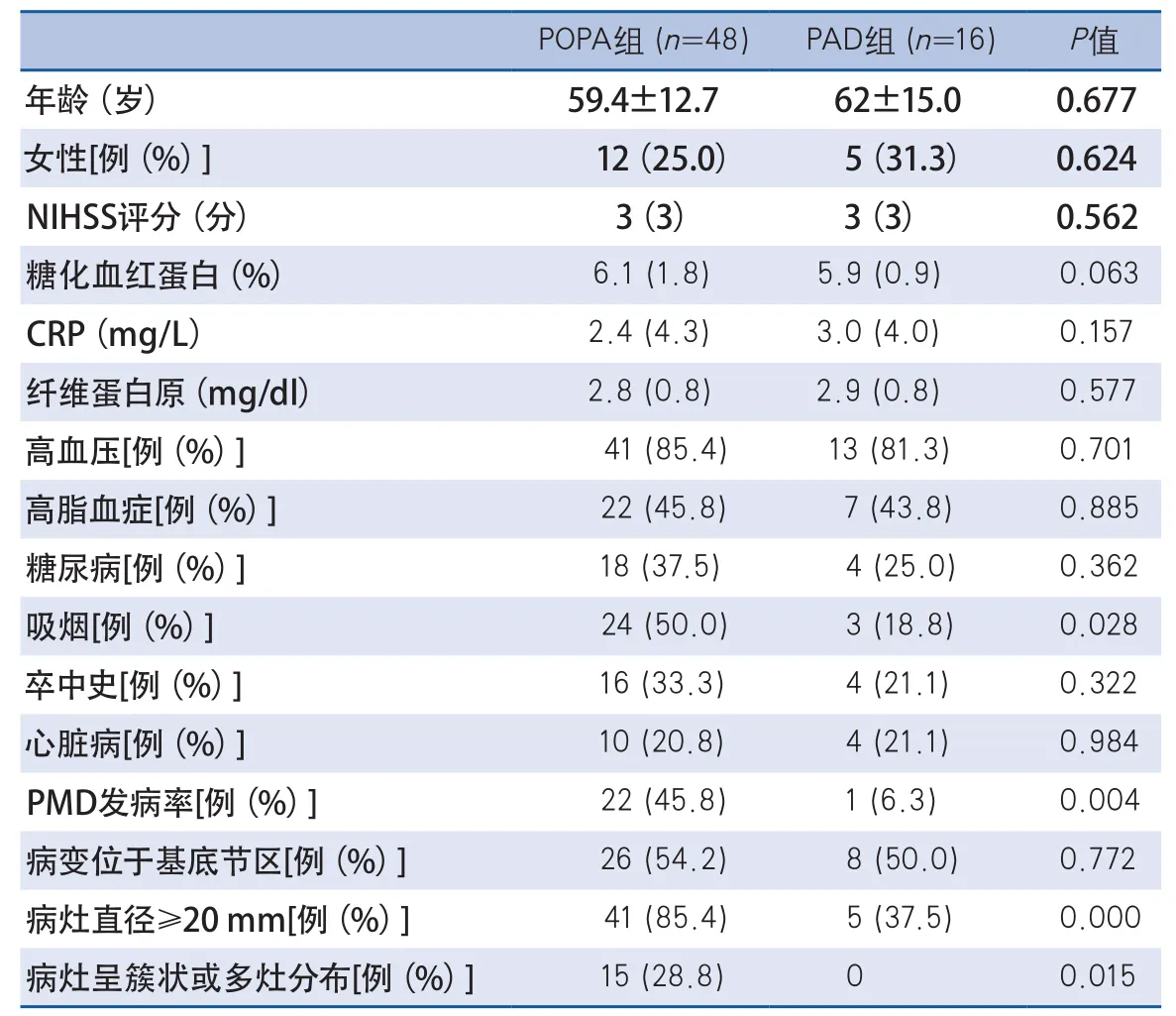
表1 POPA组与PAD组患者临床特征比较
2.2 HR-MRI与动脉粥样硬化性病变的诊断POPA组中21例(43.7%)患者经TCD、颅脑MRA等常规血管影像学检查未发现血管闭塞性病变,经管壁HR-MRI成像明确了载体动脉粥样硬化的诊断;该21例患者的血管狭窄程度为1%~57%,其中,13例为正性重构,5例为负性重构。
2.3 POPA患者病灶影像学特点 48例POPA组患者中,41例患者颅脑DWI显示病灶直径≥20 mm,而PAD组患者中仅2例患者病灶≥20 mm。
15例POPA组患者病灶形态呈簇状或卫星样多灶分布。该15例患者中,11例(73.3%)表现为PMD;22例POPA组的脑桥梗死患者中,16例表现为脑桥旁正中梗死。而8例PAD组脑桥梗死患者中仅1例表现为脑桥旁正中梗死,比较差异有统计学意义(P=0.002,Fisher确切概率法)。
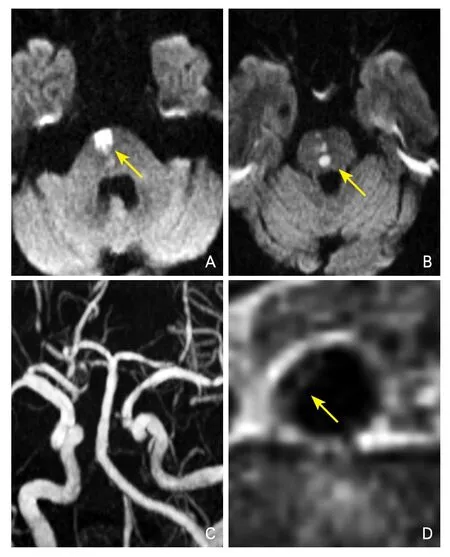
图1 一例脑桥POPA患者影像检查结果

图2 一例基底节PAD患者影像检查结果
3 讨论
本研究64例穿支动脉供血区梗死患者中,48例(75%)患者明确诊断为POPA,说明穿支动脉供血区梗死的病因学分类更多源于大动脉粥样硬化型。该病因分型不仅支持既往研究结论,认为颅内动脉粥样硬化性疾病为亚洲人群缺血性卒中的主要病理基础[5],而且,明确的卒中病因分型更有利于卒中二级预防及预后判断。
不同病因卒中患者血管病危险因素比较各研究报道并不完全一致[6-7],但吸烟作为颅内动脉粥样硬化性病变的主要危险因素之一已经被证实,且吸烟与卒中发病率呈剂量-反应关系[8]。本研究结果显示两组不同病因分型患者间仅吸烟率存在差异,POPA组患者的吸烟率显著高于PAD组患者,间接说明吸烟对颅内动脉粥样硬化的影响。故临床卒中预防工作中应强调戒烟的重要性,尤其对于年轻卒中患者吸烟可能为其唯一的血管病危险因素,相反戒烟会降低其卒中发生风险[8]。
HR-MRI作为动脉管壁MRI技术,可清晰地显示动脉管壁的细微结构,缩短临床与病理的距离,提高了卒中病因分型的诊断率。既往研究报道,在常规血管影像学筛检正常的卒中患者中,经HR-MRI发现颅内动脉粥样硬化的比例为38.5%~51.3%[9-11]。王江波等[12]的研究指出,在30例脑桥旁正中梗死患者中,MRA仅发现9例基底动脉狭窄患者,但HR-MRI发现25例患者基底动脉存在粥样硬化性斑块。本研究POPA组中21例(43.7%)患者经常规血管影像学检测未见异常者,经HR-MRI明确动脉粥样硬化的诊断。阳性诊断率与国内外研究报道基本一致。
常规血管影像学未检测出动脉粥样硬化性病变的原因与该类患者动脉管腔狭窄程度轻或表现为正性重构有关,后者病变部位血管管径正常难以被常规血管影像学发现。本研究21例由HR-MRI诊断为载体动脉粥样硬化病变患者的血管狭窄程度为1%~57%,其中61.9%患者存在正性重构。而正性重构是指在动脉粥样硬化形成过程中随着粥样硬化斑块体积的增加,病变局部管壁发生代偿性扩张,导致病变局部动脉外径增加而内径无明显狭窄[13]。具有正性重构特征的动脉粥样硬化性斑块具有脂质核心大、纤维帽较薄、斑块内炎症成分增多等特点,多为不稳定斑块,易导致急性血管事件发生[14]。一项颅内动脉重构模式与梗死类型的研究指出正性重构的存在与动脉-动脉栓塞事件相关[15]。
本研究POPA组患者PMD的发生率显著高于PAD组(P=0.004),尤其是梗死灶呈簇状分布的患者,PMD发生率高达73.3%。国外一项研究显示对于基底动脉供血区梗死患者,PMD的发生与基底动脉粥样硬化性病变显著相关[比值比(odds ratio,OR)=9.1,95%可信区间(confidence interval,CI)1.4~58.9][16]。因此,载体动脉粥样硬化及发生正性重构导致动脉-动脉栓塞可能成为POPA患者发生PMD的重要发病机制。对于经由头颅DWI显示为区域内多灶性梗死或者皮层多发微小梗死灶者,临床考虑动脉-动脉栓塞的可能,有必要进一步行HR-MRI检查以明确近端责任动脉或其载体动脉微小动脉粥样硬化斑块的存在,弥补常规血管影像学的不足。同时,临床医生也应尽早洞察该类卒中患者的不良预后,采取溶栓等诊疗措施,预防卒中的进展。
POPA患者颅脑DWI所示病灶形态及分布与PAD患者不同。POPA患者病灶相对较大,可表现为“巨大腔隙性梗死”或呈“多灶分布的团簇状梗死”,其发生机制为载体动脉粥样硬化性斑块延伸累及多个穿支动脉开口,或不稳定斑块破裂,致多个穿支动脉栓塞引起,导致较大体积的梗死或簇状梗死的出现。此外,本研究入组的脑桥POPA患者病灶多累及基底部表面,而PAD患者的梗死灶多位于脑桥深部。病理研究证实脑桥基底部梗死患者载体动脉粥样硬化发生率显著高于脑桥深部腔梗[17],与本研究结论一致。综上,依据DWI所示病灶位置、大小及形态可初步判断穿支动脉供血区梗死的病因分型。
由于HR-MRI扫描时间长,费用昂贵,对患者合作性要求较高等因素影响,导致入组病例数较少,研究结果可能存在一定偏倚,尚需大规模前瞻性研究进一步证实。其次,目前的检测技术尚无法证实穿支动脉粥样硬化的存在,也无法证实载体动脉粥样硬化性病变是否为穿支动脉供血区梗死患者的责任病变,而并非伴随病变。此外由于本文中所发现斑块多为微小斑块,影响对斑块性质的判断,因此并未对斑块性质与梗死病灶特点进一步分析。
参考文献
[1]ADAM H P J R,BENDIXEN B H,KAPPELLE L J,et al. Classification of subtype of acute ischemic stroke. Definitions for use in a multicenter clinical trial. TOAST. Trial of Org 10172 in Acute Stroke Treatment[J]. Stroke,1993,24(1):35-41.
[2]GAO S,WANG Y J,XU A D,et al. Chinese ischemic stroke subclassification[J/OL]. Front Neurol,2011,2:6. https://doi.org/10.3389/fneur.2011.00006
[3]XU W H,LI M L,GAO S,et al. In vivo highresolution MR imaging of symptomatic and asymptomatic middle cerebral artery atherosclerotic stenosis[J]. Atherosclerosis,2010,212(2):507-511.
[4]YAMAMOTO Y,OHARA T,HAMANAKA M,et al. Predictive factors for progressive motor deficits in penetrating artery infarctions in two different arterial territories[J]. J Neurol Sci,2010,288(1-2):170-174.
[5]GORELICK P B,WONG K S,BAE H J,et al.Large artery intracranial occlusive disease:a large worldwide burden but a relatively neglected frontier[J].Stroke,2008,39(8):2396-2399.
[6]LV P,JIN H,LIU Y,et al. Comparison of risk factor between lacunar stroke and large artery atherosclerosis stroke:a cross-sectional study in China[J/OL]. PLoS One,2016,11(3):e0149605.https://doi.org/10.1371/journal.pone.0149605
[7]王桂红,郑华光,王伊龙,等. 缺血性脑卒中患者颅内/外脑大动脉粥样硬化性狭窄的分布及其预测因素[J]. 中国卒中杂志,2006,1(8):543-547.
[8]SHAH R S,COLE J W. Smoking and stroke:the more you smoke the more you stroke[J]. Expert Rev Cardiovasc Ther,2010,8(7):917-932.
[9]KLEIN I F,LAVALLÉE P C,MAZIGHI M,et al.Basilar artery atherosclerotic plaques in paramedian and lacunar pontine infarctions:a high-resolution MRI study[J]. Stroke,2010,41(7):1405-1409.
[10]KIM J M,JUNG K H,SOHN C H,et al. Middle cerebral artery plaque and prediction of the infarction pattern[J]. Arch Neurol,2012,69(11):1470-1475.
[11]YOON Y,LEE D H,KANG D W,et al. Single subcortical infarction and atherosclerotic plaques in the middle cerebral artery:high-resolution magnetic resonance imaging findings[J]. Stroke,2013,44(9):2462-2467.
[12]王江波,江炜炜,徐俊,等. 高清磁共振研究基底动脉粥样硬化狭窄重构模式在脑桥旁正中梗死中的应用[J].中国卒中杂志,2013,8(12):953-958.
[13]CHUNG G H,KWAK H S,HWANG S B,et al. High resolution MR imaging in patients with symptomatic middle cerebral artery stenosis[J]. Eur J Radiol,2012,81(12):4069-4074.
[14]李文君,刘俊艳. 高分辨率磁共振成像与颅内动脉粥样硬化性疾病的诊断[J]. 中华神经科杂志,2015,48(8):711-714.
[15]ZHAO D L,DENG G,XIE B,et al. Wall characteristics and mechanisms of ischaemic stroke in patients with atherosclerotic middle cerebral artery stenosis:a high-resolution MRI study[J]. Neurol Res,2016,38(7):606-613.
[16]LIM S H,CHOI H,KIM H T,et al. Basilar plaque on high-resolution MRI predicts progressive motor deficits after pontine infarction[J]. Atherosclerosis,2015,240(1):278-283.
[17]FISHER C M,CAPLAN L R. Basilar artery branch occlusion:a cause of pontine infarction[J]. Neurology,1971,21(9):900-905.

