不同贮藏温度对采后伽师瓜果实冷害及品质的影响
安瑞丽,王 斌,魏长庆,杜红凤,唐凤仙*,单春会*
伽师瓜属葫芦科(Cutrbitaceae)黄瓜属(Cuccmis C.)瓜亚属(Melo Jeffrey)[1],是哈密瓜的一种。伽师瓜因其肉厚质细、味甘可口、色泽美丽诱人,深受消费者喜爱,是新疆南部地区的主栽品种。但由于其上市时间集中,采收季节温度较高,导致伽师瓜品质劣变迅速,腐烂严重,给采后贮运造成巨大的损失[2]。
低温贮藏是果蔬贮藏保鲜应用最普遍又最为有效的方法[3]。低温虽能显著抑制伽师瓜采后劣变,但伽师瓜对低温敏感,易发生冷害。Fogelman[4]和王静[5]等发现贮藏前热处理可以提高哈密瓜的耐冷性。Lim等[6]发现不同采收期的网纹哈密瓜在低温贮藏期间发生冷害的情况不同,夏季采收的哈密瓜更容易发生冷害,温度越低,冷害越严重。张婷等[7]研究发现,逐步降温处理能有效延缓及控制‘86-1’哈密瓜果实采后冷害的发生,使其保持较好的品质。伽师瓜冷害主要表现为果实表面出现凹凸不平的浅褐色小斑点,随着冷害的加重,小斑点逐渐增大,颜色变深且下陷,进而诱发腐烂[8]。因此研究伽师瓜果实采后冷害控制技术,延长伽师瓜保鲜期,已成为当前伽师瓜产业亟待解决的关键技术问题之一。
目前,对伽师瓜采后贮运的研究主要集中在考察不同贮藏期[9]、不同温度[10]和过氧化氢处理[11]对其品质和贮藏效果的影响[12],包括硬度、腐烂率和褐变指数等方面的理化指标变化,但针对伽师瓜采后低温贮藏过程中冷害相关的酶学特性研究报道较少。研究表明,果实中脂氧合酶(lipoxygenase,LOX)、脂肪酸去饱和酶(fatty acid desaturases,FADs)和三磷酸腺苷酶(adenosine triphosphatase,ATPase)在细胞膜的完整性和流动性方面起着重要的作用,而冷害发生的初始位置就是细胞膜,但在伽师瓜冷害方面关于这3 种酶的报道几乎没有。
因此本实验以新疆伽师瓜为研究对象,探讨不同贮藏温度对果实的冷害、品质指标及相关酶活力的影响,为新疆哈密瓜果实贮运保鲜提供理论依据。
1 材料与方法
1.1 材料与试剂
供试哈密瓜品种为伽师瓜,产自新疆石河子121团农场,采摘成熟度为八成熟,可溶性固形物质量分数在11%左右。
酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)试剂盒 泉州市科诺迪生物科技有限公司。
1.2 仪器与设备
TA.XT plus质构仪 英国Stable Micro Systems公司;DDS-307电导率仪 上海仪电科学仪器股份有限公司;Multifuge X1R高速冷冻离心机 赛默飞世尔科技(中国)有限公司;多功能酶标仪 美国伯腾仪器有限公司。
1.3 方法
1.3.1 样品处理与收集
大多数学者认为中晚熟哈密瓜发生冷害的温度低于3 ℃,伽师瓜属于哈密瓜的一种,因此实验设计温度分别为21.0(对照组)、3.0 ℃和0.5 ℃。选择大小均匀、无病虫害和机械损伤的伽师瓜,分别放置在3 个不同温度的冷库中,相对湿度控制在75%~85%之间。每个温度放置41 个瓜,其中20 个瓜用作理化指标(腐烂率、质量损失率和冷害指数)检测,每次测完放回原处;另外的21 个瓜,用于测定其他指标。所有指标测定均是每6 d取一次样,每次取3 个瓜作为平行,样品迅速放入液氮中速冻并转移至-80 ℃冰箱中,备用。
1.3.2 腐烂率的测定
腐烂率按照公式(1)进行计算。
1.3.3 质量损失率的测定
采用称质量法测定质量损失率。果实质量损失率计算公式如式(2)所示。
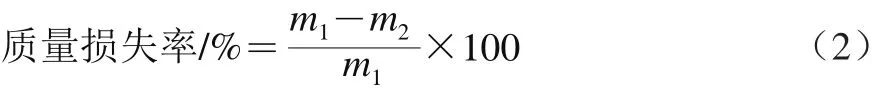
式中:m1表示初始质量/g;m2表示所测时间点的质量/g。
1.3.4 冷害指数的测定
伽师瓜果实的冷害症状包括表皮出现小斑点,凹陷、褐变[13]。果实冷害指数(chilling injury index,CII)按果实表面的凹陷及斑点面积大小分级。根据Meng Xianghong等[14]的方法测定,略有改动。使用以下标准分级,0级:未出现冷害症状;1级:冷害面积小于等于25%;2级:冷害面积在25%~50%之间;3级:冷害面积在50%~75%之间;4级:冷害面积大于等于75%。计算公式如式(3)所示。

式中:n为最高冷害级数;N为果实总个数。
1.3.5 硬度的测定
参考徐伟欣[15]的方法略作修改。将伽师瓜纵切取其中一半,再横切成薄片状,厚度约为1.5 cm,然后用1.6 cm直径的打孔器进行打孔,之后修饰成厚度约为1 cm的圆柱体,用质构仪在穿刺模式下测定其硬度,每个瓜设5 个重复,求平均值。
1.3.6 相对电导率的测定
参照陈娟等[16]的方法略有改动。用直径8 mm的打孔器对准健康伽师瓜果实中间的位置打孔,取约3 mm厚的薄片2 g,用滤纸吸取多余的水分后放入烧杯中,加入40 mL蒸馏水,在20~25 ℃恒温下放置30 min后,测电导率(P1)。然后煮沸15 min,冷却至室温,测其电导率(P2)。重复测定3 次,取平均值。计算公式如式(4)所示。

1.3.7 FADs、LOX、ATPase活力的测定
FADs、LOX、ATPase活力的测定方法参考文献[17-19],均采用ELISA试剂盒进行测定。
1.4 数据统计分析
利用Excel软件进行数据统计,Origin 8.5软件作图,SPSS 17.0软件的方差分析法进行差异显著性检验,P<0.05表示差异显著。
2 结果与分析
2.1 不同贮藏温度对伽师瓜腐烂率的影响
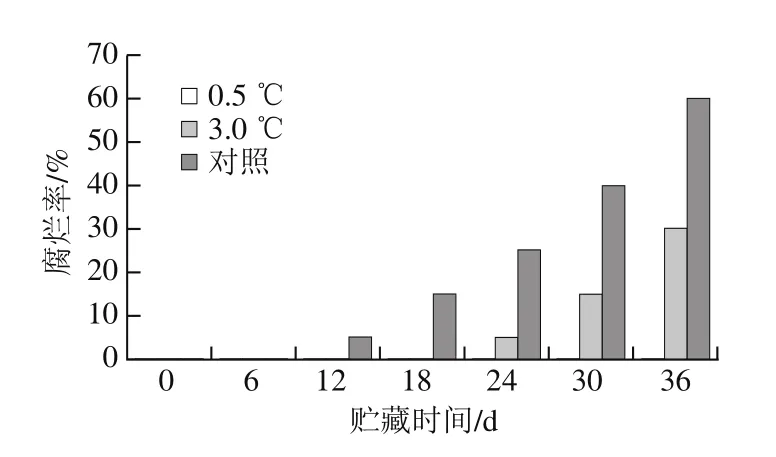
图1 不同贮藏温度对伽师瓜腐烂率的影响Fig. 1 Effects of different storage temperatures on decay incidence in Jiashi melon
对不同温度下20 个伽师瓜中腐烂的伽师瓜进行计数,求得腐烂率。如图1所示,随着贮藏时间的延长,伽师瓜腐烂率呈上升趋势。在0~12 d,只有对照组伽师瓜出现轻微的腐烂,直至第24天,3.0 ℃贮藏的伽师瓜出现轻微腐烂,整个贮藏过程中0.5 ℃伽师瓜未发生腐烂。尤其是贮藏后期伽师瓜腐烂速率加快,与对照组相比,0.5 ℃和3.0 ℃处理组伽师瓜的腐烂率相对较低。腐烂率直接反映果蔬在低温贮藏条件下的保鲜效果。3.0 ℃处理组和对照组的伽师瓜在贮藏后期腐烂率上升,可能是由于温度较高时伽师瓜代谢旺盛引起的,而0.5 ℃有效地抑制了伽师瓜新陈代谢过程。
2.2 不同贮藏温度对伽师瓜质量损失率的影响
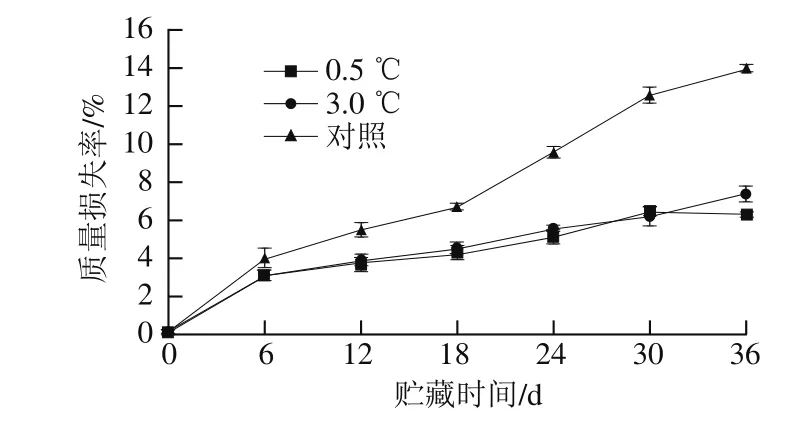
图2 不同贮藏温度对伽师瓜质量损失率的影响Fig. 2 Effects of different storage temperatures on weight loss percentage in Jiashi melon
如图2所示,随着贮藏时间的延长,伽师瓜质量损失率呈上升趋势。0.5 ℃和3.0 ℃贮藏的伽师瓜质量损失率缓慢上升,后期基本保持在6%左右,而对照组质量损失率迅速增加,最终达到12.86%,两个低温处理组与对照组之间存在显著性差异(P<0.05)。研究表明,水分损失是果实冷害发生的先兆,减少果实水分损失会减少冷害的发生[20]。21.0 ℃贮藏时伽师瓜质量损失率迅速上升可能是因为高温时果实呼吸作用较强,质量损耗较快所致。
2.3 不同贮藏温度对伽师瓜果实冷害指数的影响
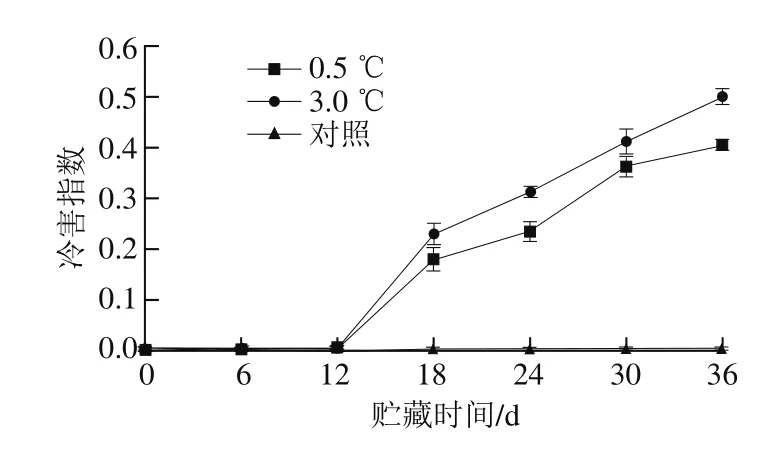
图3 不同贮藏温度对伽师瓜果实冷害指数的影响Fig. 3 Effects of different storage temperatures on chilling injury index in Jiashi melon
冷害指数能直观地反映伽师瓜冷害程度大小[21]。根据果实表面凹陷和出现斑点的面积对其冷害程度进行分级,计算冷害指数。如图3所示,随着贮藏时间的延长,伽师瓜冷害指数呈上升趋势,可能是因为果蔬的冷害程度在温度与时间上具有累积效应。贮藏初期,伽师瓜基本没有出现冷害,冷害指数无明显变化。在第12天之后,果实表面出现凹凸不平的浅褐色小斑点,冷害指数均快速上升,明显高于对照组,这与张婷等[8]报道的结果基本一致。两个处理组与对照组相比,差异显著(P<0.05),而0.5 ℃与3.0 ℃贮藏的伽师瓜相比,冷害指数明显较低,可能是因为0.5 ℃更利于伽师瓜的贮藏。对照组的伽师瓜没有出现冷害,但果实质量损失率较大,腐烂严重。
2.4 不同贮藏温度对伽师瓜果实硬度的影响
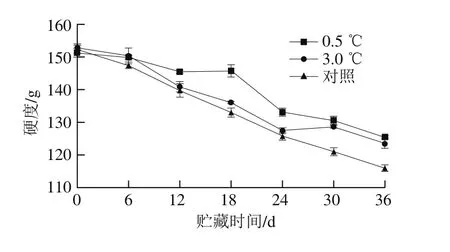
图4 不同贮藏温度对伽师瓜果实硬度的影响Fig. 4 Effects of different storage temperatures on hardness of Jiashi melon
如图4所示,伽师瓜在贮藏前硬度最高,随着贮藏时间的延长,硬度不断下降。这是由于果胶物质在贮藏过程中不断被果胶酶水解造成的。果胶酶活力越低,果胶物质水解速率越慢,果实软化速率也越慢[22]。在整个贮藏过程中,0.5 ℃贮藏的伽师瓜硬度下降较为平缓,3.0 ℃贮藏下降较快,从贮藏前152.75 g下降至贮藏结束时的123.49 g,下降了19.16%,且0.5 ℃处理组伽师瓜果实的硬度在贮藏过程中始终高于3.0 ℃处理组;可能是因为伽师瓜在3.0 ℃时发生的冷害更严重,水分散失较多,所以硬度较低。而对照组前期硬度下降平缓,后期下降较快,可能与贮藏后期果实腐烂有关。差异显著性分析结果表明,不同贮藏温度下伽师瓜果实硬度存在显著性差异(P<0.05)。
2.5 不同贮藏温度对伽师瓜果实相对电导率的影响
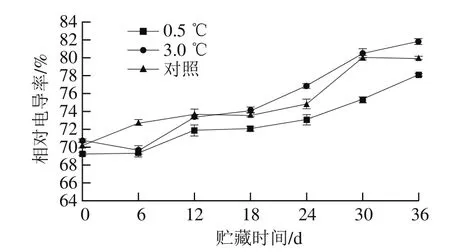
图5 不同贮藏温度对伽师瓜果实相对电导率的影响Fig. 5 Effects of different storage temperatures on relative conductivity of Jiashi melon
如图5所示,随着贮藏时间的延长,伽师瓜相对电导率呈上升趋势。0~12 d,冷害现象不明显,0.5 ℃和3.0 ℃贮藏的伽师瓜的相对电导率基本保持在70%左右,贮藏18 d后,两组的相对电导率逐渐增大;可能是因为冷敏感型植物在低温胁迫下易发生冷害,导致细胞膜发生相变,膜通透性增大,大量离子发生渗漏,从而使相对电导率增大[23]。3.0 ℃贮藏条件下伽师瓜的相对电导率高于0.5 ℃,可能是因为0.5 ℃处理组出现冷害的时间较晚,且没有3.0 ℃处理组伽师瓜的严重。对照组伽师瓜的相对电导率在后期上升可能是因为其在后期腐烂加重,衰老加速,细胞膜受损严重。
2.6 不同贮藏温度对伽师瓜果实FADs活力的影响
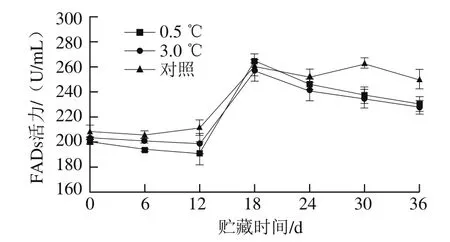
图6 不同贮藏温度对伽师瓜果实FADs活力的影响Fig. 6 Effects of different storage temperatures on FADs activity of Jiashi melon
如图6所示,随着贮藏时间的延长,伽师瓜中FADs活力呈先上升后下降的趋势。贮藏前期,冷害现象不明显,伽师瓜果实FADs活力变化较小。贮藏至18 d,果实中FADs活力达到峰值,0.5 ℃处理组伽师瓜果实的FADs活力高于3.0 ℃处理组,与前面0.5 ℃处理组果实的冷害指数低于3.0 ℃的刚好相反。因为FADs催化不饱和脂肪酸的生物合成,影响植物生长发育进程,参与生物和非生物胁迫,是参与细胞适应冷应激的关键酶,FADs活力越高,果蔬耐冷性越强,相对应的冷害指数越低[24]。
2.7 不同贮藏温度对伽师瓜果实LOX活力的影响
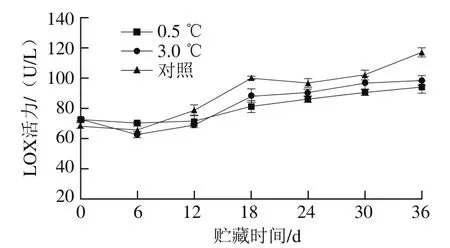
图7 不同贮藏温度对伽师瓜果实LOX活力的影响Fig. 7 Effects of different storage temperatures on LOX activity of Jiashi melon
如图7所示,随着贮藏时间的延长,伽师瓜中LOX活力总体呈上升趋势。贮藏前期,低温可以延缓果实衰老,LOX活力相对较低。贮藏后期,冷害加重,膜脂过氧化加剧,细胞膜受损严重,导致0.5 ℃和3.0 ℃贮藏的伽师瓜果实的LOX活力大幅度增加,且0.5 ℃处理组伽师瓜果实的LOX活力低于3.0 ℃,差异显著(P<0.05)。可能是因为LOX活力的高低反映了果蔬在冷胁迫下膜脂过氧化程度,LOX活力越高,膜脂过氧化程度越严重,果实细胞膜透性越大,冷害越严重[25]。贮藏后期,对照组伽师瓜果实的LOX活力高于其他两个处理组,是因为常温下果实质量损失较多,软化衰老较快,导致细胞膜受损,故LOX活力较高。
2.8 不同贮藏温度对伽师瓜果实ATPase活力的影响

图8 不同贮藏温度对伽师瓜果实ATPase活力的影响Fig. 8 Effects of different storage temperatures on ATPase activity of Jiashi melon
如图8所示,随着贮藏时间的延长,伽师瓜中ATPase活力呈先上升后下降趋势。在0~12 d,伽师瓜果实出现轻微的冷害,ATPase活力变化较小。12~30 d,ATPase活力随着低温损伤的加重而逐渐上升,第30天,伽师瓜果实ATPase活力达到峰值,其中0.5 ℃处理组ATPase活力最高,3.0 ℃处理组次之,对照组最低,分别为90.82、83.91、76.60 U/mL。贮藏后期,与对照组相比,其他两组伽师瓜果实的ATPase活力明显较高,0.5 ℃处理组较3.0 ℃处理组的ATPase活力高,差异显著(P<0.05)。可能是因为低温贮藏期间为维持呼吸等代谢活力ATP的消耗增大,使得ATPase活力增强,后期ATPase活力下降是因为随着果实贮藏时间的延长,后熟衰老使得ATP的合成减少,所以ATPase活力也降低。
3 讨 论
果蔬通过低温贮藏降低呼吸速率和抑制真菌的生长来延长采后贮藏期,保持其品质。但热带和亚热带果蔬对低温敏感,易发生冷害,对果蔬产生不良影响,如不正常的软化、凹陷和褐变,本实验的研究结果与上述报道基本一致。此外,随着低温贮藏时间的延长,冷害程度进一步加剧,使得果蔬品质下降。本实验中,0.5 ℃和3.0 ℃贮藏的伽师瓜与对照组相比,品质保持得较好,冷害指数和相对电导率明显低于对照组,但0.5 ℃条件下贮藏的伽师瓜品质更好。说明低温可以有效地延长伽师瓜的贮藏期。
相关研究表明,果实发生冷害主要与细胞膜的完整性和流动性密切相关。当果蔬处于冷胁迫下时,除果蔬体内存在的抗氧化酶防御体系发挥作用外,还有一些酶通过改变其活力大小来提高果蔬的抗寒性,如FADs、LOX和ATPase。冷害使植物细胞膜由液晶相过渡到凝胶相,细胞膜的流动性降低,离子渗漏,最终使得细胞死亡,发生冷害[26]。不饱和脂肪酸在调节膜的流动性使植物适应不同的逆境条件方面起着重要的作用,而FADs是不饱和脂肪酸合成途径的关键酶,是一组负责增加膜不饱和度的酶。植物应对低温时,FADs活力增强;不饱和度越高,植物抗寒性越强[27];也有相关证据表明FADs是通过调节不饱和脂肪酸水平来增大细胞膜的流动性,从而提高植物的耐冷性[28];因此,FADs活力越高,果蔬抗寒性越高。本研究中,贮藏后期0.5 ℃处理组伽师瓜果实的FADs活力始终高于3.0 ℃处理组,且贮藏末期低温处理组好果率明显高于对照组。
LOX作为脂氧合酶生物合成路径的第一个酶,在植物发育的不同阶段有调控功能[29],其与果蔬细胞脂质过氧化、后熟衰老过程的启动和逆境胁迫信号的产生和识别有密切关系[30],其代谢产物中的活性氧和氧自由基对细胞膜有破坏作用[31]。伽师瓜果实在贮藏后期LOX活力大幅度增加,此时也是果实的快速衰老期,随着贮藏时间的延长,逐渐达到峰值,说明此酶与果蔬软化衰老的启动有关,而冷害是衰老的一种体现。刚采收的伽师瓜果实LOX活力较高,这可能与采收时的气温有关,随果温的下降,酶活力降低。随着贮藏时间的延长,对照组伽师瓜果实进入快速软化衰老阶段,LOX活力逐渐增大。而0.5 ℃和3.0 ℃贮藏的伽师瓜因为冷害的加重,LOX活力随贮藏时间的延长而逐渐增大,且0.5 ℃伽师瓜果实LOX活力始终低于其他两组;说明低温处理可以有效抑制LOX活力,延缓果实衰老,延长贮藏期[32]。
相关研究表明,高水平的三磷酸腺苷(adenosine triphosphate,ATP)和能量消耗有利于维持膜的完整性,进而提高芒果果实在低温冷藏期间的耐冷性[33]。并且提高与能量相关的代谢酶(包括ATPase、琥珀酸脱氢酶、细胞色素c氧化酶)的活力,使得ATP含量增高,降低了山竹发生冷害的几率[34]。随着贮藏时间的延长,冷害加剧,ATPase活力整体呈先上升后下降的趋势。贮藏后期,与对照组相比,低温处理组ATPase活力更高,尤其是0.5 ℃处理组,其保持了较好的品质。由此可推测低温贮藏期间果实为维持呼吸等代谢活动大量消耗ATP,ATPase活力显著增强,活力增强幅度与温度有关,温度越低增幅越大;说明果蔬在低温胁迫下通过提高ATPase活力增强对逆境的抗性,从而延缓果蔬的衰老,延长贮藏期,这与王艳娜[35]和Kawamura[36]等的研究结果一致。因此保持较高水平的代谢酶活力去提供充足的能量是冷胁迫下细胞存活的关键。
综上所述,低温贮藏可以缓解伽师瓜果实的衰老速率,使其保持较好的好果率,延长其贮藏期,根据酶活力的变化,推测FADS、ATPase和LOX的活力变化可能与伽师瓜抗寒性相关。
参考文献:
[1] 李鹏飞. 温光对厚皮甜瓜生长发育及产量和品质的影响[D]. 杨凌:西北农林科技大学, 2010: 1-3.
[2] 刘同业, 张婷, 车凤斌, 等. 不同贮藏温度下西州密25号哈密瓜果实冷害生理的研究[J]. 新疆农业科学, 2015, 52(1): 26-32. DOI:10.6048/j.issn.1001-4330.2015.01.005.
[3] 朱赛赛, 张敏. 温度激化处理对采后果蔬贮藏品质影响的研究进展[J].食品科学, 2016, 37(5): 230-238. DOI:10.7506/spkx1002-6630-201605041.
[4] FOGELMAN E, KAPLAN A, TANAMI Z, et al. Antioxidative activity associated with chilling injury tolerance of muskmelon (Cucumis melo L.) rind[J]. Scientia Horticulturae, 2011, 128(3): 267-273.DOI:10.1016 / j.scienta.2011.01.034.
[5] 王静, 茅林春, 李学文, 等. 热处理降低哈密瓜果实活性氧代谢减轻冷害[J]. 农业工程学报, 2016, 32(2): 280-286. DOI:10.11975/j.issn.1002-6819.2016.02.040.
[6] LIM B S, HONG S J, OH S H, et al. Effect of storage temperature on chilling injury and fruit quality of muskmelon[J]. Korean Journal of Horticultural Science & Technology, 2010, 28(2): 248-253.
[7] 张婷, 车凤斌, 潘俨, 等. 逐步降温对哈密瓜果实采后冷害、品质及内源激素的影响[J]. 西北农林科技大学学报(自然科学版), 2016,44(12): 143-149. DOI:10.13207/j.cnki.jnwafu.2016.12.0120.
[8] 张婷, 车凤斌, 吴忠红, 等. 逐步降温处理对“86-1”哈密瓜果实采后冷害及内源多胺含量的影响[J]. 食品工业科技, 2015, 36(22): 350-353; 361. DOI:10.13386/j.issn1002-0306.2015.22.063.
[9] 谭政, 唐忠建. 不同温度及不同贮藏期对伽师瓜果实品质的影响[J].北方园艺, 2013(21): 150-152.
[10] 车凤斌, 艾尔麦克, 李萍, 等. 伽师瓜贮藏温度试验小结[J]. 新疆农业科学, 2010, 47(1): 98-103. DOI:10.6048/j.issn.1001-4330.2010.01. 018.
[11] 郭殿卿, 冯作山, 吴婧婧, 等. 采后过氧化氢处理对伽师瓜贮藏品质的影响[J]. 食品科学, 2012, 33(22): 324-327.
[12] 张有林, 张润光, 孙刚, 等. 伽师瓜采后生理、贮期病害及贮藏保鲜技术[J]. 中国农业科学, 2010, 43(6): 1220-1228. DOI:10.3864/j.issn.0578-1752.2010.06. 015.
[13] YU F, SHAO X F, YU L N, et al. Proteomic analysis of postharvest peach fruit subjected to chilling stress or non-chilling stress temperatures during storage[J]. Scientia Horticulturae, 2015, 197:72-89. DOI:10.1016/j.scienta.2015.10.045.
[14] MENG Xianghong, HAN Jin, WANG Qing, et al. Changes in physiology and quality of peach fruits treated by methyl jasmonate under low temperature stress[J]. Food Chemistry, 2009, 114(3): 1028-1035. DOI:10.1016/j.foodchem.2008.09.109.
[15] 徐伟欣. 甜瓜种质资源果实质构评价及其相关酶基因的表达分析[D].天津: 天津大学, 2014: 21-25.
[16] 陈娟, 张婷, 车凤斌, 等. NO处理对哈密瓜果实采后冷害及渗透调节物质的影响[J]. 新疆农业科学, 2015, 52(12): 2238-2244.DOI:10.6048/j.issn.1001-4330.2015.12.012.
[17] 张黎凤, 马天文, 曹海艳. ELISA法在植物检测中的应用研究及改进措施[J]. 现代农业科技, 2016(24): 137-138.
[18] 李会容, 赵昶灵, 杨焕文, 等. 高等植物脂氧合酶活性测定方法的研究进展[J]. 中国农学通报, 2011, 27(15): 217-223.
[19] 冯劲立, 沈海蓉, 李想, 等. 防己黄芪汤对复合造模肝纤维化小鼠肝线粒体过氧化损伤的影响[J]. 中药新药与临床药理, 2010, 21(5):506-508.
[20] COHEN E, SHAPIRO B, SHALOM Y, et al. Water loss: a nondestructive indicator of enhanced cell membrane permeability of chilling-injured citrus fruit[J]. Journal of the American Society for Horticulturalence, 1994, 119(5): 983-986.
[21] 乔勇进, 王梦晗, 王凯晨, 等. 酵母多糖处理提高樱桃番茄抗冷性的机制分析[J]. 食品科学, 2016, 37(10): 240-245. DOI:10.7506/spkx1002-6630-201610041.
[22] 户金鸽, 廖新福, 孙玉萍, 等. 不同成熟度哈密瓜采后生理和品质的变化[J]. 中国瓜菜, 2011, 24(3): 10-15. DOI:10.3969/j.issn.1673-2871.2011.03.003.
[23] DONG J F, YU Q, LU L, et al. Effect of yeast saccharide treatment on nitric oxide accumulation and chilling injury in cucumber fruit during cold storage[J]. Postharvest Biology and Technology, 2012, 68: 1-7.DOI:10.1016/j.postharvbio.2012.01.005.
[24] MIRONOV K S, SIDOROV R A, TROFIMOVA M S, et al. Lightdependent cold-induced fatty acid unsaturation, changes in membrane fluidity, and alterations in gene expression in Synechocystis[J].Biochimica et Biophysica Acta, 2012, 1817(8): 1352-1359.DOI:10.1016/j.bbabio.2011.12.011.
[25] 高慧. 油桃果实冷害及冷害生理机制研究[D]. 杨凌: 西北农林科技大学, 2007: 40-45.
[26] AGHDAM M S, SEVILLANO L, FOLRES F B, et al. Heat shock proteins as biochemical markers for postharvest chilling stress in fruits and vegetables[J]. Scientia Horticulturae, 2013, 160: 54-64.DOI:10.1016/j.scienta.2013.05. 020.
[27] HERNÁNDEZ M L, PADILLA M N, SICARDO M D, et al. Effect of different environmental stresses on the expression of oleate desaturase genes and fatty acid composition in olive fruit[J]. Phytochemistry,2011, 72(2/3): 178-187. DOI:10.1016/j.phytochem.2010.11. 026.
[28] UPCHURCH R G. Fatty acid unsaturation, mobilization, and regulation in the response of plants to stress[J]. Biotechnology Letters,2008, 30(6): 967-977. DOI:10.1007 / s10529-008-9639-z.
[29] SHAHANDASHTI S S K, AMIRI R M, ZEINALI H, et al. Change in membrane fatty acid compositions and cold-induced responses in chickpea[J]. Molecular Biology Reports, 2013, 40(2): 893-903.DOI:10.1007/s11033-012-2130-x.
[30] KOLOMIETS M V, CHEN H, GLADON R J, et al. A leaf lipoxygenase of potato induced specifically by pathogen infection[J].Plant Physiology, 2000, 124(3): 1121-1130.
[31] AGHDAM M S, NADERI R, JANNATIZADEH A, et al.Enhancement of postharvest chilling tolerance of anthurium cut flowers by γ-aminobutyric acid (GABA) treatments[J]. Scientia Horticulturae, 2016, 198: 52-60. DOI:10.1016/j.scienta.2015.11.019.
[32] 田寿乐, 周俊义. 不同贮藏温度与鲜枣果实中保护酶及脂氧合酶活性变化的关系[J]. 河北农业大学学报, 2006, 29(1): 46-49.DOI:10.3969/j.issn.1000-1573.2006.01. 013.
[33] LI P Y, ZHENG X L, LIU Y, et al. Pre-storage application of oxalic acid alleviates chilling injury in mango fruit by modulating proline metabolism and energy status under chilling stress[J]. Food Chemistry,2014, 142(2): 72-78. DOI:10.1016/j.foodchem.2013.06. 132.
[34] LIU Z L, LI L, LUO Z S, et al. Effect of brassinolide on energy status and proline metabolism in postharvest bamboo shoot during chilling stress[J]. Postharvest Biology & Technology, 2016, 111: 240-246.DOI:10.1016/j.postharvbio.2015.09.016.
[35] 王艳娜, 王贵禧, 梁丽松, 等. 低温及轮纹病菌胁迫对鸭梨果肉ATP含量及H+-ATPase、Ca2+-ATPase活性的影响[J]. 林业科学, 2008,44(12): 72-76. DOI:10.3321/j.issn:1001-7488.2008.12.013.
[36] KAWAMURA Y, UEMURA M. Mass spectrometric approach for identifying putative plasma membrane proteins of Arabidopsis leaves associated with cold acclimation[J]. The Plant Journal, 2003, 36(2): 141-154.
——伽师瓜

