大蒜精油和发酵剂对熏马肠中生物胺及微生物分布的影响
李彬彬,张雅晴,赵利利,毛 顺,卢士玲*
熏马肠是新疆哈萨克民族特色的传统肉类制品,是一种营养丰富、蛋白质含量极高、脂肪含量少但多不饱和脂肪酸所占比例高的发酵肉制品。熏马肠作为优质独特的功能性食品,具有很好的销售前景,但由于其在加工成熟及贮藏过程中产生的生物胺累积,造成了一定的食品安全隐患[1]。
食物中存在生物胺的累积现象,主要可能由于十分充足的前体物质的存在,还有许多含有氨基酸脱羧酶基因的细菌以及能够促进其生长并且对脱羧酶活性有促进作用的环境因素造成[2]。在所有胺类化合物中,组胺和酪胺被确认毒理作用最强。当它们作用于机体时,会对人类的精神状态、血管活性造成影响,甚至导致严重的毒性反应[3]。此外生物胺具有良好的热稳定性,食品加工和制备过程中的高温对其破坏力有限,目前只能通过预防和监测的方式来有效控制生物胺在食品加工中的形成从而延长食品链[4]。
据目前大量研究结果来看,发酵剂对发酵香肠中生物胺的产生具有良好的控制作用[5],如乳酸菌和凝固酶阴性葡萄球菌[6]。乳酸菌在原料肉中数量极低(3~4(lg(CFU/g))),但它能够在很短时间内提高乳酸菌的数量,使其在发酵初期成为熏马肠中的优势菌株(8(lg(CFU/g))),葡萄球菌能够在发酵过程中分解原料形成风味化合物[7]。乳酸菌分解产生大量乳酸或有机酸导致pH值在短时间内快速降低,抑制了腐败微生物的生长,从而减少生物胺的积累[8]。添加香辛料和天然植物提取物对原料肉进行腌制[9],也是目前控制生物胺产生的重要途径,它能够使熏马肠中的初始微生物的数量和种类得到有效控制。
微生物宏基因组分类测序是根据对被检样品中微环境的基因序列实施检测,能够高效准确地辨别其中微生态物种的类别以及相对丰度。宏基因组学目前已被广泛应用到发酵制品的发酵加工过程中,对微生物多样性和动态进行研究。新疆熏马肠发酵成熟时期涉及多菌种共同作用,分化发酵肉中微生物种类以及在各时期的变化规律和机理,对于深入研究其发酵机理和构建发酵时期的监测手段和控制途径具有举足轻重的意义。本实验将利用宏基因组学的方法对熏马肠发酵成熟时期的细菌群落的构成和多样性进行详细监测,旨在为发酵剂和大蒜精油对熏马肠发酵成熟过程中优势菌群的发掘和腐败微生物的抑制提供一定的理论依据。
1 材料与方法
1.1 菌株、材料与试剂
屎肠球菌(Enterococcus faecium)KT923202、粪肠球菌(E. faecalis)KT923193均为本实验室从熏马肠中分离筛选。
马肉购自石河子牧民家庭;辅料(天然动物肠衣、食盐、烟熏液)均为市售。
改良后的甘露醇高盐琼脂培养基(manitol salt agar,MSA)、结晶紫中性红胆盐琼脂培养基(violet red bile agar,VRBA)、MRS培养基 北京奥博星生物试剂公司;发酵剂 科汉森菌种有限公司;大蒜精油仲景大厨房股份有限公司。
1.2 仪器与设备
甲醇、乙腈(均为色谱纯) 天津福晨化学试剂厂;生物胺标准品(色胺、苯乙胺、腐胺、尸胺、组胺、酪胺、亚精胺、精胺、丹磺酰氯(dansyl chloride,DNS-Cl))美国Sigma公司。
T25型匀浆机 德国IKA公司;BagMixer 400VW型均质器 法国Interscience公司;9020-0094 KBF 240型恒温恒湿培养箱 德国Binder公司;高速冷冻离心机 美国贝克曼公司。
1.3 方法
1.3.1 新疆熏马肠的制作
配方:瘦肉80%(质量分数,下同)、肥肉20%、食盐2.5%、白糖2%、亚硝酸钠0.02%、胡椒粉0.1%、花椒粉0.15%、姜粉0.2%、味精0.1%、五香粉0.1%、八角0.1%、烟熏液1%、大蒜精油0.025%、发酵剂0.025%。
工艺流程:原料肉处理(紫外灯照射30 min)→修整、切丁(切小拇指上指尖大小)→配料→腌制(4 ℃,1 d)→接种→灌肠→发酵(18 ℃,相对湿度90%~95%,2 d)→成熟(12 ℃,相对湿度70%~75%,25 d)→成品。
分别在第0、3、7、14、21、28天取样,每次取一根,每根香肠分装成5 节,对微生物数量、水分含量、pH值测定,置于-20 ℃冷冻保藏,以备生物胺的测定。
1.3.2 实验设计
将1.3.1节处理好的原料肉均匀地分为8 组,其中4 组接种浓度约为103CFU/mL的屎肠球菌和粪肠球菌菌液作为产胺菌接种剂,另外4 组不接种产胺菌。然后在模拟发酵条件下进行熏马肠的发酵和成熟,并在发酵过程中的第0、3、7、14、21、28天分别取样,进行实验分析。
对原料马肉分别做如下处理:第1组(OJ)添加大蒜精油和接种产胺菌;第2组(CK)空白对照组;第3组(S)只添加发酵剂;第4组(SO)添加发酵剂和大蒜精油;第5组(O)只添加大蒜精油;第6组(SOJ)添加发酵剂和大蒜精油及接种产胺菌;第7组(SJ)添加发酵剂和接种产胺菌;第8组(J)接种产胺菌。每组腐败菌的接种量均约为103CFU/g。发酵剂为清酒乳杆菌和肉糖葡萄球菌,添加量为106CFU/g。
1.3.3 微生物计数
取10 g香肠,加入到90 mL无菌生理盐水中,在室温下200 r/min摇床培养30 min。然后根据微生物实验操作书上的要求进行规范操作,吸取适当浓度菌液于对应固体培养基进行均匀涂布。乳酸菌用MRS培养基,在37 ℃条件下培养72 h;葡萄球菌/微球菌用MSA培养基,37 ℃培养48 h;肠细菌用VRBA培养基,30 ℃培养48 h。
1.3.4 样品pH值测定
无菌条件下取样品20 g于180 mL灭菌生理盐水,装入无菌拍打袋中。使用拍打机,强度调至4拍打20 min,直至样品完全散开在无菌生理盐水中,上清液用pH计进行测定。
1.3.5 样品生物胺含量测定
参考文献[10]的方法,取5 g熏马肠样品加入20 mL的0.4 mol/L的高氯酸,取上述样品1 mL,加入200 μL 2 mol/L NaOH溶液使溶液呈碱性,再加入300 μL饱和NaHCO3溶液进行缓冲,然后再加入2 m L 10 mg/mL的DNS-Cl丙酮溶液,使之在黑暗条件40 ℃反应,45 min后加入100 μL的NH3·H2O终止反应,去除残留的DNS-Cl溶液。用乙腈定容到5 mL,用0.22 μm滤膜过滤后装入样品瓶待测。
色谱条件:C18色谱柱(250 mm×4.6 mm,5 μm);流动相A为水,流动相B为乙腈;流速为0.9 mL/min;进样量:20 μL;柱温:30 ℃;检测波长:254 nm。梯度洗脱程序为:0.1 min、35% A;5.0 min、25% A;44 min、0% A;55 min、35% A。1.3.6 宏基因组学测序
将8 组熏马肠发酵成熟所有时期的共41 个样品,无菌条件下取样送至华大基因测序公司进行宏基因组学测序。对样品纯度进行检测;检测合格的样品构建文库:回收目的Amplicon片段,用T4 DNA Polymerase、Klenow DNA Polymerase和T4 PNK将打断形成的黏性末端修复成平末端,再通过3’端加碱基“A”,使得DNA片段能与3’端带有“T”碱基的特殊接头连接。也可通过对具有测序接孔的双Index融合引物进行设计并合成,以DNA为模板,对PCR引物进行融合。磁珠筛选目的Amplicon片段,最后,用合格的文库进行cluster制备和测序。用下机得到的数据进行相应的生物信息分析。
下机数据经过过滤,滤除低质量的reads,剩余高质量的Clean data方可用于后期分析。通过reads之间的Overlap关系将reads拼接成Tags。在规定的一定相似度下将Tags集聚合成操作分类单元(operational taxonomic units,OTU),最后将OTU与数据库比对,对OTU进行物种注释。基于OTU和物种注释结果进行样品物种复杂度分析以及组间物种差异分析。
1.4 数据统计分析
所有数据从液相分析平台导出,用Excel 2010建立数据库,并用DPS 7.05版进行邓肯氏多重比较分析。
2 结果与分析
2.1 pH值分析
pH值的下降是熏马肠在发酵成熟过程中的一个显著变化,新鲜马肉的初始pH值为5.78。由表1可知,8 组熏马肠在发酵初期(0~3 d),pH值迅速下降,接种发酵剂组熏马肠的酸化程度要显著高于对照组的熏马肠(P<0.05),主要是由于发酵剂或接种的乳酸菌等微生物作用于内源或添加的糖等碳水化合物,使其分解为乳酸、醋酸或其他有机酸,从而导致pH值降低,pH值降低可以有效抑制杂菌的生长。因此,未接种的对照组pH值下降过程不明显,发酵结束后pH值为5.3。发酵结束后pH值下降缓慢,这是由于成熟温度为18 ℃,要低于发酵温度,导致一些微生物生长速率缓慢,产酸能力受到抑制。直到成熟期21 d,pH值开始回升,主要原因是在成熟过程中,水分蒸发流失,含氮化合物被乳酸菌利用作为能源,蛋白酶分解蛋白质产生碱性缓冲物质如生物胺的积累。在成熟结束后,各组样品的pH值大多处于4.64~4.92之间,依然能够为食品提供一个较低的酸性环境,能够很好地抑制细菌的氨基酸脱羧酶活性,从而控制生物胺的产生。Fanco等[11]报道,pH 5左右的酸性条件有利于维持发酵香肠货架期的稳定性。但这一结果要低于Lu Shiling等[9]终产品中的pH值,可能是由于所使用的马肉品质间的差异所致。通过比较分析可得,添加发酵剂组pH值下降幅度显著(P<0.05)大于未接种发酵剂组,并且在终产品中的pH值显著低于未接种发酵剂组(P<0.05);与接种发酵剂相比,添加大蒜精油对熏马肠pH值的作用效果并不明显(P>0.05),这与Bozkurt[12]的研究结果较为相似。
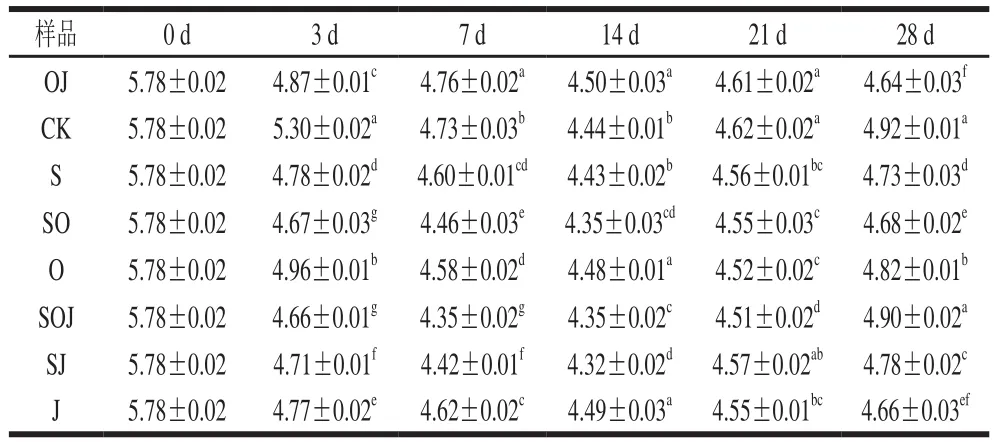
表1 新疆熏马肠在成熟过程中pH值变化情况Table 1 Change in pH during the ripening of smoked horsemeat sausages
2.2 微生物分布分析2.2.1 乳酸菌分析
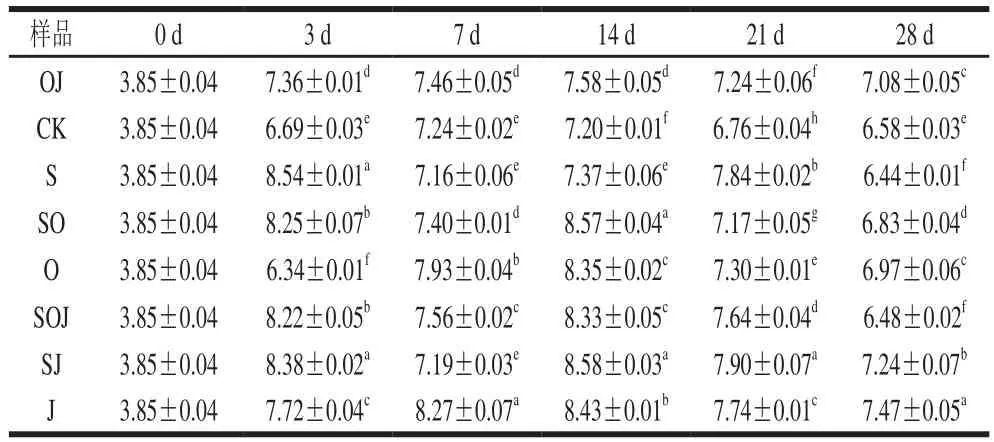
表2 新疆熏马肠在成熟过程中乳酸菌生长情况(n=6)Table 2 Growth of lactic acid bacteria during the ripening of smoked horsemeat sausages (n= 6)lg(CFU/g)
由表2可知,不同处理的样品在发酵成熟过程中乳酸菌数量存在差异。在发酵结束时(0~3 d),除CK和O组,其他香肠中的乳酸菌都迅速由原料肉中的3.85(lg(CFU/g))增长到7.36~8.38(lg(CFU/g)),通常情况下生鲜肉中的乳酸菌数量在3~4(lg(CFU/g))[13],其中接种发酵剂组的熏马肠,乳酸菌数量平均都在8.22(lg(CFU/g)),显著高于其他未接种发酵剂的熏马肠(P<0.05)。此结果与Mokhtar等[5]研究结果相比,对照组乳酸菌数量高1.587(lg(CFU/g)),接种发酵剂组平均高1.159(lg(CFU/g)),这可能是由于原料肉品质间的差异引起的,也可能是发酵剂中菌种活性不同所致。在熏马肠的整个成熟阶段,加入大蒜精油对接种产胺菌组的乳酸菌数量有一定抑制作用。在未接种发酵剂的样品中,乳酸菌依然成为了优势菌,之前许多国内外学者已有报道[14]。在成熟结束后(第28天),每组熏马肠中的乳酸菌数量在6.44~7.47(lg(CFU/g))之间,与国际上建议的乳酸菌在功能性食品中的数量范围6~8(lg(CFU/g))相符[15],说明产品具有一定的可信度。2.2.2 微球菌和葡萄球菌分析
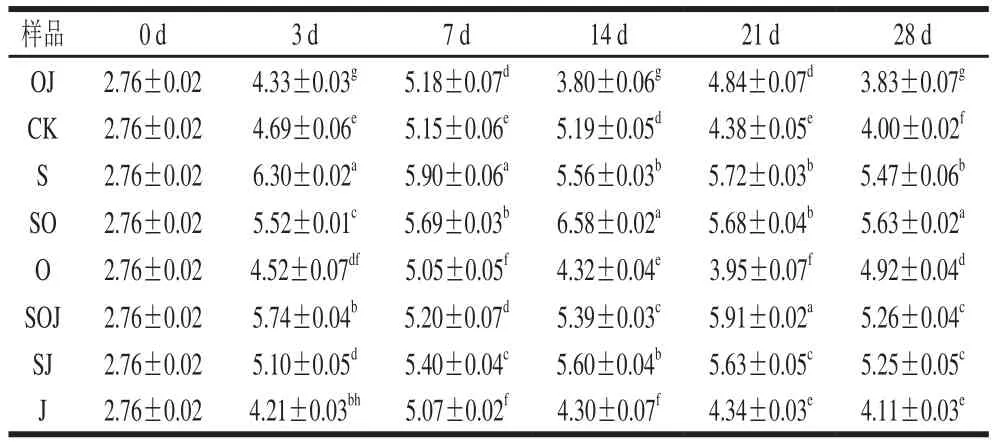
表3 新疆熏马肠在成熟过程中微球菌和葡萄球菌生长情况(n=6)Table 3 Growth of Micrococcus and Staphylococcus during the ripening of smoked horsemeat sausages (n= 6)lg(CFU/g)
由于微球菌和葡萄球菌具有解朊作用和分解脂肪活性,因此与乳酸菌一起作为发酵剂被广泛应用于发酵香肠中。为研究发酵剂和大蒜精油对微球菌和葡萄球菌数量的影响,分别对8 组熏马肠样品中检测出的微球菌和葡萄球菌数量进行统计分析及多重比较,结果见表3。接种发酵剂组的熏马肠中微球菌和葡萄球菌数量远远高于其他未接种发酵剂组(P>0.05),数量在5.5(lg(CFU/g))左右,而未接种发酵剂的熏马肠中微球菌和葡萄球菌数量在4.5(lg(CFU/g))左右,接种发酵剂组比未接种发酵剂组高1(lg(CFU/g))左右。该结果与Gücükoğlu等[16]研究接种不同发酵剂的发酵香肠在发酵结束后,微球菌和葡萄球菌数量在5.66~5.80(lg(CFU/g))相近。微球菌和葡萄球菌在发酵阶段虽然数量增长的幅度远低于乳酸菌,也可能是乳酸菌的快速产酸不利于其增殖,但接种发酵剂对微球菌和葡萄球菌的快速增殖还是有一定促进作用。到熏马肠成熟的第21天时,添加大蒜精油对添加发酵剂的熏马肠中微球菌和葡萄球菌数量没有显著抑制作用。在熏马肠终产品中,各组样品中的微球菌和葡萄球菌数量在3.83~5.63(lg(CFU/g))之间,与一些学者报道的发酵香肠中微球菌数量相近(4.1~5.9(lg(CFU/g)))[17]。
2.2.3 肠细菌分析
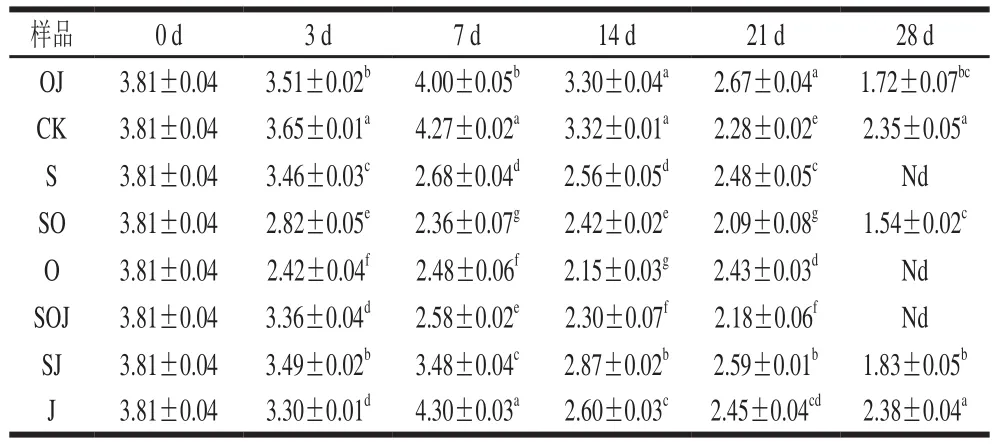
表4 熏马肠在成熟过程中肠细菌生长情况(n=6)Table 4 Growth of Enterobacteria during the ripening of smoked horsemeat sausages (n= 6)lg(CFU/g)
肠细菌比起乳酸菌、微球菌和葡萄球菌,可以说是一类不受欢迎的菌种,大量的肠细菌存在于发酵香肠时可同时产生尸胺和腐胺。其常在肉中出现,如果在不适宜的环境下加工肉制品,很可能导致致病性危害以及对发酵香肠的感官品质造成影响[18];同时它也能通过水解蛋白、分解脂肪和分解糖等作用为发酵香肠贡献芳香化合物[19]。在熏马肠成熟时期中取样检测肠细菌数量,从表4可以看出,各组在发酵结束后,肠细菌数量变化不大,添加大蒜精油组肠细菌数量显著低于未添加大蒜精油组(P<0.05)。到熏马肠成熟第7天时,肠细菌的数量出现了两种变化情况,添加大蒜精油和接种发酵剂组熏马肠中的肠细菌数量显著减少,且添加大蒜精油组比接种发酵剂组减少效果更显著(P<0.05),而其余各组熏马肠中的肠细菌数量均有一定程度的增长,说明大蒜精油对肠细菌的生长具有一定的抑制效果,而发酵剂在熏马肠成熟阶段对减少肠细菌数量上也做出一定的贡献,这与Simion等[20]研究结果相符。成熟第28天时,各组熏马肠样品中的肠细菌数量都相对较低,说明使用的原料肉符合良好的卫生标准,添加发酵剂和精油对肠细菌有显著的抑制作用,但接种发酵剂和添加大蒜精油处理组之间肠细菌数量没有显著性的差异(P>0.05)。
2.3 微生物多样性分析
通过与数据库进行比对,对OTU进行物种分类并在科分类等级对各个样品作物种分布柱状图。图1为41 个熏马肠样品在科水平中物种相对丰度柱状图,不同色块宽度表示不同物种相对丰度比例。如图1所示,在科水平上除SJ-21其他所有样品乳杆菌科(Lactobacillaceae)相对丰度占细菌类群的50%以上,其中S-3、OJ-7、O-14、SO-14的相对丰度高达90%,说明乳酸菌的确在熏马肠整个发酵成熟过程中是优势菌群。而假单胞菌科(Pseudomonadales)在SJ-21样品中占主导地位相对丰度约为60%,其次在SOJ-7中也出现一定比例,说明这两组样品在加工成熟过程中有可能受到污染,但在成熟结束时,在所有熏马肠样品中都没有发现假单胞菌的存在,可能是水分缺失,不利于其生长。由表5中可以看出,SOJ-7与同一时期其他样品相比,酪胺含量较高,达到82.40 mg/kg,而SJ-21组产生的尸胺和酪胺的含量均显著高于其他组,Li Miaoyun等[21]也证实了假单胞菌通常是腐胺、酪胺和组胺的产生菌,这与本实验所研究结论相符。除此之外,葡萄球菌科(Staphylococcaceae)在J-3、SJ-14、O-21、S-21、SO-21、OJ-28和SO-28这7 个样品中相对丰度相对较高,约为10%~20%,由此可以看出,葡萄球菌常出现在发酵肉制品的成熟后期,是为发酵香肠的风味贡献产香物质的主要菌群。Essid等[7]研究表明,葡萄球菌在发酵香肠中有两大贡献,一是酸化作用,二是反硝化作用,如脂解作用和蛋白质水解作用,同时还能生成低分子质量化合物如肽类、氨基酸等赋予发酵肉香气成分。
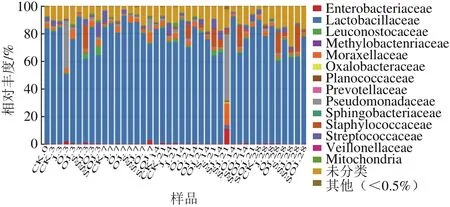
图1 样品科分类水平中物种相对丰度柱状图Fig. 1 Relative abundance of sequences assigned to families
2.4 生物胺含量分析
如表5所示,每种样品中各种生物胺数据的变化可能要结合一些能够影响生物胺产生的因素进行解释分析,如原料肉的新鲜程度和卫生质量、加工和成熟阶段引起的微生物种类和数量的变化等。
由于生物胺存在于发酵香肠对消费者健康造成潜在的威胁,因此酪胺、组胺、尸胺和腐胺已被建议作为发酵肉制品受腐败微生物污染的标志[22]。许多研究表明,尸胺和腐胺是肉制品中主要的胺类[23],虽然它们通常不被认为具有毒性作用,但是它们能够增强一些芳香族胺的毒性作用,如酪胺和组胺;此外,它们能够与一些胺氧化酶反应,从而降低氧化酶降解生物胺的活性。腐胺主要是由假单胞菌产生的,尸胺主要是由肠杆菌产生的[24]。本研究中腐胺和尸胺的结果如表5所示,在0~3 d内,两种胺的含量平均都低于50 mg/kg,腐胺含量到成熟结束也一直保持这样的水平,该值被Ladero等[25]报道作为安全限量。而在熏马肠成熟后期(第28天),与空白组相比,添加大蒜精油可使尸胺和腐胺含量减少75.50%和37.98%,接种发酵剂并添加大蒜精油可使尸胺和腐胺含量分别减少75.56%、70.34%,说明大蒜精油和发酵剂的结合使用能够大幅度抑制这两种生物胺的产生。从表5可看出,接种发酵剂的S组对腐胺的影响不是很大,但Zhang Qilin等[26]研究表明添加不产胺的乳酸菌作为发酵剂可以降低腐胺和尸胺的积累,并且能够快速产酸,抑制不受欢迎的细菌如假单胞菌和大肠杆菌等的产生。而添加大蒜精油的O和SO组腐胺产生的数量要显著低于其他组(P<0.05),说明可能是大蒜精油对鸟氨酸脱羧酶活性具有抑制作用,也可能是大蒜精油和发酵剂联合使用阻碍了腐胺的产生。

表5 新疆熏马肠中生物胺含量Table 5 Concentrations of biogenic amines in smoked horsemeat sausages mg/kg
从表5中可得,在熏马肠发酵成熟的各个时期,接种发酵剂和添加大蒜精油组(S和SO组),尸胺含量比对照组(CK)平均减少了60%以上,此结果高于Simion等[20]研究在发酵香肠仅接种发酵剂对尸胺含量的影响,结果说明尸胺的形成受发酵剂的影响较大,而将大蒜精油与发酵剂相结合,对产生尸胺的微生物起到了良好的抑制效果。朱志远[27]研究称pH值对氨基酸脱羧酶活性具有很大的影响。在熏马肠中快速降低pH值,能够抑制产胺菌的生长,特别对于肠细菌作用最显著,因此其尸胺含量也显著低于其他胺类。而接种产胺菌组对尸胺的产生影响不大,说明屎肠球菌和粪肠球菌不是主要产生尸胺的菌种。
已有大量研究表明,组胺的产生与尸胺和腐胺有关,尤其与尸胺关系更为密切,因为它们都主要由肠细菌产生[28]。从表5可以看出,各个时期的8 组熏马肠样品中组胺含量都不超过50 mg/kg,远低于一些学者提出的发酵肉制品中组胺的最低限量100 mg/kg[29]。接种发酵剂和添加大蒜精油的熏马肠中组胺的含量显著少于空白对照组(P<0.05),且在第28天时,组胺含量相较对照组减少了68.88%,说明发酵剂和大蒜精油在抑制组胺形成过程中具有一定作用。
酪胺在食物中引起中毒的剂量范围为100~800 mg/kg[30],而本实验8 组熏马肠样品只有J组在发酵结束时酪胺的含量最高为117 mg/kg,而且即使在接种发酵剂或添加大蒜精油的样品中,酪胺的含量也都在75 mg/kg以上,说明酪胺主要是由屎肠球菌和粪肠球菌等乳酸菌产生的,Pircher等[31]研究也认为,酪胺的累积通常与一些污染菌如非发酵型乳酸菌有关,特别是肠球菌属;Linares等[32]也曾报道称酪胺通常是由一些具有生物胺脱羧酶活性的乳酸菌属产生的,如弯曲乳杆菌、短乳杆菌等。高浓度的酪胺通常在发酵阶段产生,并且与Parente等[33]报道相似。在成熟第28天,接种发酵剂和添加大蒜精油的样品酪胺平均含量为30 mg/kg,而接种产胺菌组酪胺含量平均在78 mg/kg,都没超过酪胺在食品中规定的限量。
通常苯乙胺是伴随着大量的酪胺出现的[34],有些学者认为苯乙胺是有非特异活性的酪氨酸脱羧酶形成的,而Montel等[35]则报道称该胺是由肠球菌和乳酸菌(弯曲乳杆菌、屎肠球菌和粪肠球菌)产生的。由表5中可以看出,原料肉中苯乙胺的含量非常低,说明该生物胺不是内源性胺。而大量的苯乙胺的形成是在发酵结束第3天时,接种产胺菌组中的苯乙胺含量要显著高于未接种产胺菌组(P<0.05),经对比发现,大蒜精油对产胺菌产生物胺的抑制作用要优于发酵剂,而联合使用效果最佳。在Gücükoğlu等[16]研究中也证实了接种发酵剂能够阻碍苯乙胺的形成。在成熟结束后,接种产胺菌平均可产生苯乙胺39.78 mg/kg、酪胺5.35 mg/kg,只添加大蒜精油或接种发酵剂可使苯乙胺含量分别减少60.88%和68.57%,使酪胺含量分别减少61.31%和57.38%,接种发酵剂和添加大蒜精油组的熏马肠中苯乙胺含量在11.55~18.20 mg/kg之间,稍高于Gücükoğlu等[16]的研究结果,但与Bover-Cid等[36]测定的苯乙胺在发酵香肠中的含量5~45 mg/kg相近。
精胺和亚精胺是天然存在的胺类,它们会经常存在于新鲜的肉中。它们既会出现在用于制作香肠的瘦肉中,也会存在于脂肪里。并且它们受香肠成熟过程中的影响变化非常小,精胺和亚精胺的含量在加工成熟过程中几乎保持不变,甚至精胺会被某些微生物当作氮源利用导致含量降低。从表5中可以看出,所有组的熏马肠样品中精胺和亚精胺的含量都相当低,而且各组之间的差异性不显著(P>0.05),说明使用的原料肉中自身所含的精胺和亚精胺就相对较少。
3 结 论
将大蒜精油和发酵剂联合使用能够很好地减少熏马肠中尸胺、腐胺、组胺、酪胺和苯乙胺的产生,对控制生物胺在熏马肠中的含量起到非常显著的作用。添加大蒜精油可使尸胺和腐胺含量减少75.50%和37.98%;接种发酵剂并添加大蒜精油尸胺、腐胺和组胺含量平均减少75.56%、70.34%和68.88%。接种产胺菌平均可产生苯乙胺39.78 mg/kg、酪胺5.35 mg/kg;只添加大蒜精油或接种发酵剂可使苯乙胺含量分别减少60.88%和68.57%,使酪胺含量分别减少61.31%和57.38%;而复合添加物可苯乙胺和酪胺含量平均减少75.17%和63.30%。
将41 个样品进行聚类分析共产生276 个OTU,说明熏马肠中含有丰富的微生物物种,通过样品科分类水平中物种分析,得出乳酸菌在熏马肠整个加工过程都是优势菌,而葡萄球菌在成熟后期数量较多。大蒜精油对一些腐败菌如大肠杆菌、假单胞菌具有一定的抑制作用,加之发酵剂中的乳酸菌迅速产酸,从而减少了生物胺在熏马肠中的积累。
参考文献:
[1] AYHAN K, KOLSARICI N, ÖZKAN G A. The effects a starter culture on the formation of biogenic amines in Turkish soudjoucks[J]. Meat Science, 1999, 53(3): 183-188. DOI:10.1016/S0309-1740(99)00046-7.
[2] GARAI G, DUEÑAS M T, IRASTORZA A, et al. Biogenic amines in natural ciders[J]. Journal of Food Protection, 2006, 69(12): 3006-3012.
[3] SPANO G, RUSSO P, LONVAUD-FUNEL A, et al. Biogenic amines in fermented foods[J]. European Journal of Clinical Nutrition, 2010,64: 95-100. DOI:10.1038/ejcn.2010.218.
[4] ALVAREZ M A, MORENO-ARRIBAS M V. The problem of biogenic amines in fermented foods and the use of potential biogenic amine-degrading microorganisms as a solution[J]. Trends in Food Science & Technology, 2014, 39(2): 146-155. DOI:10.1016/j.tifs.2014.07.007.
[5] MOKHTAR S, MOSTAFA G, TAHA R, et al. Effect of different starter cultures on the biogenic amines production as a critical control point in fresh fermented sausages[J]. European Food Research &Technology, 2012, 235(3): 527-535. DOI:10.1007/s00217-012-1777-9.
[6] LEROY F, VERLUYTEN J, VUYST L D. Functional meat starter cultures for improved sausage fermentation[J]. International Journal of Food Microbiology, 2006, 106(3): 270-285. DOI:10.1016/j.ijfoodmicro.2005.06.027.
[7] ESSID I, HASSOUNA M. Effect of inoculation of selected Staphylococcus xylosus and Lactobacillus plantarum strains on biochemical, microbiological and textural characteristics of a Tunisian dry fermented sausage[J]. Food Control, 2013, 32(2): 707-714.
[8] LU S L, XU X L, ZHOU G H, et al. Effect of starter cultures on microbial ecosystem and biogenic amines in fermented sausage[J]. Food Control, 2010, 21(4): 444-449. DOI:10.1016/j.foodcont.2009.07.008.
[9] LU Shiling, JI Hua, WANG Qingling, et al. The effects of starter cultures and plant extracts on the biogenic amine accumulation in traditional Chinese smoked horsemeat sausages[J]. Food Control,2015, 50: 869-875. DOI:10.1016/j.foodcont.2014.08.015.
[10] 马宇霞, 卢士玲, 李开雄, 等. 熏马肠中生物胺氧化酶菌株的筛选与鉴定[J]. 现代食品科技, 2014, 30(5): 49-55. DOI:10.13982/j.mfst.1673-9078.2014.05.002.
[11] FANCO I, PRIETO B, CRUZ J M, et al. Study of the biochemical changes during the processing of Androlla, a Spanish dry-cured pork sausage[J]. Food Chemistry, 2002, 78(2): 339-345. DOI:10.1016/S0308-8146(02)00118-8.
[12] BOZKURT H. Utilization of natural antioxidants: green tea extract and Thymbra spicata oil in Turkish dry-fermented sausage[J]. Meat Science, 2006, 73(3): 442-450. DOI:10.1016/j.meatsci.2006.01.005.
[13] 卢士玲, 李开雄, 徐幸莲, 等. 传统香肠中产生物胺肠细菌和乳酸菌分离方法的研究[J]. 食品与发酵工业, 2012, 38(8): 47-52.DOI:10.13995/j.cnki.11-1802/ts.2012.08.031.
[14] ELÍAS M, CARRASCOSA A V. Characterisation of the Paio do Alentejo, a traditional Portuguese Iberian sausage, in respect to its safety[J]. Food Control, 2010, 21(1): 97-102. DOI:10.1016/j.foodcont.2009.04.004.
[15] SANTIAGO R M, ALBERTO M, MARÍA JOSÉ B, et al. Application of Lactobacillus fermentum HL57 and Pediococcus acidilactici SP979 as potential probiotics in the manufacture of traditional Iberian dryfermented sausages[J]. Food Microbiology, 2011, 28(5): 839-847.DOI:10.1016/j.fm.2011.01.006.
[16] GÜCÜKOĞLU A, ÖZLEM KÜPLÜLÜ. The effect of different starter cultures and ripening temperatures on formation of biogenic amine in Turkish fermented sausages[J]. European Food Research &Technology, 2010, 230(6): 875-884. DOI:10.1007/s00217-010-1220-z.
[17] MARTÍN A, COLÍN B, ARANDA E, et al. Characterization of Micrococcaceae isolated from Iberian dry-cured sausages[J]. Meat Science, 2007, 75(4): 696-708. DOI:10.1016/j.meatsci.2006.10.001.
[18] HUGAS M, GARRIGA M, AYMERICH M T. Functionalty of enterococci in meat products[J]. International Journal of Food Microbiology, 2003, 88: 223-233. DOI:10.1016/S0168-1605(03)00184-3.
[19] SARANTINOPOULOS P, ANDRIGHETTO C, GEORGALAKI M D, et al. Biochemical properties of enterococci relevant to their technological performance[J]. International Dairy Journal, 2001, 11(8):621-647. DOI:10.1016/S0958-6946(01)00087-5.
[20] SIMION A M C, VIZIREANU C, ALEXE P, et al. Effect of the use of selected starter cultures on some quality, safety and sensorial properties of Dacia sausage, a traditional Romanian dry-sausage variety[J]. Food Control, 2014, 35(1): 123-131. DOI:10.1016/j.foodcont.2013.06.047.
[21] LI Miaoyun, TIAN Lu, ZHAO Gaiming, et al. Formation of biogenic amines and growth of spoilage-related microorganisms in pork stored under different packaging conditions applying PCA[J]. Meat Science,2014, 96(2): 843-848. DOI:10.1016/j.meatsci.2013.09.023.
[22] IGNATENKO N A, BESSELSEN D G, ROY U K, et al. Dietary putrescine reduces the intestinal anticarcinogenic activity of sulindac in a murine model of familial adenomatous polyposis[J]. Nutrition &Cancer, 2006, 56(2): 172-181. DOI:10.1207/s15327914nc5602_8.
[23] FILIPPIS F D, PENNACCHIA C, PASQUA R D, et al. Decarboxylase gene expression and cadaverine and putrescine production by Serratia proteamaculans in vitro and in beef[J]. International Journal of Food Microbiology, 2013, 165(3): 332-338. DOI:10.1016/j.ijfoodmicro.2013.05.021.
[24] HALÁSZ A, BARÁTH Á, SIMON-SARKADI L, et al. Biogenic amines and their production by microorganisms in food[J]. Trends in Food Science and Technology, 1994, 5(94): 42-49. DOI:10.1016/0924-2244(94)90070-1.
[25] LADERO V, CALLES-ENRÍQUEZ M, FERNÁNDEZ M,et al. Toxicological effects of dietary biogenic amines[J].Current Nutrition & Food Science, 2010, 6(2): 145-156.DOI:10.2174/157340110791233256.
[26] ZHANG Qilin, LIN Shenglin, NIE Xiaohua. Reduction of biogenic amine accumulation in silver carp sausage by an amine-negative Lactobacillus plantarum[J]. Food Control, 2013, 32(2): 496-500.DOI:10.1016/j.foodcont.2013.01.029.
[27] 朱志远. 发酵剂对发酵香肠生物胺含量及理化品质的影响研究[D].南京: 南京农业大学, 2009: 18-20. DOI:10.7666/d.Y1762735.
[28] WÖHRL S, HEMMER W, FOCKE M, et al. Histamine intolerancelike symptoms in healthy volunteers after oral provocation with liquid histamine[J]. Allergy and Asthma Proceedings, 2004, 25(5): 305-311.[29] RAUSCHER-GABERNIG E, GROSSGUT R, BAUER F, et al.Assessment of alimentary histamine exposure of consumers in Austria and development of tolerable levels in typical foods[J]. Food Control,2009, 20(4): 423-429. DOI:10.1016/j.foodcont.2008.07.011.
[30] VIDAL-CAROU M C, IZQUIERDO-PULIDO M L, MARTÍNMORRO M C, et al. Histamine and tyramine in meat products:relationship with meat spoilage[J]. Food Chemistry, 1990, 37(4): 239-249. DOI:10.1016/0308-8146(90)90104-C.
[31] PIRCHER A, BAUER F, PAULSEN P. Formation of cadaverine,histamine, putrescine and tyramine by bacteria isolated from meat,fermented sausages and cheeses[J]. European Food Research &Technology, 2007, 226(1/2): 225-231. DOI:10.1007/s00217-006-0530-7.
[32] LINARES D M, DEL RÍO B, LADERO V, et al. Factors influencing biogenic amines accumulation in dairy products[J]. Frontiers in Microbiology, 2012, 3: 180. DOI:10.3389/fmicb.2012.00180.
[33] PARENTE E, MARTUSCELLI M, GARDINI F, et al. Evolution of microbial populations and biogenic amine production in drysausages produced in Southern Italy[J]. Journal of Applied Microbiology, 2001,90(6): 882-891. DOI:10.1016/0008-6215(96)00070-5.
[34] KURT S, ZORBA O. Biogenic amine formation in Turkish dry fermented sausage (sucuk) as affected by nisin and nitrite[J]. Journal of the Science of Food & Agriculture, 2010, 90(15): 2669-2674.DOI:10.1002/jsfa.4138.
[35] MONTEL M C, MASSON F, TALON R. Comparison of biogenic amine content in traditional and industrial French dry sausages[J].Sciences des Aliments, 1999, 19(2): 247-254.
[36] BOVER-CID S, IZQUIERDO-PULIDO M, VIDAL-CAROU M C.Mixed starter cultures to control biogenic amine production in dry fermented sausages[J]. Journal of Food Protection, 2000, 63(11):1556-1562. DOI:10.4315/0362-028X-63.11.1556.

