苯并噻二唑处理对柑橘果实采后病害控制效果及机制分析
刘晓佳,薛耀碧,周雅涵,姚世响,邓丽莉,2,曾凯芳,2,*
柑橘是世界第一大类水果,因其营养丰富、色香味兼优而深受消费者喜爱。然而,柑橘果实在采后贮藏、运输过程中容易受病原菌侵染而发生霉变、腐烂现象,给柑橘产业造成巨大经济损失。其中,青霉病、绿霉病、炭疽病、酸腐病、蒂腐病是柑橘果实采后最为普遍和最严重的侵染性病害。目前,人们对于柑橘果实采后侵染性病害最为主要的控制手段是使用化学杀菌剂,但化学杀菌剂的长期大量使用会引发病原菌抗药性、控病效果下降、农残超标、环境污染等一系列问题[1-3]。因此,寻求一种新型的、安全的、可替代或减少化学杀菌剂的病害防治方法十分必要。近年来,利用诱抗剂诱导植物自身产生抗病性成为果蔬采后控制病害研究的热点[4-6]。苯并噻二唑(benzothiadiazole,BTH)是其中一种,它在离体条件下并无杀菌作用,但可以诱导植物产生抗病性[7]。目前BTH在植物控病方面应用较多,但在采后果蔬控病方面应用较少[8]。从现有的研究报道来看,BTH处理能够诱导鸭梨果实产生抗病性,有效降低了鸭梨果实采后青霉病的发生[9]。BTH处理降低了草莓果实贮藏过程中的灰霉病发病率[10]。另外,也有关于BTH处理在苹果[11]、杏[12]、甜瓜[13]等水果的抗病方面研究的报道。但BTH处理对柑橘果实采后青霉病、绿霉病、炭疽病等病害的相关研究却鲜见报道。许多研究表明,包括β-1,3葡聚糖酶(β-1,3-glucanase,GLU)、几丁质酶(chitinase,CHI)、苯丙氨酸解氨酶(phenylalanine ammonia-lyase,PAL)、过氧化物酶(peroxidase,POD)和多酚氧化酶(polyphenol oxidase,PPO)在内的一些防御酶在植物抵御病原菌侵染过程中起着重要作用[14]。内源水杨酸在植物抗病性反应中充当一个重要信号分子的角色,对植物的抗病性起着重要的作用[15-17]。因此,本实验主要采取不同浓度的BTH与柑橘青霉菌(Penicillium italicum)、绿霉菌(Penicillium digitatum)、炭疽菌(Colletotrichum gloeosporides)对柑橘果实进行同孔、异孔接种,观察BTH诱抗剂对柑橘果实青霉病、绿霉病、炭疽病的控制效果,筛选出针对这3 种病害控病效果最好的BTH浓度,在此浓度下考察两种处理方式(打孔和浸泡)对柑橘果实果皮抗病性相关酶活力和内源水杨酸含量的影响,为BTH在柑橘果实采后病害防治上的应用提供参考。
1 材料与方法
1.1 材料与试剂
实验采用‘丰脐’柑橘(Citrus sinensis L. Osbeck)果实,采自重庆北碚槽上金竹林果园。果实达到商业成熟采摘标准(固酸比为11.55±0.49)时进行人工采摘,采后直接运往实验室,挑选无病虫害、无机械伤且大小、色泽、果形和成熟度等外观品质基本一致的果实作为试材。
P. italicum、P. digitatum、C. gloeosporioides为实验室自行分离、鉴定和保存菌种。
BTH(分析纯) 美国Sigma公司。
1.2 仪器与设备
UV-1000紫外-可见分光光度计 上海天美科学仪器有限公司;SYNERGYH1MG全自动酶标仪 美国BioTeK公司;3H16R1冷冻离心机 湖南赫西仪器装备有限公司;DZKW-S-4电热恒温水浴锅 北京市永光明医疗器械厂;WH-2微型旋涡混合仪 上海沪西分析仪器有限公司;DW-FL270超低温冷冻存储箱 中科美菱低温科技有限责任公司;LC-20A高效液相色谱仪 日本岛津公司。
1.3 方法
1.3.1 病原菌培养及孢子悬浮液的制备
将病原菌接种在马铃薯葡萄糖琼脂培养基上,于25 ℃下培养7 d后(C. gloeosporioides需28 ℃下培养15 d,使病原菌长出粉红色孢子),用无菌水将孢子洗下,4 层纱布过滤,血球计数板计数,最后用无菌水将菌悬液稀释至1×104spores/mL(C. gloeosporides菌悬液浓度为1×105spores/mL),待用。
1.3.2 诱抗剂的制备
BTH用无菌水直接配制,浓度分别为0.25、0.50、1.00 mmol/L,配制过程中加入含体积分数0.01%的Tween-80。
1.3.3 果实处理
果实用体积分数2%次氯酸钠溶液浸泡2 min,进行表面消毒后,在自来水下冲洗干净并于室温(20~25 ℃)下自然晾干,然后将果实随机分成24 组(其中同孔实验12 组,异孔实验12 组),每组果实3 个,重复3 次。
1.3.4 BTH诱抗剂浓度的筛选
1.3.4.1 BTH与病原菌同孔损伤接种对柑橘果实采后青霉病、绿霉病和炭疽病的控制效果
损伤接种处理方法参照Zhou Yahan[18]和Usall[19]等方法并作适当修改。果实表面赤道部位经体积分数75%乙醇擦拭消毒后,用灭菌后的打孔器在果实赤道部位相对位置打2 个孔(深3 mm,直径6 mm)。然后按照表1所设计的实验接种30 µL诱抗剂(对照组接等量无菌水),24 h后分别在每个孔中接种相应的菌悬液30 µL。待菌液完全吸收后,用聚乙烯薄膜袋(170 mm×140 mm)将果实单果包装,于20 ℃、相对湿度80%~90%环境下贮藏。每天观察果实发病情况,果实开始发病时,每天统计病斑直径和发病率(接种C. gloeosporioides的果实开始发病时,每2 d统计一次病斑直径和发病率)。
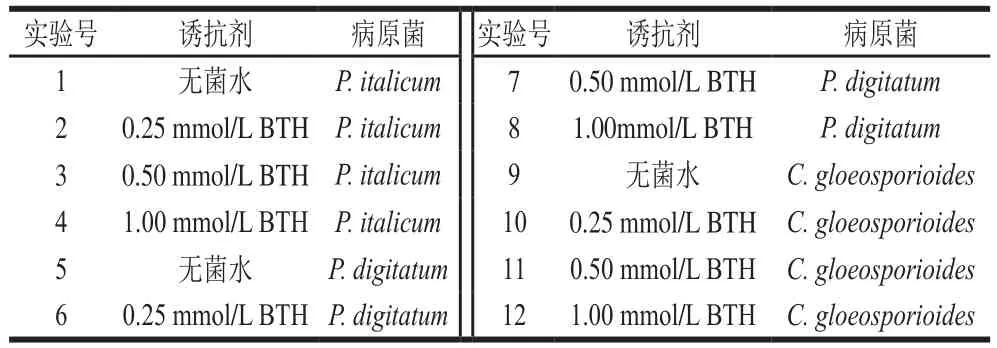
表1 BTH与P. italicum、P. digitatum、C. gloeosporioides在柑橘果实上同孔、异孔损伤接种条件Table 1 Combinations of BTH treatment and pathogen inoculation in the same and different wounds
1.3.4.2 BTH与病原菌异孔损伤接种对柑橘果实采后青霉病、绿霉病和炭疽病的控制效果
接种诱抗剂方法同1.3.4.1节。果实在接种诱抗剂24 h后在距离原孔2.5 cm处再打一个新孔(深3 mm、直径6 mm),在这个新孔内接种相应的菌悬液30 µL。菌液完全吸收后,用聚乙烯薄膜袋将果实单果包装,于20 ℃、相对湿度80%~90%环境下贮藏。每天观察果实发病情况,果实开始发病时,每天统计病斑直径和发病率(接种C. gloeosporioides的果实开始发病时每2 d统计一次病斑直径和发病率)。
1.3.5 BTH处理对柑橘果实果皮内源水杨酸和抗性相关酶活力的影响
1.3.5.1 打孔处理
样品处理及取样参照Deng Lili[20]、Tang Wanli[21]、Droby[22]等的方法并稍加修改。挑选果形均匀且大小、成熟度一致的果实,用体积分数2%次氯酸钠浸泡2 min进行表面杀菌后,再用自来水冲洗干净,室温下晾干。然后用灭菌的打孔器在果实赤道部位均匀刺6 个孔(深3 mm、直径6 mm),分别在两组果实上用微量移液器每孔接种如下液体30 μL:1)无菌水,作为对照组;2)0.50 mmol/L BTH。处理后的果实单果包装,以报纸覆盖保湿处理,于20 ℃、相对湿度85%~90%环境下贮藏,并于贮藏第0、1、2、3、4、7天取孔周围1 cm的健康果皮组织进行内源水杨酸含量和抗性相关酶活力的测定,每组取样5 个果实,重复3 次。
1.3.5.2 浸泡处理
果实分别置于1)无菌水,对照组;2)0.50 mmol/L BTH溶液中浸泡处理2 min。处理后的果实单果包装,以报纸覆盖保湿处理,于20 ℃、相对湿度85%~90%环境下贮藏,并于贮藏第0、7、14、21、28、35天取果实赤道1 cm的果皮组织进行内源水杨酸含量和抗性相关酶活力的测定,每组取样5 个果实,重复3 次。
1.3.6 指标测定
1.3.6.1 发病率的测定
发病率的测定参考Zeng Kaifang等[23]的方法,计算如式(1)所示。

1.3.6.2 病斑直径的测定
病斑直径的测定参考Qin Guozheng等[24]的方法,采用十字交叉法测量,单位为mm。
1.3.6.3 内源水杨酸含量的测定
内源水杨酸含量的测定参考Zhang Yu等[25]的方法,实验重复3 次。以鲜质量计,单位为ng/g。
1.3.6.4 抗性相关酶活力的测定
GLU、CHI、PAL、PPO和POD的提取及活力的测定均参考曾凯芳[26]的方法。GLU以每秒钟每克柑橘果皮组织(鲜质量)分解昆布多糖产生1×10-9mol葡萄糖为1 个酶活力单位(U)。CHI以每秒钟每克柑橘果皮组织(鲜质量)分解胶状几丁质产生1×10-9mol N-乙酰葡萄糖胺为1 个酶活力单位(U)。PAL以每小时每克(鲜质量)柑橘果皮组织酶促反应体系在290 nm波长处吸光度增加0.01为1 个酶活力单位(U)。PPO和POD活力单位(U)均定义为470 nm波长处吸光度变化1所需的酶量。单位均为U/g。实验重复3 次。
1.4 数据分析
所有数据统计、标准差计算以及制图均采用Excel 2013软件;数据的方差分析(ANOVA)采用SPSS 20.0软件,利用Duncan’s多重比较对数据的显著性差异进行分析,P<0.05表示差异显著。
2 结果与分析
2.1 BTH处理对柑橘果实青霉病、绿霉病、炭疽病的控制效果
2.1.1 同孔接种控制效果

图1 BTH处理对同孔接种病原菌柑橘果实病斑直径及发病率的影响Fig. 1 Effect of BTH on lesion diameters and disease incidence in citrus fruits caused by pathogens inoculated in the same wound
由图1A、B可以看出,柑橘果实青霉病病斑直径随贮藏时间延长而增大。与对照组相比(除贮藏第4天),BTH处理均明显降低了柑橘果实青霉病病斑直径(图1A)。贮藏第4天,只有对照组和0.25 mmol/L BTH处理组的柑橘果实发生了病害,二者之间对比,无显著性差异。贮藏第5天,所有处理组果实均发病,从控病效果看,0.50 mmol/L的BTH处理能明显降低果实青霉病发病率,其发病率仅为对照组果实的22.0%(图1B)。
如图1C、D所示,随贮藏时间延长,柑橘果实绿霉病的病斑直径增加。与对照组相比,不同浓度BTH处理均能降低果实绿霉病病斑直径(图1C)。贮藏第4天,所有组果实均开始发病,BTH处理组与对照组果实病斑直径存在显著性差异,但各BTH处理组之间相比,并无明显差异性。贮藏第5天,果实发病率都达到100%,从绿霉病斑直径来看,0.50 mmol/L的BTH处理控病效果最好,此时,其病斑直径仅为对照组果实的64.0%(图1D)。
由图1E、F可知,果实在贮藏第6天开始发病,除在贮藏第14天,0.25 mmol/L BTH处理与对照相比增加了果实炭疽病病斑直径外,其余BTH处理均可不同程度降低柑橘果实炭疽病病斑直径(图1E)。贮藏第6天,0.50 mmol/L的BTH处理组与其他组之间无论是病斑直径还是发病率都存在显著性差异,其病斑直径为对照组的50.0%,发病率为对照组的53.0%(图1F)。
2.1.2 异孔接种控制效果
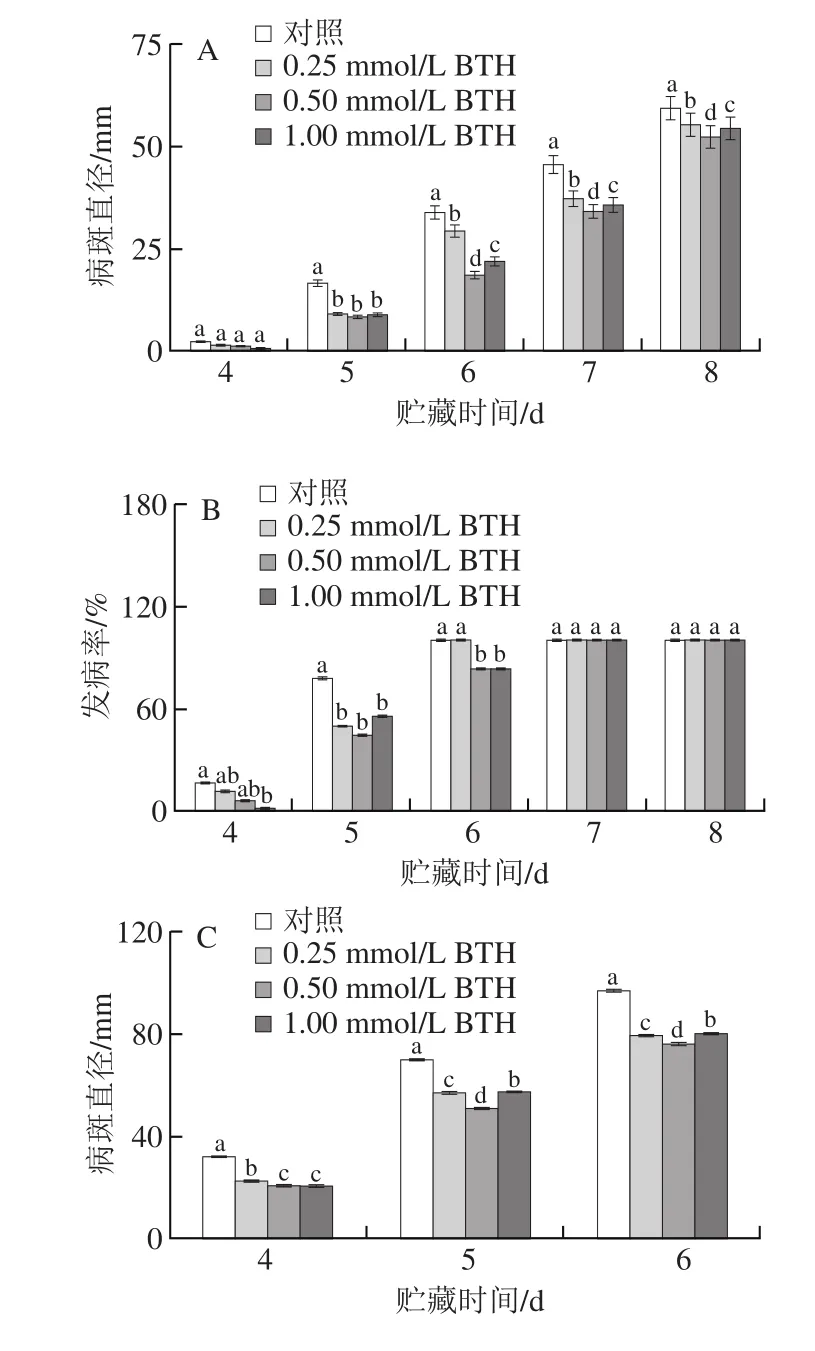
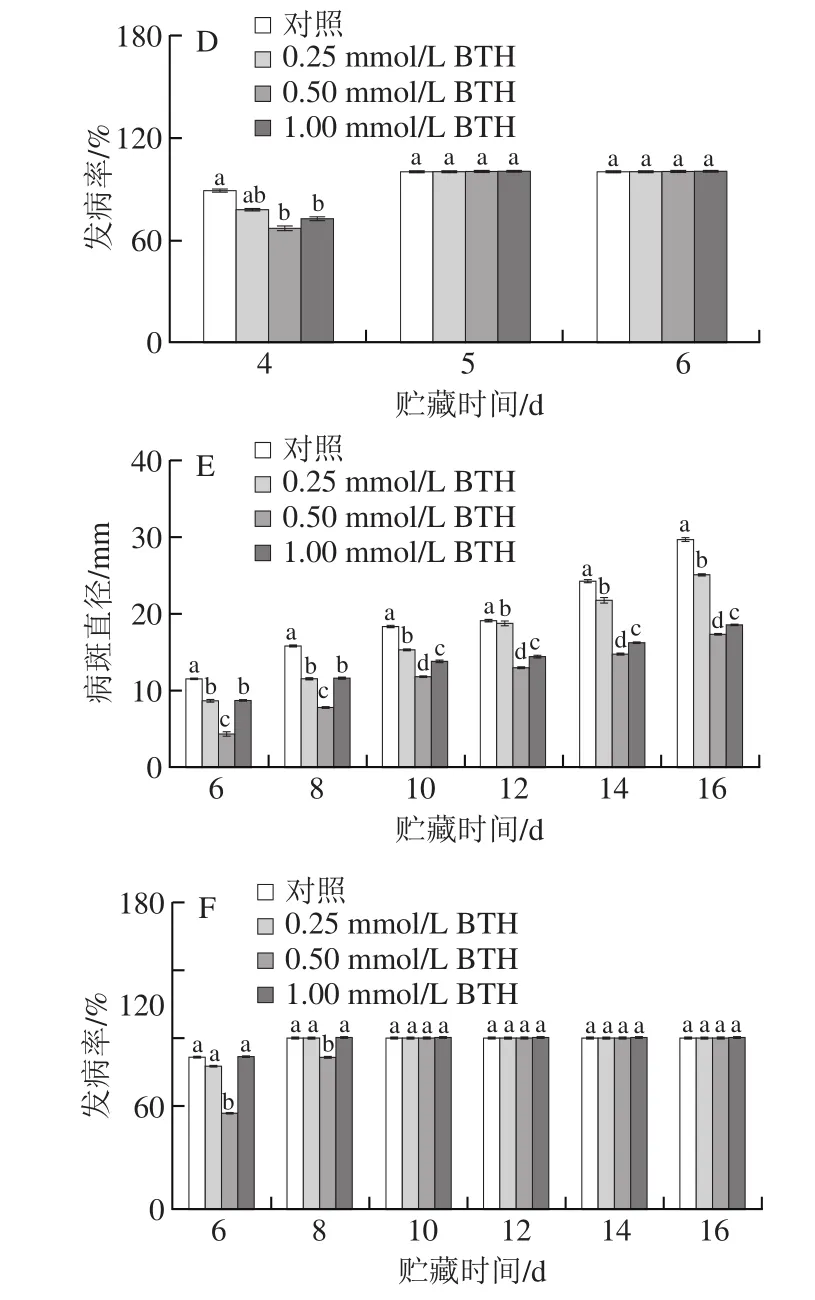
图2 BTH处理对异孔接种病原菌柑橘果实病斑直径及发病率的影响Fig. 2 Effect of BTH on lesion diameters and disease incidence of citrus fruits caused by pathogens when inoculated in the different wounds
由图2A、B可知,各组果实青霉病病斑直径随贮藏时间延长增加。贮藏第4天,除1.00 mmol/L BTH处理组的果实未发病外,其余组果实均开始发病,对照组与处理组、处理组与处理组果实病斑直径、发病率间均无显著性差异。贮藏第5天,所有浓度的BTH处理均明显降低了果实的青霉病病斑直径和发病率,但不同浓度BTH处理组间并无差异性。贮藏第6天,0.50 mmol/L的BTH处理显著降低了果实青霉病病斑直径。
由图2C、D可知,不同浓度的BTH处理均能降低柑橘果实绿霉病的病斑直径。贮藏第5天,0.50 mmol/L的BTH处理很好地控制了果实绿霉生长,其病斑直径为对照组的72.7%。
如图2E、F所示。贮藏第6天,对照组与处理组果实均开始发病。不同浓度的BTH处理在整个贮藏过程都能明显地抑制柑橘果实炭疽病病斑直径的增加。在贮藏第6~8天,0.50 mmol/L的BTH处理明显降低了果实炭疽病的发生,同时其也很好地抑制了果实病斑直径的增加,与其他处理组之间具有显著性差异。
综上所述,0.25、0.50、1.00 mmol/L 3 种浓度的BTH与P. italicum、P. digitatum、C. gloeosporioides同孔或异孔接种均可以降低果实青霉病、绿霉病、炭疽病的病斑直径,其中,0.50 mmol/L的BTH效果最好;在控制病害发病率方面,3 种浓度的BTH处理均在果实发病初期有效果,后期效果不显著,相比之下,0.50 mmol/L的BTH效果较好。
2.2 BTH处理对柑橘果皮内源水杨酸含量的影响
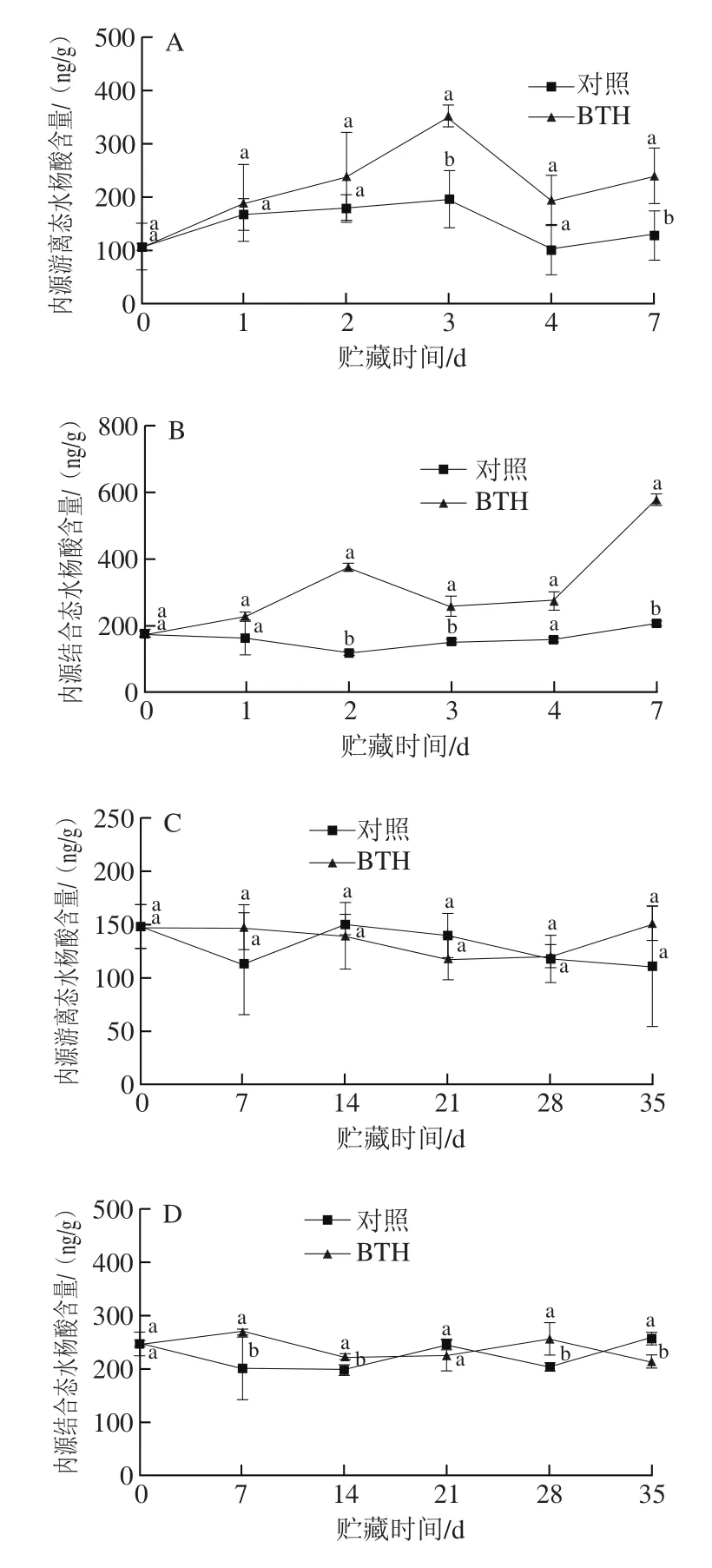
图3 BTH损伤接种处理(A、B)及浸泡处理(C、D)对柑橘果皮内源水杨酸含量的影响.Fig. 3 Effect of BTH wound inoculation (A, B) and dipping treatment(C, D) on endogenous salicylic acid contents in citrus fruit peel
如图3A所示,损伤接种BTH和无菌水均能使柑橘果实果皮中内源游离态水杨酸含量先增加后降低。与对照组相比,BTH处理显著提高了内源游离态水杨酸含量的峰值,其峰值为对照组的1.79 倍。在贮藏末期,BTH处理组的内源游离态水杨酸含量显著高于对照组。由图3B可以看出,损伤接种BTH后,内源结合态水杨酸的含量先升高达到高峰后略有下降,此后继续升高,在贮藏第7天达到最大值,其值为对照组的2.81 倍,而对照组的内源结合态水杨酸含量在整个贮藏期间变化都不大。
由图3C、D可知,浸泡处理的果实中,果皮内源游离态水杨酸和内源结合态水杨酸含量在整个贮藏期间变化都不大。与对照组相比,BTH浸泡处理对果实果皮中内源游离态水杨酸含量无明显影响,但能够显著增加内源结合态水杨酸含量,在贮藏第28天,BTH处理组内源结合态水杨酸含量为对照组的1.26 倍。
2.3 BTH处理对柑橘果皮抗性相关酶活力的影响
2.3.1 BTH处理对柑橘果皮GLU活力的影响

图4 BTH损伤接种处理(A)及浸泡处理(B)对柑橘果皮GLU活力的影响Fig. 4 Effect of BTH wound inoculation (A) and dipping treatment (B)on GLU activity of citrus fruit peel
如图4A所示,损伤接种后,柑橘果皮GLU活力呈先上升后下降的趋势。与对照组相比,BTH处理能明显增加柑橘果皮GLU活力,提高其峰值水平,而且在整个贮藏期间,其GLU活力始终高于对照组。
由图4B可知,与对照组相比,BTH浸泡处理也能显著增加柑橘果皮GLU活力,并能使GLU活力峰值提前出现,在贮藏第7天,BTH处理组果皮的GLU活力为对照组果实的1.30 倍。
2.3.2 BTH处理对柑橘果皮CHI活力的影响
由图5A可知,BHT损伤接种可以使柑橘果皮CHI活力呈先上升、后下降再上升、再下降的趋势。与对照组相比,BTH损伤处理能明显增加柑橘果皮中CHI活力,使其活力峰值水平提高。在贮藏末期(第7天),BTH处理组CHI活力高出对照组56.4%。
从图5B可以看出,经不同浸泡处理的柑橘果皮在贮藏期间CHI活力呈先上升后降低再升高趋势。BTH处理组CHI活力总体要高于对照组,贮藏末期,BTH处理组的CHI活力是对照组的1.13 倍。

图5 BTH损伤接种处理(A)及浸泡处理(B)对柑橘果皮CHI活力的影响Fig. 5 Effect of BTH wound inoculation (A) and dipping treatment (B)on CHI activity of citrus fruit peel
2.3.3 BTH处理对柑橘果皮PAL活力的影响

图6 BTH损伤接种处理(A)及浸泡处理(B)对柑橘果皮PAL活力的影响Fig. 6 Effect of BTH wound inoculation (A) and dipping treatment (B)on PAL activity of citrus fruit peel
如图6A所示,与对照组相比,BTH损伤接种处理能明显增加柑橘果实果皮中PAL活力,使其在整个贮藏期间始终保持较高水平。在贮藏第1、3、4、7天,BTH处理组PAL活力值与对照组间存在显著性差异。贮藏第4天,BTH处理组的PAL活力为对照组的1.40 倍,贮藏末期(第7天),BTH处理组的PAL活力为对照组的1.31 倍。
由6B图可得,与对照处理相比,BTH浸泡处理能显著提高果实果皮中PAL活力,尤其是在贮藏第14天,PAL活力迅速达到高峰,此后虽有所下降,但变化时间较短,在贮藏末期(第21~35天),PAL活力缓慢上升。贮藏第35天,BTH组PAL活力为对照组的1.17 倍。
2.3.4 BTH处理对柑橘果皮POD活力的影响
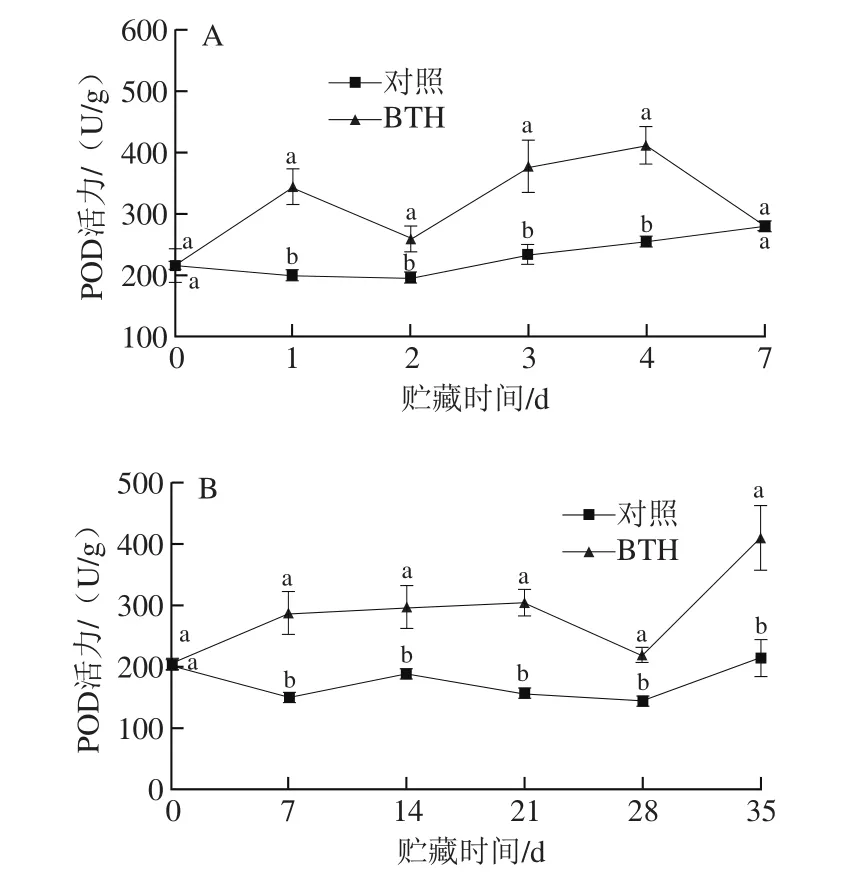
图7 BTH损伤接种处理(A)及浸泡处理(B)对柑橘果皮POD活力的影响Fig. 7 Effect of BTH wound inoculation (A) and dipping treatment (B)on POD activity of citrus fruit peel
如图7A所示,与对照组相比,BTH损伤接种可明显增加柑橘果皮POD活力。整个贮藏期间(第2天除外),BTH损伤接种果实果皮中POD活力呈先上升后下降的趋势,在贮藏第4天达到最大值,为此时对照组POD活力的1.63 倍。对照组果实果皮中POD活力在整个贮藏期间呈缓慢上升趋势直至贮藏末期。
由图7B可知,与对照组相比,BTH浸泡处理能显著增加柑橘果实果皮中POD活力。整个贮藏期间对照组果皮POD活力变化不明显,BTH处理组POD活力在贮藏前期显著增加,贮藏7~21 d内变化不大,在贮藏末期(21~35 d),其POD活力呈先迅速降低后急剧上升,在贮藏第35天,BTH浸泡处理组POD活力为对照组的1.91 倍。
2.3.5 BTH处理对柑橘果皮PPO活力的影响
由图8A可知,与对照组相比,BTH损伤接种处理能明显增加柑橘果实果皮中PPO活力。损伤接种后,BTH处理组PPO活力缓慢上升,在贮藏第4天达到峰值,为此时对照组的1.60 倍,此后PPO活力有所降低,但整个贮藏期BTH组PPO活力始终高于对照组。
由图8B可知,BTH浸泡处理果实后,柑橘果实果皮中PPO活力在贮藏7 d内先缓慢上升,达到高峰后缓慢下降,直到贮藏末期,其PPO活力仍显著高于对照组,说明BTH处理可以增加果实果皮中PPO活力。在贮藏第35天,BTH处理组PPO活力为对照组的1.56 倍。
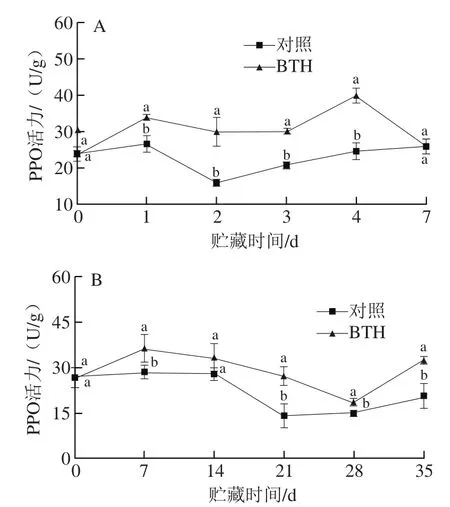
图8 BTH损伤接种处理(A)及浸泡处理(B)对柑橘果皮PPO活力的影响Fig. 8 Effect of BTH wound inoculation (A) and dipping treatment (B)on PPO activity of citrus fruit peel
3 讨 论
BTH被认为是十分有效的植物抗病性诱导剂,能够诱导多种作物产生抗病性,从而增强其对病原菌的防御能力。然而,在利用BTH诱导不同采后果蔬对不同病害产生抗性时,所需的浓度不同。例如,汪开拓等[27]研究认为0.2 g/L BTH处理能有效控制桃果实贮藏期间由Penicillum expansum引起的青霉病。弓德强等[28]研究认为利用50 mg/L的BTH水溶液对杧果果实作喷雾处理,能显著降低杧果果实自然发病病情指数。麻宝成等[29]研究认为利用5 mmol/L的BTH对香蕉果实进行喷雾处理,能较好地控制其腐烂效果,且能显著降低果实在贮藏过程中的病情指数。本实验结果表明,适宜浓度的BTH均能诱导柑橘果实产生抗病性,减轻果实青霉病、绿霉病和炭疽病的病害严重程度。在不同浓度BTH对柑橘果实青霉病、绿霉病和炭疽病病斑直径的控制实验中:0.25、0.50 mmol/L和1.00 mmol/L的BTH在对柑橘果实损伤接种后,P. italicum、P. digitatum、C. gloeosporioides与其同孔、异孔接种,均能明显降低青霉病、绿霉病、炭疽病的病斑直径。其中,0.50 mmol/L的BTH同时对这3 种病害具有最好的控制效果。而在不同浓度BTH对果实3 种病害发病率控制方面:BTH仅能够在发病初期对3 种病害发病率有所控制,后期并无显著影响。相比之下,0.50、1.00 mmol/L的BTH控制效果均好于0.25 mmol/L BTH,并且0.50 mmol/L BTH控病效果最好。综上所述,在实验所试的3 种浓度中,0.50 mmol/L BTH诱导柑橘果实产生抗病性对青霉、绿霉和炭疽病的控制效果最好。
水杨酸在植物体内通常以游离态和结合态两种形式存在,当游离态水杨酸含量达到一个阈值的时候,则会转换为结合态水杨酸。水杨酸作为一种诱导子,其含量水平在植物体内与抗病性表现出一定的相关性。内源水杨酸的积累先于抗病相关基因表达和抗病性产生[15]。本实验结果表明,在柑橘果实上损伤接种BTH,能够有效地引起柑橘果实果皮中游离态水杨酸含量的增加,同时也能引起果实果皮中内源结合态水杨酸含量的增加;在BTH浸泡处理实验中,BTH对柑橘内源游离态水杨酸含量无明显影响,但能引起内源结合态水杨酸含量的增加,表明BTH可以诱导柑橘果实产生抗病性。
GLU和CHI是两种重要的病程蛋白相关酶[30]。由于真菌细胞壁中含有β-1,3-葡聚糖和几丁质,且这两种酶通常在降解真菌细胞壁反应中表现出协同作用;因此,如果果实能够被诱导产生这两种酶,则通常被认为能够增强对病原菌的抗性。汪跃华等[31]研究认为BTH处理能够提高砂糖橘GLU和CHI活力。本实验结果表明,与对照处理相比,BTH处理增加了柑橘果实果皮内GLU和CHI活力。PAL、POD、PPO参与了果实总酚、类黄酮、木质素等代谢过程。其中,PAL是苯丙烷途径的限速酶和关键酶,能够催化苯丙氨酸向肉桂酸转变,进入苯丙烷类代谢途径,影响植物体内阿魏酸、香豆酸、芥子酸等中间代谢产物的生成以及一系列苯丙烷类化合物的合成,是木质素诱导合成的起点[32-33]。POD则是木质素诱导形成过程中最常见的氧化-还原酶之一,在脱氢酶的参与下,能够催化许多重要酚类物质发生氧化反应,从而参与木质素的合成过程,同时也是细胞内重要的活性氧清除剂[32]。而PPO能够催化醌类物质和单宁类物质的生成,醌类物质和单宁类物质通常对病原菌菌丝的生长产生毒性作用,且酚类物质是合成木质素的前体物质,PPO参与了木质素的形成,进而促进细胞壁木质化,使植物对病原菌的抗性增强[32]。因此,以上3 种酶活力的增强对采后果实抗病性的增强具有重要作用。大量研究表明,BTH处理能够促进相关果蔬中PAL、POD、PPO活力的增强,进而增强其抗病性[32,34-37]。本研究结果表明,在损伤接种及浸泡实验中,BTH处理均能升高柑橘果实果皮中PAL、POD、PPO、CHI和GLU的活力,推测它们参与了BTH诱导柑橘果实对病原菌侵染的抗性反应。
参考文献:
[1] GHAOUTH A E, WILSON C, WISNIEWSKI M, et al. Biological control of postharvest diseases of fruits and vegetables[J]. Applied Mycology and Biotechnology, 2002, 2: 219-238. DOI:10.1016/S1874-5334(02)80012-0.
[2] ALTIERI G, DI RENZO G C, GENOVESE F, et al. A new method for the postharvest application of imazalil fungicide to citrus fruit[J].Biosystems Engineering, 2013, 115(4): 434-443. DOI:10.1016/j.biosystemseng.2013.04.008.
[3] KANETIS L, FORSTER H, ADASKAVEG J E. Optimizing efficacy of new postharvest fungicides and evaluation of sanitizing agents for managing citrus green mold[J]. Plant Disease, 2008, 92(2): 261-269.DOI:10.1094/PDIS-92-2-0261.
[4] SPADARO D, VOLA R, PIANO S, et al. Mechanisms of action and efficacy of four isolates of the yeast Metschnikowia pulcherrima active against postharvest pathogens on apples[J]. Postharvest Biology and Technology, 2002, 24(2): 123-134. DOI:10.1016/S0925-5214(01)00172-7.
[5] CALVO J, CALVENTE V, DE ORELLANO M E, et al. Biological control of postharvest spoilage caused by Penicillium expansum and Botrytis cinerea in apple by using the bacterium Rahnella aquatilis[J].International Journal of Food Microbiology, 2007, 113(3): 251-257.DOI:10.1016/j.ijfoodmicro.2006.07.003.
[6] DROBY S, WISNIEWSKI M, MACARISIN D, et al. Twenty years of postharvest biocontrol research: is it time for a new paradigm?[J].Postharvest Biology and Technology, 2009, 52(2): 137-145.DOI:10.1016/j.postharvbio.2008.11.009.
[7] 任亚琳, 毕阳, 葛永红, 等. BTH浸泡处理对厚皮甜瓜采后病害的控制及贮藏品质的影响[J]. 食品科学, 2013, 34(2): 267-272.
[8] 潘永贵, 刘新华, 黎寿英. 采后BTH处理对芒果果实活性氧和抗氧化酶活性的影响[J]. 中国食品学报, 2012, 12(2): 111-117.DOI:10.3969/j.issn.1009-7848.2012.02.017.
[9] CAO J, JIANG W, HE H. Induced resistance in yali pear (Pyrus bretschneideri Rehd.) fruit against infection by Penicillium expansum by postharvest infiltration of acibenzolar-s-methyl[J]. Journal of Phytopathology, 2005, 153(11/12): 640-646. DOI:10.1111/j.1439-0434.2005.01031.x.
[10] TERRY L A, JOYCE D C. Suppression of gray mold on strawberry fruit with the chemical plant activator acibenzolar[J]. Pest Management Science, 2000, 56(11): 989-992. DOI:10.1002/1526-4998.
[11] 葛永红, 李灿婴, 朱丹实, 等. 采后BTH处理对苹果果实苯丙烷代谢和病程相关蛋白积累的增强作用[J]. 食品工业科技, 2015, 36(5): 306-310.
[12] 王迪, 黄文书, 陶永霞, 等. 苯丙噻重氮处理对采后赛买提杏贮藏品质的影响[J]. 食品科技, 2015, 40(10): 324-329.
[13] 徐涛, 蒋玉梅, 李霁昕, 等. 采后BTH处理对“玉金香”厚皮甜瓜生理特性及感官品质的影响[J]. 食品工业科技, 2014, 35(11): 315-318.
[14] 潘永贵, 刘新华, 黎寿英. 采后BTH处理对不同品种芒果果实防御酶活性的影响[J]. 食品科学, 2010, 31(20): 469-472.
[15] 曹建康. SA、ASM、INA和柠檬酸对鸭梨果实采后抗病性和品质的影响[D]. 北京: 中国农业大学, 2005: 59-60.
[16] 郭科燕. 水杨酸对杏果实采后抗病性和后熟软化的影响[D]. 乌鲁木齐: 新疆农业大学, 2012: 25-26.
[17] DELANEY T P, UKNES S, VERNOOIJ B, et al. A central role of salicylic acid in plant disease resistance [J]. Science, 1994, 266: 1247-1250. DOI:10.1126/science.266.5188.1247.
[18] ZHOU Yahan, MING Jian, DENG Lili, et al. Effect of Pichia membranaefaciens in combination with salicylic acid on postharvest blue and green mold decay in citrus fruits[J]. Biological Control, 2014,74(7): 21-29. DOI:10.1016/j.biocontrol.2014.03.007.
[19] USALL J, SMILANICK J, PALOU L, et al. Preventive and curative activity of combined treatments of sodium carbonates and Pantoea agglomerans CPA-2 to control postharvest green mold of citrus fruit[J]. Postharvest Biology and Technology, 2008, 50(1): 1-7.DOI:10.1016/j.postharvbio.2008.03.001.
[20] DENG Lili, ZENG Kaifang, ZHOU Yahan, et al. Effects of postharvest oligochitosan treatment on anthracnose disease in citrus (Citrus sinensis L. Osbeck) fruit[J]. European Food Research and Technology,2015, 240(4): 795-804. DOI:10.1007/s00217-014-2385-7.
[21] TANG Wanli, ZHU Shijiang, LI Lingling, et al. Differential expressions of PR1 and chitinase genes in harvested bananas during ripening, and in response to ethephon, benzothiadizole and methyl jasmonate[J]. Postharvest Biology and Technology, 2010, 57(2):86-91. DOI:10.1016/j.postharvbio.2010.02.007.
[22] DROBY S, VINOKUR V, WEISS B, et al. Induction of resistance to Penicillium digitatum in grapefruit by the yeast biocontrol agent Candida oleophila[J].Phytopathology, 2002, 92(4): 393-399. DOI:10.1094/PHYTO.2002.92.4.393.
[23] ZENG Kaifang, CAO Jiankang, JIANG Weibo. Enhancing disease resistance in harvested mango (Mangifera indica L. cv. ‘Matisu’) fruit by salicylic acid[J]. Journal of the Science of Food and Agriculture,2006, 86(5): 694-698. DOI:10.1002/jsfa.2397.
[24] QIN Guozheng, TIAN Shiping, XU Yong. Biocontrol of postharvest diseases on sweet cherries by four antagonistic yeasts in different storage conditions[J]. Postharvest Biology and Technology, 2004,31(1): 51-58. DOI:10.1016/S0925-5214(03)00130-3.
[25] ZHANG Yu, CHEN Kunsong, ZHANG Shanglong, et al. The role of salicylic acid in postharvest ripening of kiwifruit[J]. Postharvest Biology and Technology, 2003, 28(1): 67-74. DOI:10.1016/S0925-5214(02)00172-2.
[26] 曾凯芳. 套袋、SA和INA对芒果(Mangifera indica L.)果实采后抗病性和品质的影响[D]. 北京: 中国农业大学, 2005: 56-57.
[27] 汪开拓, 王英. BTH诱导采后桃果实抗病性反应对其贮藏品质的影响[J]. 食品与发酵工业, 2013, 39(6): 212-219.
[28] 弓德强, 谷会, 张鲁斌, 等. 苯并噻重氮对采后杧果抗病性及相关酶活性的影响[J]. 果树学报, 2010, 27(4): 585-590.
[29] 麻宝成, 朱世江. 苯并噻重氮和茉莉酸甲酯对采后香蕉果实抗病性及相关酶活性的影响[J]. 中国农业科学, 2006(6): 1220-1227.DOI:10.3321/j.issn:0578-1752.2006.06.019.
[30] 曾艳, 赵南明, 刘进元. 几丁质酶与植物防卫反应[J]. 中国生物工程进展, 1997, 17(4): 31-34.
[31] 汪跃华, 徐兰英, 庞学群, 等. 苯并噻二唑处理提高采后沙糖橘对指状青霉菌的抗性[J]. 园艺学报, 2010, 37(12): 1901-1908.
[32] 王晨芳. 化学诱导剂在诱导黄瓜抗病性中的作用[D]. 杨凌: 西北农林科技大学, 2005: 4-5.
[33] LUO Y, ZENG K, MING J. Control of blue and green mold decay of citrus fruit by Pichia membranefaciens and induction of defense responses[J]. Scientia Horticulturae, 2012, 135(1): 120-127.DOI:10.1016/j.scienta.2011.11.031.
[34] YAO H J, TIAN S P. Effects of pre- and post-harvest application of salicylic acid or methyl jasmonate on inducing disease resistance of cherry fruit in storage[J]. Postharvest Biology and Technology, 2005,35(3): 253-262. DOI:10.1016/j.postharvbio.2004.09.001.
[35] 张紫微, 朱世江. 苯并噻重氮对采后枇杷果实病害及品质的影响[J]. 食品科学, 2009, 30(6): 264-267. DOI:10.3321/j.issn:1002-6630.2009.06.062.
[36] 曾凯芳, 姜微波. 水杨酸处理对采后绿熟芒果炭疽病抗病性的诱导[J]. 中国农业大学学报, 2005, 10(2): 36-40. DOI:10.3321/j.issn:1007-4333.2005.02.009.
[37] 范存斐, 毕阳, 王云飞, 等. 水杨酸对厚皮甜瓜采后病害及苯丙烷代谢的影响[J]. 中国农业科学, 2012, 45(3): 584-589. DOI:10.3864/j.issn.0578-1752.2012.03.022.

