肺结核后肺癌的发生及早期诊断
全斌 徐明生 喻艳林 秦继武 王妮
(1.皖南医学院第二附属医院,安徽 芜湖241000;2.皖南医学院第一附属医院,安徽 芜湖241002)
肺结核后肺癌(lung cancer with previous pulmonary tuberculosis,LCWPTB)是在原肺结核病基础上发生的肺癌。与整体肺癌人群相比,LCWPTB的临床特点、早期筛查方案优化有一定差异,具有独特性。本课题组总结了64例LCWPTB患者的临床特点、病理类型,分析胸部CT和血清肿瘤标记物(tumor marker, TM)在肺结核人群中对肺癌的早期诊断的临床价值。以此来提高肺结核患者、临床人员对这类肺癌的警惕性,同时也可为LCWPTB的早期筛查、早期诊断提供相关依据。
1 对象和方法
1.1 研究对象 选自皖南医学院第二附属医院和皖南医学院第一附属医院2005年12月~2016年12月期间的64例LCWPTB(研究组)住院患者。其中男性51例,女性13例,比例约为4∶1;年龄分布在37.1~85.2岁,平均年龄(63.71±11.92)岁。研究组剔除标准:①肺癌未经病理或者细胞组织学确诊。②先有肺癌病史再诊断为肺结核者。③合并其他部位肿瘤,合并风湿免疫疾病、严重心肺肝肾功能不全者。④确诊时临床资料不齐全。60例同期住院的肺结核患者作为对照组,男性41例,女性19例;年龄分布在32.8~81.9岁,平均年龄(61.20±15.28)岁。具有详细临床资料及血清CA125、SCC、CA199、CEA检测结果。对照组剔除标准:合并其他呼吸系统慢性病、恶性肿瘤、风湿免疫疾病、严重心肺肝肾功能障碍者等。研究组和对照组间的性别、年龄、吸烟史、糖尿病史等差异无统计学意义(P>0.05)。
1.2 方法 肺结核的诊断依据按中华医学会结核病学分会的诊断标准[1];肺癌的诊断依据:通过肺穿刺、胸膜活检、外科手术等途径检出癌细胞,根据2009年UICC第7版《恶性肿瘤TNM分期》对肺癌患者进行分期。对两组患者的临床资料、胸部CT及肿瘤标识物(TM)水平进行分析。
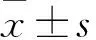
2 结果
2.1 肺结核后肺癌的临床特点 64例LCWPTB(研究组)患者主要首发临床表现为:咳嗽咳痰(60.9%),痰中带血(40.6%),消瘦(40.6%),胸背部疼痛(28.1%),胸闷(26.6%),胸腔积液(20.3%)等。60例肺结核(对照组)与LCWPTB患者临床特点较相似,但痰中带血、消瘦、胸背部疼痛的差异具有鉴别诊断意义(P<0.05),见表1。
2.2 肺结核后肺癌病理类型及临床分期 LCWPTB病理类型:鳞状细胞癌27例(42.2%),腺癌20例(31.3%),小细胞肺癌7例(10.9%),其他病理类型10例(15.6%);TNM分期为I期10例,II期17例,III期17例,Ⅳ期20例。
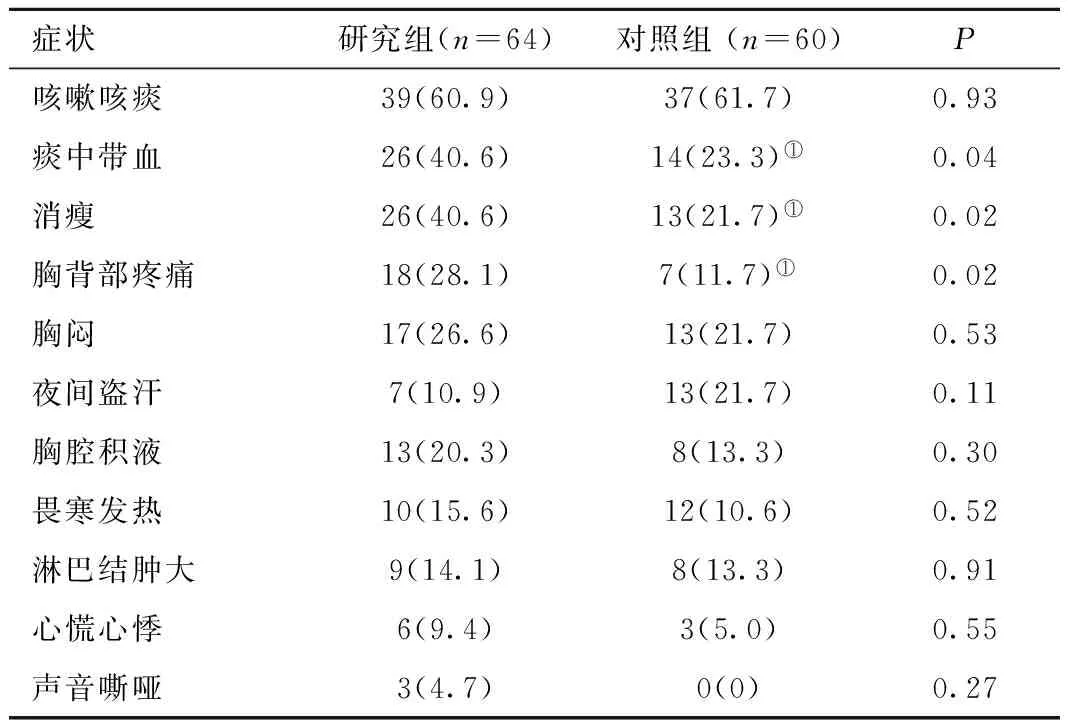
表1 两组患者临床特点的对比分析[n,(×10-2)]Table 1 Clinical features of two groups
注:与研究组比较,①P<0.05。
2.3 肺结核后肺癌影像学表现 肿瘤的整体分布:周围型肺癌占54.7 %(35例),中央型肺癌占39.1%(25例),另有6.3%(4例)呈两肺播散弥漫型。影像学特征:LCWPTB不仅具有钙化灶、薄壁空洞、纤维条索等结核病灶影像学特征,还具有恶性肿瘤的胸部CT征像如肿块影、厚壁空洞、深分叶征、毛刺状结节、胸膜凹陷征象,见图1。

图1 LCWPTB患者胸部CTFigure 1 Images of chest CT
注:A1、2:右肺门旁可见肿块影,边缘呈分叶状,另见两上肺散在斑絮状、条索状高密度影;B1、2:两肺多发小薄壁空洞,双上肺多发结节及纤维条索影,左上肺后段近胸膜侧可见混杂密度肿块影,伴左侧胸膜增厚、粘连,可见胸膜凹陷征。
2.4 TM在两组间的对比分析
2.4.1 两组TM检测水平对比 64例LCWPTB患者中有60份完整CAl25、SCC、CAl99及CEA检查结果。LCWPTB组患者的血清CA125,SCC,CA199及CEA检测水平分别为(114.56±105.34)ug/L、(8.07±7.35)ug/L,(61.32±46.23)和(37.17±36.60)ug/L均高于对照组(P<0.05),但CA125的水平差异无统计学意义(P>0.05),见表2。

表2 研究组与对照组血清TM检测水平对比Table 2 Comparison of serum TM
2.4.2 TM对肺结核后肺癌的约登指数及ROC曲线分析 以研究组的CAl25、SCC、CAl99及CEA的测定值与对照组患者4项TM的测定值为对照进行ROC曲线分析评价,得到AUC分别为 0.56、0.66、0.82和0.80,其中CA199、CEA、SCC有统计学意义(P<0.01),且CEA、SCC诊断价值较高(AUC>0.7)。同时约登指数由高到低的分别是CEA(0.550)、SCC(0.484)、CA199(0.217)、CA125(0.017)。分析结果,见图2及表3。

图24项TM对LCWPTB诊断的ROC曲线图
Figure2TheROCcurveforLCWPTB
表3TM对LCWPTB诊断的ROC曲线分析及约登指数对比
Table3ComparisonofROCcurveanalysisandYoudenindex
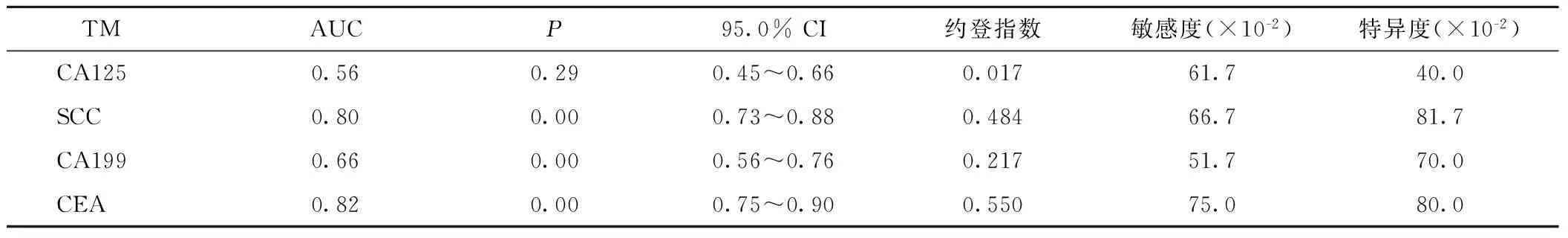
TMAUCP95.0%CI约登指数敏感度(×10-2)特异度(×10-2)CA1250.560.290.45~0.660.01761.740.0SCC0.800.000.73~0.880.48466.781.7CA1990.660.000.56~0.760.21751.770.0CEA0.820.000.75~0.900.55075.080.0
3 讨论
2014年全球肺癌的死亡率约占所有恶性肿瘤的1/4,发病率居首[2],特别是在发展中国家的其发病率和死亡率在日益攀升。肺癌的发生除和吸烟、空气污染、老年化、电离辐射等因素影响外,肺结核、哮喘、慢性阻塞性肺疾病(COPD)、尘肺等一些慢性肺部病也会增加肺癌罹患风险[3-4]。据报道[5]有1/3的人群感染过结核分枝杆菌(MTB),2014年全年有900万肺结核新发病例,150万人因此丧生[6]。Yu研究认为肺结核人群患肺癌的危险性比无结核病史人群约高出11倍[5]。Wu等[7]曾对台湾地区1997年至2008年间肺癌发生的危险因素(年龄、肺结核史、糖尿病史、COPD史、风湿免疫性疾病史等)进行Cox多因素风险分析,发现既往肺结核病史的风险比(Hr=1.64;P<0.001)甚至高于COPD (Hr=1.09;P=0.02)。在Leung[8]、Hong[3]等的多项研究报告中也都证明既往肺结核病史是肺癌发生最大的独立危险因素[7]。肺结核促进肺癌的发生机制虽尚未明确,但综合目前临床研究、流行病调查等可能和以下因素相关[5,7-9]:①肺结核患者出现CD4+T淋巴细胞下降为主的免疫功能受损。②抗痨药物可能存在致癌性。③长期MTB炎性刺激和肺部慢性损伤。④反复的支气管纤毛上皮破坏、增生。⑤致癌物的聚集及局部血管新生等。
肺结核和肺癌的临床特点比较相似,如两组所有研究对象(124例)中有76位患者出现了咳嗽咳痰症状,其中LCWPTB组为39/64,肺结核组有37/60,正是由于这种相似性导致确诊时间推迟[10],所以LCWPTB确诊时大部分处于中晚期阶段(III期占26.6% ,IV期占31.3%),I期仅占15.6%(8例)。本研究统计了两所医院11年间64位LCWPTB患者的临床特点,并与同期住院肺结核患者对比,发现了肺结核患者继发肺癌后一些临床特征发生改变:①结核空洞壁动脉血管的破裂或MTB感染组织坏死直接溶解破坏血管壁,故肺结核大多是大咯血;而LCWPTB的结核处于活动期较少,这类患者出现痰血主要和肿瘤或并发细菌感染的局部炎症使毛细血管渗透性增加有关,因此反复的痰中带血则对肺癌有诊断价值。②继发肺癌后的部分患者会出现与呼吸无关的局限、持续性胸背部疼痛(28.1%),这主要是因为癌细胞侵犯了壁层胸膜或胸壁,而肺结核患者若不合并干性胸膜炎一般不会有胸背疼痛。③继发肺癌的肺结核患者体重短时间明显下降也是一突出特点(占40.6%),肺结核病虽亦属于消耗性疾病,但多在结核活动期才明显消瘦乏力,且有效抗痨治疗后症状会得到改善,但并发肺癌的肺结核病人却在有效抗痨过程中体重仍进行性下降。
据WTO报道[11],大众人群的原发性肺癌中腺癌约占32%,鳞癌占29%,小细胞癌等其他类型占39%,而在本课题组中的LCWPTB的病理类型则以鳞癌为主(42.2%),分析差异原因:①肺结核空洞壁和细支气管柱状上皮在MTB长期刺激下发生增殖性改变,上皮鳞状化生,反复坏死、化生过程中增加了不完全修复、DNA损害等遗传错误,促发鳞状上皮细胞出现不可控性增殖[12-14]。②研究组共入组64例LCWPTB,样本量不多,存在一定误差。
为了达到肺癌早发现、早诊断的目的,在提高对LCWPTB警惕的同时,选择简便、有效的诊断方法也十分重要,而胸部CT、血清TM检查是目前公认重要的肺癌早期筛查方法[15-17]。
LCWPTB的肿块影像表现易被原有的结核病灶掩盖,故临床易漏诊或误诊[3],研究发现肺结核继发的肺癌诊断平均要延迟4至11个月[5]。本课题组通过统计分析64例LCWPTB 患者胸部CT发现LCWPTB的胸部影像学表现呈现多样化,除具有钙化灶、薄壁空洞,结核球卫星灶、纤维条索灶或肺大泡等结核特征外,还会出现体积较大且密度不均匀肿块、厚壁空洞、深分叶征、毛刺状结节、胸膜凹陷征等恶性肿瘤征象;其次LCWPTB主要表现为周围型(占54.7 %),这与既往相关文献报道一致[16]。
血清TM的检测具有操作简单、重复性强、创伤小等优点,正确的选择并运用TM检测与肺癌早期的发现有密切关系[15],本课题组研究了CA125、SCC、CA199及CEA在结核人群中对肺癌的早期诊断的临床价值。SCC最早是由Kat和Torigoe从宫颈鳞癌中分离出来,后发现SCC在肺、食管、口腔等多个部位的肿瘤上也有较高水平表达[18]。本研究中的LCWPTB患者SCC检测水平达到(8.07±7.35)ug/L,较单纯性肺结核明显升高(P<0.01)。ROC曲线分析,SCC的AUC=0.80仅次于CEA,对LCWPTB具有最高的诊断特异性81.7%,很适用于LCWPTB的早期筛查。CEA[19]是一种分布于癌细胞表面的酸性糖蛋白,属广谱肿瘤标志物。CEA在LCWPTB患者的血清水平为(37.17±36.60) ug/L,明显高于正常参考值上限,对单纯肺结核组的差异也有统计学意义(P<0.05),其对LCWPTB的诊断有最高的敏感性(75.0%)和约登指数(0.550),在ROC曲线分析中无论是曲线走行还是曲线下面积(AUC=0.82)均优于另外3种TM,所以CEA亦可用于肺结核人群的肺癌早期鉴别诊断。CAl99是Koprowski等用人结肠癌细胞株免疫BALBC纯种小鼠并与骨髓瘤进行杂交得到的一株单克隆抗体所能识别的糖类癌抗原,在癌细胞的信息传递、生长和分化中起到重要作用[20],现报道证实CA199不仅可作为消化道肿瘤的标记物,在乳腺癌、肺癌、淋巴瘤等患者血清中也有明显升高。研究组的CA199水平为(61.32±46.23)ug/L,要高于单纯肺结核患者的(25.54±21.22)ug/L(P<0.01),AUC值为0.66,对LCWPTB的诊断亦具有一定价值。目前发现CA125不仅可由卵巢细胞、癌细胞产生,也储存在正常的呼吸系统腺体及上皮组织中,当遭受MTB等刺激后CA125基因得以被激活,胞内合成增多,此时细胞间连接和基膜阻挡亦被破坏,产生的CA125大量释放到血液循环中[20-21]。通过两组对比可知4种TM中CAl25水平差异无统计学意义(P=2.26),同时在ROC曲线分析的AUC小于0.6,约登指数仅为0.017,说明其对肺结核后继发的肺癌诊断准确性较低。
4 结论
本资料显示,肺结核是促进肺癌发生的明确独立危险因素[1,5,7-13],对于既往有肺结核病史的患者如短期内出现反复痰血,不明原因消瘦,胸背部顽固性疼痛等症状时应高度警惕并发肺癌的可能,此时需及时行胸部CT、血清TM(特别是SCC、CEA、CA199)检查。这些筛查方法可为进一步的穿刺、气管内镜或外科手术病理学最终确诊提供参考依据,可减少肺癌的漏诊或误诊。
【参考文献】
[1]张培元. 肺结核诊断和治疗指南[J]. 中华结核和呼吸杂志, 2001, 24(2): 70-74.
[2]Siegel R, Ma J, Zou Z,etal. Cancer statistics, 2014[J]. CA: a cancer journal for clinicians, 2014, 64(1): 9-29.
[3]Hong S, Mok Y, Jeon C,etal. Tuberculosis, smoking and risk for lung cancer incidence and mortality[J]. International journal of cancer, 2016, 139(11): 2447-2455.
[4]Mahajan S, Gotwal V, Lata N,etal. Coexistence of Pulmonary tuberculosis and lung cancer[J]. Int. J. Curr. Res. Med. Sci, 2017, 3(5): 42-45.
[5]Yu YH, Liao CC, Hsu WH,etal. Increased lung cancer risk among patients with pulmonary tuberculosis: a population cohort study[J]. Journal of Thoracic Oncology, 2011,6(1): 32-37.
[6]World Health Organization. Global tuberculosis report 2014[R]. Geneva:World Health Organization,2015.
[7]Wu CY, Hu HY, Pu CY,etal. Pulmonary tuberculosis increases the risk of lung cancer[J]. Cancer, 2011, 117(3): 618-624.
[8]Leung CC, Hui L, Lee R S Y,etal. Tuberculosis is associated with increased lung cancer mortality[J]. The International Journal of Tuberculosis and Lung Disease, 2013,17(5): 687-692.
[9]全斌, 喻艳林. 肺结核合并肺癌的发生机制研究进展[J]. 山东医药, 2015, 55(24): 104-106.
[10] Vaghasiya K, Sharma A, Verma R K. Misdiagnosis murder: Disguised tb or lung cancer[J]. Pulm Res Respir Med Open J, 2016, 3(2): e5-e6.
[11] Hanser SL, Longo DL, Jameson JL,etal.,Harrison's principles of internal medicine[M].New York: McGraw-Hill Medical, 2008,2275-2304.
[12] Shiels MS, Albanes D, Virtamo J,etal. Increased risk of lung cancer in men with tuberculosis in the alpha-tocopherol, beta-carotene cancer prevention study[J]. Cancer Epidemiology Biomarkers & Prevention, 2011, 20(4): 672-678.
[13] Skowroński M, Iwanik K, Halicka A,etal. Squamous cell lung cancer in a male with pulmonary tuberculosis[J]. Advances in Respiratory Medicine, 2015, 83(4): 298-302.
[14] 欧阳莉, 孙勇, 刘春华. 肺结核并发肺癌患者的临床特点和生存状况研究[J]. 中国现代医学杂志, 2015, 25(31): 44-48.
[15] New York Early Lung Cancer Action Project Investigators. CT Screening for lung cancer: diagnoses resulting from the New York Early Lung Cancer Action Project[J]. Radiology, 2007, 243(1): 239.
[16] 沙广群, 石磊, 巩绪辉. 肿瘤标志物应用于肺癌检验的临床研究[J]. 检验医学与临床, 2015, 12(9): 1306-1307.
[17] 湛先发, 范小涛.肺癌影像学诊断的研究进展[J]. 西部医学, 2012,24 (4): 808-809.
[18] Molina R, Marrades RM, Augé JM,etal. Assessment of a combined panel of six serum tumor markers for lung cancer[J]. American journal of respiratory and critical care medicine, 2016, 193(4): 427-437.
[19] Feng Y, Zhou J, Chen S,etal. Relationship between EGFR gene mutation and serum tumor biomarkers in advanced lung adenocarcinoma[J]. Int J Clin Exp Pathol, 2016, 9(1): 250-255.
[20] Ghosh I, Bhattacharjee D, Das AK,etal. Diagnostic role of tumour markers CEA, CA153, CA199 and CA125 in lung cancer[J]. Indian Journal of Clinical Biochemistry, 2013, 28(1): 24-29.
[21] 全斌,喻艳林.肿瘤相关抗原在肺结核诊断及病情评估中的应用[J]. 皖南医学院学报,2015,34(1):39-42.

