TLR2、TLR4及MyD88高表达与Cm呼吸道感染肺组织炎症相关①
庞高举 孙丽妲 姚 楠 查晓宇 梁聚友 檀 露 张 虹 乔 赛 白 虹
(天津医科大学基础医学院免疫学系,国家教育部免疫微环境与疾病重点实验室,天津市细胞和分子免疫学重点实验室,天津 300070)
衣原体是严格胞内寄生的革兰阴性菌,沙眼衣原体可引起沙眼和包涵体结膜炎,并能通过泌尿道感染引起性传播疾病,导致女性盆腔炎、输卵管炎以及不孕不育,并且可以通过呼吸道感染引起衣原体肺炎。沙眼衣原体小鼠肺炎株(Chlamydia muridarum,Cm)呼吸道感染动物模型常被用来研究沙眼衣原体致病机制[1]。不同遗传背景的小鼠对衣原体感染的易感性不同,C57BL/6(C57)小鼠为衣原体感染抵抗表型,而C3H/HeN为易感表型[2]。本课题组前期研究发现,Cm呼吸道感染C3H小鼠,感染肺组织有大量持续的炎症细胞浸润并伴随前炎症细胞因子及中性粒细胞趋化因子的高表达,导致组织过度的炎症反应,与C57小鼠比较有较高的死亡率[3]。
Toll样受体作为主要的模式识别受体可以与病原相关分子模式(Pathogen-associated molecular patterns,PAMPs)结合激活固有免疫应答,并且可以桥连适应性免疫[4]。TLR4主要识别细菌LPS,TLR2可识别革兰阳性菌肽聚糖、脂蛋白等多种细菌产物[5],二者均可以激活MyD88依赖的信号通路诱发炎症反应[6]。有报道发现沙眼衣原体感染后患者体内TLR2、TLR4和TLR9的表达水平与患者易感性以及感染进程有关[7]。另有研究已证实沙眼衣原体感染生殖道后,TLR2、TLR4和MyD88的表达均升高,使用抗体封闭后,相应的前炎症因子表达减少,减少炎症细胞的浸润[1,5]。本研究拟讨论小鼠沙眼衣原体呼吸道感染TLR2、TLR4及MyD88的表达与疾病易感性的关系,以阐明C3H小鼠衣原体呼吸道感染过度炎症反应的机制。
1 材料与方法
1.1实验材料 6~8周龄雌性C57BL/6(C57)和C3H/HeN (H-2k)(C3H)小鼠(购自军事医学科学院实验动物中心),于天津医科大学实验动物中心饲养。所用垫料、鼠粮、饮用水均为清洁无菌标准,所有饲养程序严格按照天津医科大学实验动物中心操作规程进行。沙眼衣原体小鼠肺炎菌株(由加拿大曼尼托巴大学杨熙教授馈赠)1×103IFU经小鼠呼吸道感染,建立小鼠衣原体呼吸道感染模型。
1.2实验方法
1.2.1肺组织总RNA提取 使用Trizol(Invitro-gen)试剂,严格按照说明书操作提取肺组织总RNA,检测RNA浓度及纯度。
1.2.2RT-PCR 按照说明书取一定量的RNA用于反转录成cDNA,加入模板进行PCR。相关引物序列如下:β-actin(550 bp)正义链:5′-GTGGGGCGCCCCAGGCACCA-3′;反义链:5′-CTCCTTAATGTCACGCACGATTTC-3′;TLR2(295 bp)正义链:TTTGCTCCTGCGAACTCCTA;反义链:GCTTTCTTGGGCTTCCTCTT;TLR4(349 bp)正义链:GGGTCAAGGAACAGAAGCA;反义链:TGAAGGCAGAGGTGAAAGC;MyD88(488 bp)正义链:ATCCGGGTCCCTGGACTCCTTCAT;反义链:TGGTGATGCCTCCCAGTTCCTT。扩增产物进行琼脂糖电泳分析,用WCIF ImageJ分析电泳条带(OD)值,用GraphPad做统计分析。
1.3统计学处理 使用Paswstat软件对实验数据进行处理,采用Student′st检测进行组间组内比较,P<0.05为差异有统计学意义。
2 结果
2.1Cm呼吸道感染诱导TLR2、TLR4在C3H小鼠肺组织高表达 TLR2和TLR4是衣原体抗原与宿主细胞结合的主要细胞膜受体,在衣原体诱导的宿主固有性免疫应答中发挥着重要作用,因此我们探讨对衣原体高易感和抵抗小鼠肺组织TLR2和TLR4 mRNA的表达是否存在差异。结果显示(图1),Cm呼吸道感染后第7天和第14天,C3H小鼠肺组织TLR2和TLR4 mRNA的表达均显著高于C57小鼠(P<0.001或P<0.05),尤其在感染第14天TLR2和TLR4 mRNA的表达仍维持在较高水平,表明在沙眼衣原体呼吸道感染中,TLR2、TLR4受体介导的信号传导与C3H小鼠过度炎症应答密切相关。
2.2Cm呼吸道感染诱导MyD88在C3H小鼠肺组织过度表达 衣原体抗原结合TLR2和TLR4后主要通过激活MyD88依赖的信号通路诱发炎症反应。结果(图2)显示,Cm呼吸道感染C3H小鼠肺组织MyD88 mRNA的表达显著高于C57小鼠,尤其在感染的第14天,C57 MyD88 mRNA的表达恢复到基线水平而C3H小鼠仍维持高表达(P<0.01),并与TLR2和TLR4表达趋势一致。结果提示,在Cm呼吸道感染中,Cm结合TLR2和TLR4,激活下游MyD88途径,导致炎症细胞因子分泌诱导炎症细胞浸润,这些因子在C3H小鼠的过度表达与其高易感性密切相关。
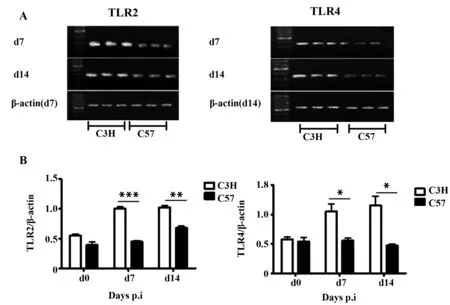
图1 感染后不同时间点C3H和C57小鼠肺组织TLR2和TLR4 mRNA表达Fig.1 Expression of TLR2 and TLR4 mRNA in lung from C3H and C57 mice postinfectionNote:A.mRNA agarose gel electrophoresis;B.Electrophoregram statistics.*.P<0.05;**.P<0.01;***.P<0.001.
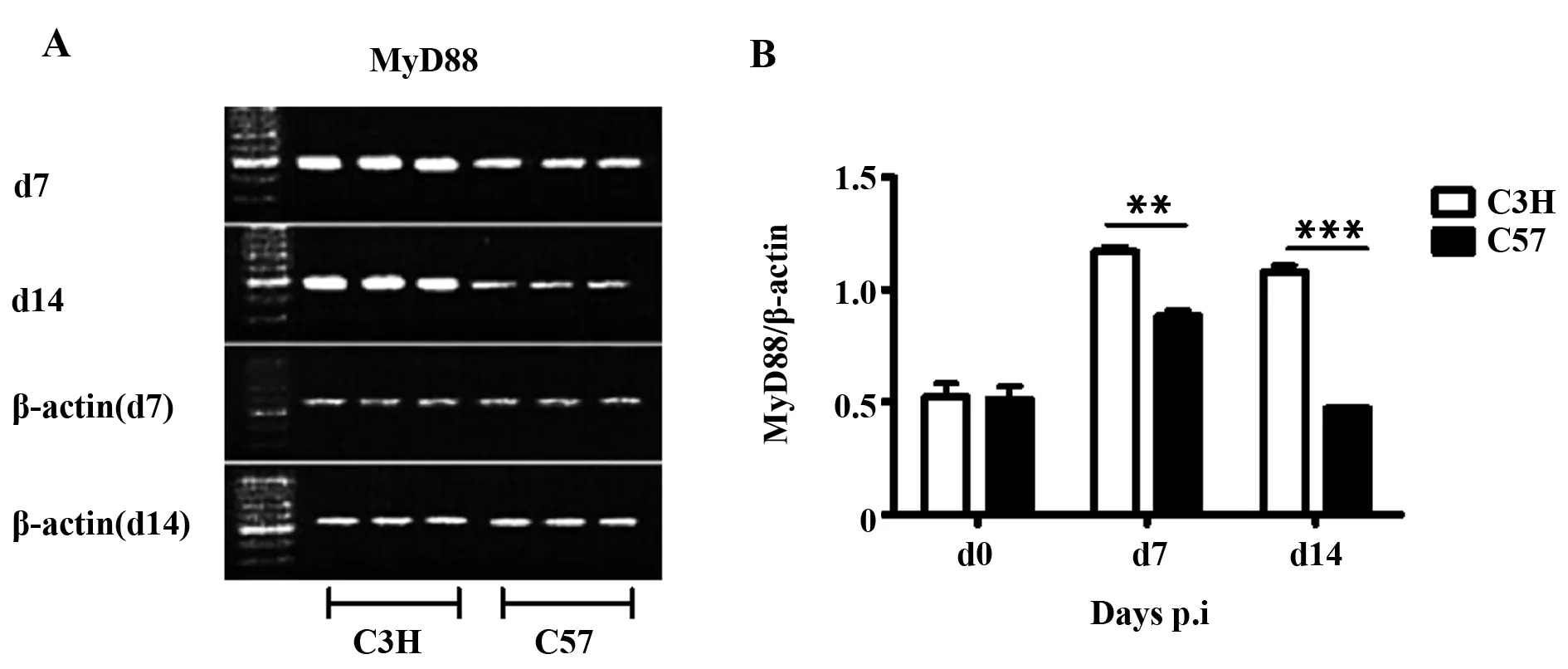
图2 感染后不同时间点C3H和C57小鼠肺组织MyD88 mRNA表达Fig.2 Expression of MyD88 mRNA in lung from C3H and C57 mice post infectionNote:A.mRNA agarose gel electrophoresis;B.Electrophoregram statistics.**.P<0.01;***.P<0.001.
3 讨论
有研究表明不同遗传背景的小鼠对衣原体生殖道感染的易感性不同,C3H小鼠是衣原体感染易感表型,C57小鼠是抵抗表型[2]。有研究表明TNF-α[8]、IL-1β[9]和IL-6[10]在衣原体感染中表达增加,加重了小鼠的疾病状况。本课题组前期的研究也发现沙眼衣原体经呼吸道感染小鼠后C3H小鼠肺组织有大量中性粒细胞浸润,与C57小鼠相比病理反应较重,结果表明与C3H小鼠体内高表达的前炎症性细胞因子TNF-α、IL-1β和IL-6以及CXC趋化因子及其受体CXCR-2密切相关,在敲除CXCR-2基因后,Cm感染后小鼠肺组织中性粒细胞的浸润减少[3],Darville等[11]在衣原体生殖道感染模型中也阐述了巨噬细胞炎症蛋白-2(Macrophage inflammatory protein 2,MIP-2)表达与中性粒细胞在感染部位浸润的关系。但是过度的中性粒胞浸润未能有效地清除衣原体,反而造成C3H小鼠严重的肺组织病理损伤。
Toll样受体等固有免疫细胞表面表达的模式识别受体与病原体的结合可促进前炎症因子的产生[1],转导蛋白MyD88分子则可以与大部分TLR结合,直接或间接地影响适应性免疫应答[12]。衣原体主要刺激TLR2和TLR4引起宿主免疫应答[13]。在沙眼衣原体小鼠生殖道感染模型中,TLR2和TLR4 mRNA表达增加,诱导炎症因子分泌增多[5],使用药物抑制TLR2和TLR4表达后疾病严重程度减轻[10]。在沙眼衣原体生殖道感染中,MyD88分子可以促进固有免疫细胞分泌细胞因子,敲除MyD88分子后,小鼠不能够有效地清除病原体[14]。在本实验中,与C57小鼠相比,Cm呼吸道感染后C3H小鼠体内TLR2、TLR4和MyD88 mRNA表达上调,且在感染后第14天仍有高水平表达,与前炎症因子表达[3]保持一致,疾病表现更加严重。有研究表明肺炎衣原体感染后主要是被TLR2识别,继而激活炎症反应,本研究中C3H小鼠肺组织中TLR2表达增高更加明显,与相关报道相符 ,说明Cm呼吸道感染后主要是C3H小鼠体内过度表达的TLR2诱导过度的炎症反应[15]。
综上所述,沙眼衣原体小鼠肺炎菌株通过呼吸道感染小鼠后,C3H小鼠体内TLR2以及下游受体蛋白MyD88表达水平升高,诱导相应前炎症因子分泌增多与C3H和C57小鼠对沙眼衣原体呼吸道感染的易感性不同密切相关。
参考文献:
[1] Hanen Sellami,Najwane Said-Sadier,Abir Znazen,etal.Chlamydia trachomatis infection increases the expression of inflammatory tumorigenic cytokines and chemokines as well as components of the Toll-like receptor and NF-κB pathways in human prostate epithelial cells[J].Mol Cell Probes,2014,28:147-154.
[2] Darville T,Andrews CW Jr,Sikes JD,etal.Mouse strain-dependent chemokine regulation of the genital tract T helper cell type 1 immune response[J].Infect Immunity,2001,69(12):7419-7424.
[3] Bai H,Yang J,Qiu HY,etal.Intranasal inoculation of Chlamydia trachomatis mouse pneumonitis agent induces significant neutrophil infiltration which is not efficient in controlling the infection in mice[J].Immunology,2005,114:246-254.
[4] Barton GM,Medzhitov R.Toll-like receptor signaling pathways[J].Sci,2003,300:1524-1525.
[5] Agrawal T,Bhengraj AR,Vats V,etal.Expression of TLR 2,TLR 4 and iNOS in cervical monocytes of chlamydia trachomatis-infected women and their role in host immune response[J].Am J Reproduct Immunol,2011,66:534-543.
[6] Thierry Roger,Nicola Casson,Antony Croxatto,etal.Role of MyD88 and Toll-like receptors 2 and 4 in the sensing of parachlamydia acanthamoebae[J].Infect Immunity,2010,78(12):5195-5201.
[7] Verweij SP,Karimi O,Pleijster J,etal.TLR2,TLR4 and TLR9 genotypes and haplotypes in the susceptibility to and clinical course of Chlamydia trachomatis infections in Dutch women[J].Pathog Dis,2016,74(1):ftv107.
[8] Sukumar Pal,Luis M,de la Maza.Mechanism of T cell mediated protection in newborn mice against a Chlamydia infection[J].Microbes Infect,2013,15(8-9):607-614.
[9] Nagarajan UM,Sikes JD,Yeruva LX.Significant role of IL-1 signaling,but limited role of inflammasome activation in oviduct pathology during Chlamydia muridarum genital infection[J].J Immunol,2012,188(6):2866-2875.
[10] Derbigny WA,Shobe LR,Kamran JC,etal.Identifying a role for toll-like receptor 3 in the innate immune response to chlamydia muridarum infection in murine oviduct epithelial cells[J].Infect Immun,2012,80(1):254-265.
[11] Darville T,Andrews CW,Sikes JD Jr,etal.Early local cytokine profiles in strains of mice with different outcomes from chlamydial genital tract infection[J].Infect Immunity,2001,69(6):3556-3561.
[12] Chen LL,Lei L,Chang XT,etal.Mice deficient in MyD88 develop a Th2-dominant response and severe pathology in the upper genital tract following chlamydia muridarum infection[J].J Immunol,2010,184:2602-2610.
[13] Frazer LC,Sullivan JE,Zurenski MA,etal.CD4+T cell expression of MyD88 is essential for normal resolution of chlamydia muridarum genital tract infection[J].J Immunol,2013,191:4269-4279.
[14] Nagarajan UM,Ojcius DM,Stahl L,etal.Chlamydia trachomatis induces expression of IFN-γ-inducible protein 10 and IFN-β independent of TLR2 and TLR4,but largely dependent on MyD88[J].J Immunol,2005,175:450-460.
[15] Ridder DA,Schwaninger M.NF-kappaB signaling in cerebral ischemia[J].Neuroscience,2009,158:995-1006.

