一株茶园草甘膦降解菌的筛选与鉴定
贺望兴 杨普香 石旭平 谢小群 朱运华 蔡翔
(江西省蚕桑茶叶研究所 330202)
草甘膦(C3H8NO5P)又称农达(Roundup),是一种高效、低毒、广谱和内吸传导、非选择性叶面喷施的除草剂[1]。其主要存在形态为酸和以草甘膦异丙胺盐为主的盐类,微溶于水,不溶于一般有机溶剂,其异丙胺盐完全溶解于水。草甘膦主要通过抑制植物体内的烯醇丙酮基莽草素磷酸合成酶,从而抑制莽草素向苯丙氨酸、酪氨酸及色氨酸的转化,使蛋白质合成受到干扰,导致植物死亡[2]。自1971年Monsanto公司John Franz等开发以来,草甘膦以高效广谱低毒而被广泛应用于农作物、林木和果园中,是全世界除草剂使用量最大的药品[3],然而草甘膦的大量使用对土壤、水体及生物等造成了较大的污染,同时对土壤生物化学过程产生一定影响,给环境尤其是土壤带来污染和生态失衡,从而影响其在土壤中的生物转化[4~5]。因此,草甘膦对人类和环境的毒性受到广泛关注。
草甘膦在土壤中的降解是一个复杂的过程,降解的途径和速率受到多种因素的影响[6]。据报道草甘膦在土壤中的半衰期在1~174d 的范围内变化,其主要的降解产物为氨甲基磷酸(AMPA)[7],其中土壤生物对草甘膦在土壤中的降解做出了主要贡献[8]。Araújo 等[9]采用土壤呼吸方法测定土壤微生物对草甘膦降解,研究结果表明土壤中草甘膦的降解主要是由微生物作用导致的。本研究从长期施用草甘膦的茶园土壤中经过初筛、复筛筛选分离得到一株能以草甘膦为唯一碳源生长并且能够降解草甘膦的菌株,通过该菌株16Sr DNA同源性分析,推断该菌株为微球菌属。
1 材料与方法
1.1 培养基
富集培养基(g/L):蛋白胨5,酵母提取物5,磷酸氢二钾1,葡萄糖1,pH值 7.0~7.2。
LB培养基(g/L):蛋白胨10,酵母提取物5,氯化钠10,琼脂粉15,pH 值7.0~7.2。
基础无机盐培养基MSM(g/L):磷酸氢二纳1.5,磷酸二氢钾1.5,硝酸四氢氮1,硫酸镁0.2,氯化钙0.01,硫酸镁0.001,酵母提取物0.05,pH 值7.0~7.2。
分离培养基:在MSM培养基中加入草甘膦,使培养基中草甘膦的终浓度达到实验所需浓度。
1.2 实验方法
1.2.1 供试土壤的驯化
采用五点采样法收集茶园草甘膦污染区土壤,然后将土壤按1:1:1:1:1的比例混合于实验容器内,每天浇灌适量草甘膦稀释液,保持土壤湿润,第一个月浇灌的草甘膦稀释液浓度为50mg/L,每个月以50mg/L的浓度增幅依次递增,浇灌驯化6个月,即为驯化土样。
1.2.2 降解菌系的富集及降解菌株的分离、纯化
富集培养:取驯化土样5g到100mL含草甘膦50mg/L的富集培养基中,30℃,170r/min震荡培养7d。
驯化培养:吸取富集培养液10mL转接到100mL含有100mg/L的草甘膦的MSM培养基中,30℃,170r/min震荡培养7d。取10mL培养液接入到浓度为200mg/L草甘膦的MSM培养基中,培养方法同上,震荡培养7d,用同样的培养方法,以100mg/L的浓度增幅依次提高MSM培养基中草甘膦的浓度至1 000mg/L。
分离纯化:将最终驯化得到的培养液经过梯度稀释后涂布在含有100mg/L草甘膦的MSM培养基平板上,每个梯度(10-1、10-2、10-3、10-4)涂布三块平板,30℃恒温培养3d。挑取生长旺盛的单菌落进行反复划线纯化,将纯化后的菌株保存在含有15%甘油和100mg/L草甘膦的LB培养基中,编号,于-80℃冰箱内保存备用。
1.2.3 菌株的鉴定
1.2.3.1 形态学观察
将分离纯化得到的降解菌采用平板划线法接种到固体LB培养基上,30℃培养24 h后观察菌落形态。
1.2.3.2 革兰氏染色
通过革兰氏染色法观察对数生长期的降解菌个体形态及菌落特征,细菌鉴定则依据《伯杰细菌鉴定手册》及《常见细菌系统鉴定手册》进行 。
1.2.4 CGL-1菌生长曲线分析
用接种环取一环经过平板活化的CGL-1菌至含100 mg/L草甘膦的MSM液体培养基中,在30℃,170r/min的条件下每隔2 h取一次菌液,菌液在600nm[10]波长下测定其光密度值(OD),绘制CGL-1菌的生长曲线。
1.2.5 菌株耐草甘膦最高浓度
将处于对数生长期的CGL-1菌适量分别接种到草甘膦梯度分别为200 mg/L、400 mg/L、600 mg/L、800 mg/L、1 000 mg/L、1 200 mg/L、1 400 mg/L、1 600 mg/L、1 800 mg/L的MSM液体培养基中,每处理3个重复,以不加草甘膦的培养基作为对照,测定每个梯度浓度下CGL-1菌在30℃,170 r/min,培养1 d发酵液中CGL-1菌活性,确定CGL-1菌旺盛生长的最高耐草甘膦浓度。
1.2.6 CGL-1菌系统发育树分析
1.2.6.1 菌株总DNA的提取
①取1mL菌液,8 000g,离心2min,弃上清,加400μL提取缓冲液冲洗细胞2次,8 000g,离心2 min,弃上清。
②用200μL TE buffer悬浮菌体,加入100μL的Tris 饱和酚(pH 值8.0),涡旋混合1 min。
③13 000 g,离心5 min,取上清。
④加入40μL TE buffer和100μL氯仿,混合震荡,13 000 g,离心5 min。
⑤取160μL上清液,加入40μL TE buffer和5μL RNase(10mg/mL),37℃放置10 min。
1.2.6.2 菌株16S rDNA扩增
引物序列:
P0:5’-GAGAGTTTGATCCTGGCTCAG-3’
P6:5’-CATCGGCTACCTTGTTACGA-3’
PCR扩增反应体系:
反应物 体积(μL)
细菌总DNA模板(约100ng/μL) 1
Taq PCR Mix 12.5μL(2x) 12.5
引物 P0(10μΜ) 1
引物 P6(10μΜ) 1
去离子水 9.5
PCR 反应程序:94℃预变性5 min;94℃变性30s,52℃退火30s,72℃延伸90 s,循环30次,最后72℃延伸10 min,4℃保存。
PCR产物送往上海生工生物公司测序。
1.2.6.3 菌株系统发育树的构建
将测序结果序列提交GenBank进行BLAST比对,下载相似度大于95%的模式菌株的序列,以fasta格式整合到一个文件内,启动MEGA 5.0软件,将得到的整合文件导入到MEGA软件,序列全选,用Align by Clustal W进行多重序列比对,比对结束后,选择菜单栏中Analysis选项中的 phylogeny Construct/Test Neighbor Joining Tree选项进行序列数据的统计,然后计算分枝间的遗传距离。Boostrap值设置为1 000来分析分支系统发育树各分支聚类的稳定性。
2 结果与分析
2.1 菌株分离与形态鉴定
经过连续6个月的土壤菌株驯化培养,再通过平板划线分离技术,得到一株以草甘膦为唯一碳源的菌株,将其命名为CGL-1,该菌株在光学显微镜下观察,菌体呈球形,无荚膜和芽孢。在LB固体培养基上30℃培养24h后,培养基上呈黄色、表面光滑、微隆起、边缘整齐的菌落。革兰氏染色实验鉴定结果显示该菌为革兰氏阳性菌。
2.2 菌株生长曲线
如图1所示,CGL-1菌在液体摇瓶培养初期细菌由于主要在适应培养环境以及为对数生长期的快速繁殖合成必要的前体物质而生长缓慢,在2~14h培养时间内菌株处于对数生长期,该期间CGL-1菌快速繁殖,菌浓度越来越高;培养14h之后由于培养液营养物质消耗殆尽以及有害次生代谢产物的积累导致菌株生长量低于死亡量,细菌进入衰亡期。
2.3 菌株耐草甘膦最高浓度
如图2所示,当发酵液中草甘膦浓度在0~1200mg/L浓度范围内,30℃,170r/min,培养1 d,测定OD600值,结果各梯度浓度下CGL-1菌活性随草甘膦浓度的增加而提高,草甘膦浓度为1 200 mg/L时菌活性最高;但当草甘膦浓度大于1 200mg/L之后 CGL-1菌活性逐渐下降。实验结果表明,CGL-1菌对草甘膦具有较好的耐受性,但草甘膦浓度过高会抑制CGL-1生长,CGL-1对草甘膦的最高耐受浓度为1 200 mg/L。
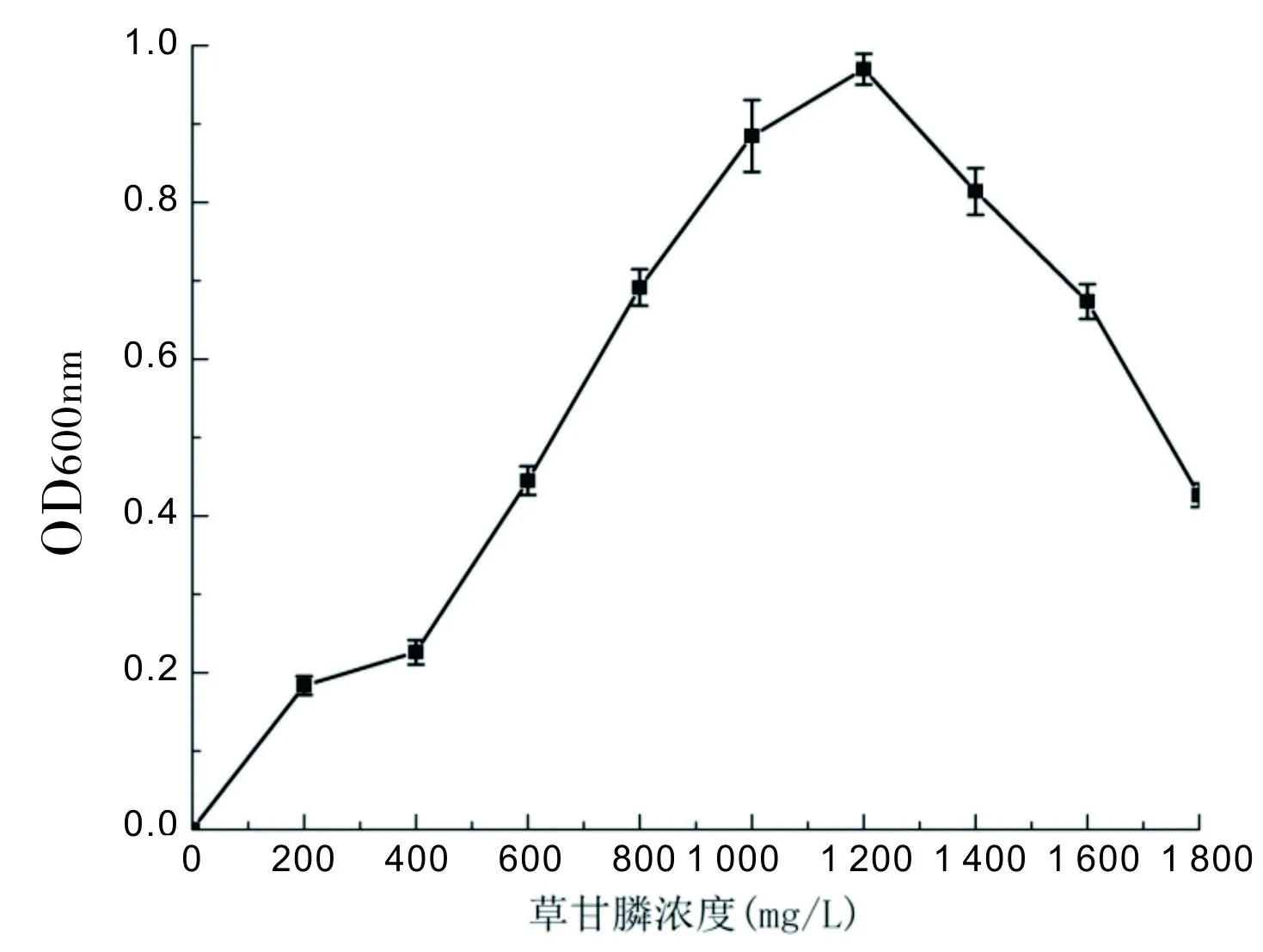
图2 CGL-1菌耐草甘膦活性
2.4 细菌系统发育树分析
如图3所示,CGL-1与9株同源关系较近的模式菌株形成了2个不同的分支,表明这些菌株属于2个不同的亚群,CGL-1与云南微球菌Micrococcusyunnanensis(KC514114)亲缘关系最近,通过对CGL-1菌16S rRNA同源性分析以及构建系统进化树分析进一步验证了本实验分离得到的降解草甘膦的菌株CGL-1为微球菌属。
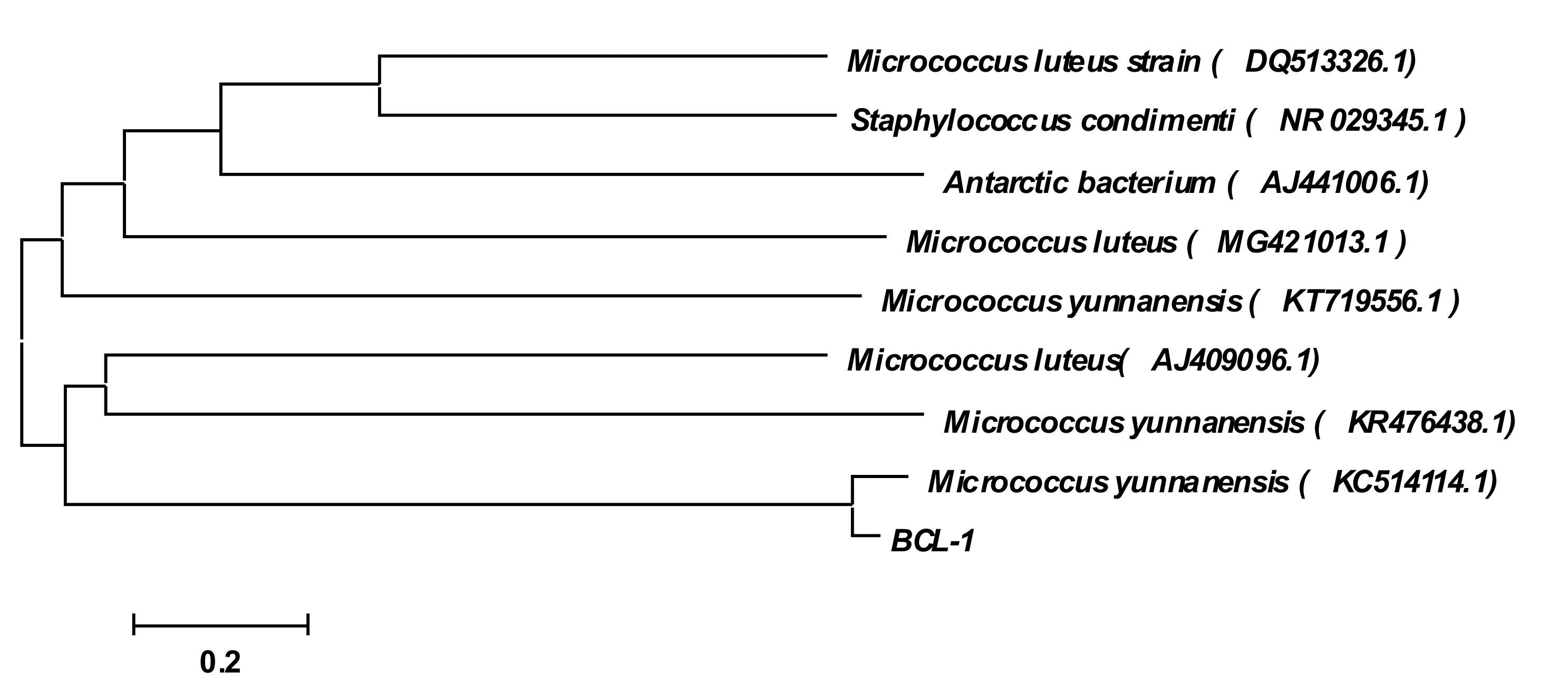
图3 CGL-1菌系统进化树
3 小结与讨论
草甘膦的分解主要要靠土壤中的微生物对它的降解作用。自1983年Moore等分离到第一株降解草甘膦的假单胞菌菌株(Pseudomonassp.)后,陆续有多株降解微生物被分离。早期分离到的菌株大多以草甘膦为磷源,这些细菌菌株分属于产黄菌属(Flavobacteriurn) 、节杆菌属(Arthrobacter)、产碱杆菌属 (Alcaligenes)及根瘤菌科(Rhizobiaceae)中[10~13]。近年来,从拟青霉(Paecilomycesvarioti)、克柔假丝酵母(Candidakruseis)、黑曲霉(Aspergilusniger)等真菌中也分离到了多株可降解草甘膦的菌株[14~17]。但有关微球菌属草甘膦农药降解菌的报道还很少见到,本实验从农药驯化土壤中分离筛选出一株潜在的降解草甘膦的菌株CGL-1,该菌株通过形态学,16S rDNA同源性分析以及构建系统进化树等方法鉴定为微球菌属。菌株CGL-1能在以草甘膦为唯一碳源的无机盐培养基中生长良好,对草甘膦的最高耐受浓度为1 200mg/L,显示对草甘膦具有较好的降解效能。后续CGL-1对草甘膦的降解效能以及田间试验将是本研究的重点工作。CGL-1菌的分离丰富了草甘膦农药降解菌资源,在被污染的土壤和污水等环境的生物修复中具有很大的应用潜力,同时应该深入研究降解菌有关酶和基因,本人认为将降解草甘瞵的基因克隆后转入农作物,使草甘膦在农作物中快速催化代谢为无毒产物的研究是今后该领域的研究热点。
参考文献
[1]陈云.除草剂草甘膦的性质和应用[J].湖北化工,1995(2):10~11.
[2]卢信,赵炳梓,张佳宝,等.除草剂草甘膦的性质及环境行为综述[J].土壤通报,2005,36(5):147~152.
[3]李亮.Ⅱ型 EPSP合酶的功能域鉴定及大肠杆菌在草甘膦冲击下的基因表达谱分析[D].北京:中国农科院,2010:1~115.
[4]杨永华,姚健,华晓梅.农药污染对土壤微生物群落功能多样性的影响[J].微生物学杂志,2000,20(2):23~25.
[5]毛美红,俞婷婷,傅柳方,等.草甘膦对毛竹笋用林土壤理化性质的影响分析[J].竹子研究汇刊,2011,30(3):29~32.
[6]张伟,王进军,高立明,等.草甘膦在水-土壤系统中的环境行为及研究进展[J].农药,2006,45(10):649~654.
[7]Wauchope R D,Buttler T M,Hornsby A G et al.The SCS/ARS/CES pesticide properties database for environmental decision-making[J].Rev Environ Contam Toxicol,1992,123(6):1~155.
[8]徐晶,王迎迎,蒲国锋,等.草甘膦农药在土壤中残留研究进展[J].吉林蔬菜,2017(6):40~42.
[9] Araújo A S F,Monteiro R T R,Abarkeli R B.Effect of glyphosate on the microbial activity of two Brazilian soils [J].Chemosphere,2003,52(5):799~804.
[10] 韩丽珍,刘飞,赵德刚,等.1株草甘膦降解菌的分离鉴定及特性[J]. 贵州农业科学,2012,40(12):139~142.
[11] Moore J K,Braymer H D,Larson A D.Isolation of aPseudomonassp. Which utilizes the phosphonate herbicide glyphosate [J].Applied and Environmental Microbiology,1983,46(2):316~320.
[12]Terry M,Bahhazor E,Hallas E.G1yphosate-degrading microorganisms from industrial activated sludge[J].Applied and Environmental Microbiology,1986,51(2):432~434.
[13] Pipke R,Amrhein N.Isolation characterization of amutant ofArthrobactersp.Strain GLP-1 which utilizes the herbicide glyphosate as its sole source of phosphorus and nitrogen[J].Applied and Environmental Microbiology,1988(54):2 868~2 870.
[14]Werner L,Manfred S,Benno P.Physiological aspect of glyphosate degradation in Alcaligenes spec. strain GL[J].Archives of Microbiology,1990(153):146~150.
[15]汤鸣强,尤民生.抗草甘膦酵母菌ZM-1的分离鉴定及其生长降解特性[J].微生物学通报,2010,37 (9):1 402~1 409.
[16] Cristina R M,Enso H,Reinoso A,et a1.Biodegradation of glyphosate by wild yeasts[J].Revista Mexicana De Micologia,2004(19):45~50.
[17]石成春,郭养浩,王大奈,等.草甘膦曲霉生物降解的动力学研究[J].中国环境科学,2005,25(3):361~365.
[18]潘渠,杨志荣.一株降解草甘膦的真菌分离鉴定[J].四川大学学报(自然科学版),2001,38(1):131~133.

