流感病毒唾液酸受体在哮喘小鼠气道组织的分布和表达
周亮 张建勇 张泓 陈玲 王莉
563003 遵义医学院附属医院呼吸二科
甲型流感病毒传染性强,人群感染率高,哮喘患者对流感病毒易感性增强[1],流感病毒的易感性受到宿主细胞唾液酸受体表达的影响。哮喘患者急性发作时常使用糖皮质激素吸入来治疗,关于哮喘后机体气道上皮细胞唾液酸受体表达的变化及糖皮质激素干预对其的影响,目前尚不清楚。本研究拟通过构建哮喘小鼠模型,观察甲型流感病毒唾液酸受体在哮喘小鼠气道组织中的表达及地塞米松干预对该受体表达的影响,探讨哮喘合并流感病毒感染的发病机制。
1 材料与方法
1.1材料清洁级雌性BALB/c小鼠30只,5~6周龄,体重(20±2)g,购于中科院上海斯莱克实验动物中心(合格证号:SCXK(沪)2007-0005);V级卵清白蛋白 (OVA,美国Sigma公司,货号A5503,批号031M7 008 V),氢氧化铝凝胶(美国Invivogen公司,货号vac-alu-250,批号AHG-34-690),小鼠IL-5 ELISA试剂盒(美国R&D公司,货号PM5000,批号201303),小鼠抗Mucin 5AC单克隆抗体(美国Thermo Fisher Scientific 公司,MA5-12178,批号NA1 499 464 A), 山槐凝集素粉I (MAA-I,货号B-1315,批号V0310)、山槐凝集素粉II (MAA-II,货号B1265,批号X0424)、黑接骨木凝集素(SNA,货号B-1305,批号V0225) 及荧光素Fluorescent Avidin DCS(货号A-2011,批号V1112) 均购自美国VECTOR Laboratories公司,DAPI购于北京索莱宝科技有限公司,AB-PAS染色试剂盒购于上海源叶生物科技有限公司,荧光显微镜DMIL LED、Leica Application Suite V4采图系统均购自德国Leica公司。
1.2小鼠哮喘模型的构建与分组采用随机数字法将30只BALB/c小鼠分为正常组(N组)、哮喘组(A组)、地塞米松干预组(D组),每组各10只。建立小鼠哮喘模型:A组于第1、13天腹腔注射致敏液0.2 ml(含OVA 20 μg和氢氧化铝凝胶0.1 mg),第19天雾化吸入10%OVA溶液激发,1次/d,30 min/次,连续5 d;D组于每 d雾化吸入前30 min予地塞米松2 mg/kg腹腔注射,1次/d,余处理同A组。
1.3支气管肺泡灌洗液(BALF)及肺组织切片的制备各组小鼠在末次雾化吸入后24 h, 用10%水合氯醛腹腔注射麻醉后, 腹主动脉放血致死。 切开气管并插管,采集支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF),计数细胞总数、嗜酸性粒细胞计数,ELISA方法测定IL-5浓度;制备肺组织石蜡包埋切片,进行苏木精-伊红(HE)染色于光镜下观察及炎症评分、阿尔新蓝-过碘酸-雪夫(AB-PAS)染色观察气道黏液物质。免疫组化法(IHC)检测肺组织Muc5ac蛋白表达。
1.4免疫荧光组织染色标本处理及采用免疫荧光法观察小鼠气道组织中唾液酸受体分布和表达的具体方法如文献所述[9]。切片经过脱蜡水化抗原修复后,分别用特异性抗体MAA-I(特异性结合SAa2,3galb1,4GlcNac)、MAA-II(特异性结合 SAa2,3galb1,3GlcNac)、SNA(特异性结合SAa2,6-gal)孵育,PBS作空白对照,室温孵育2 h,冲洗后用荧光素标记Fluorescent Avidin DCS(发绿色荧光)的二抗室温孵育30 min,用DAPI溶液(10 μg/ml)标记细胞核后封片。每组组织切片在镜下随机取10个气道,分别采集其绿色和蓝色荧光图像,计数每个气道上皮的细胞核数及阳性细胞数,并且计算各组气道阳性细胞数占细胞总数比例及每种一抗的平均阳性率。
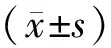
2 结果
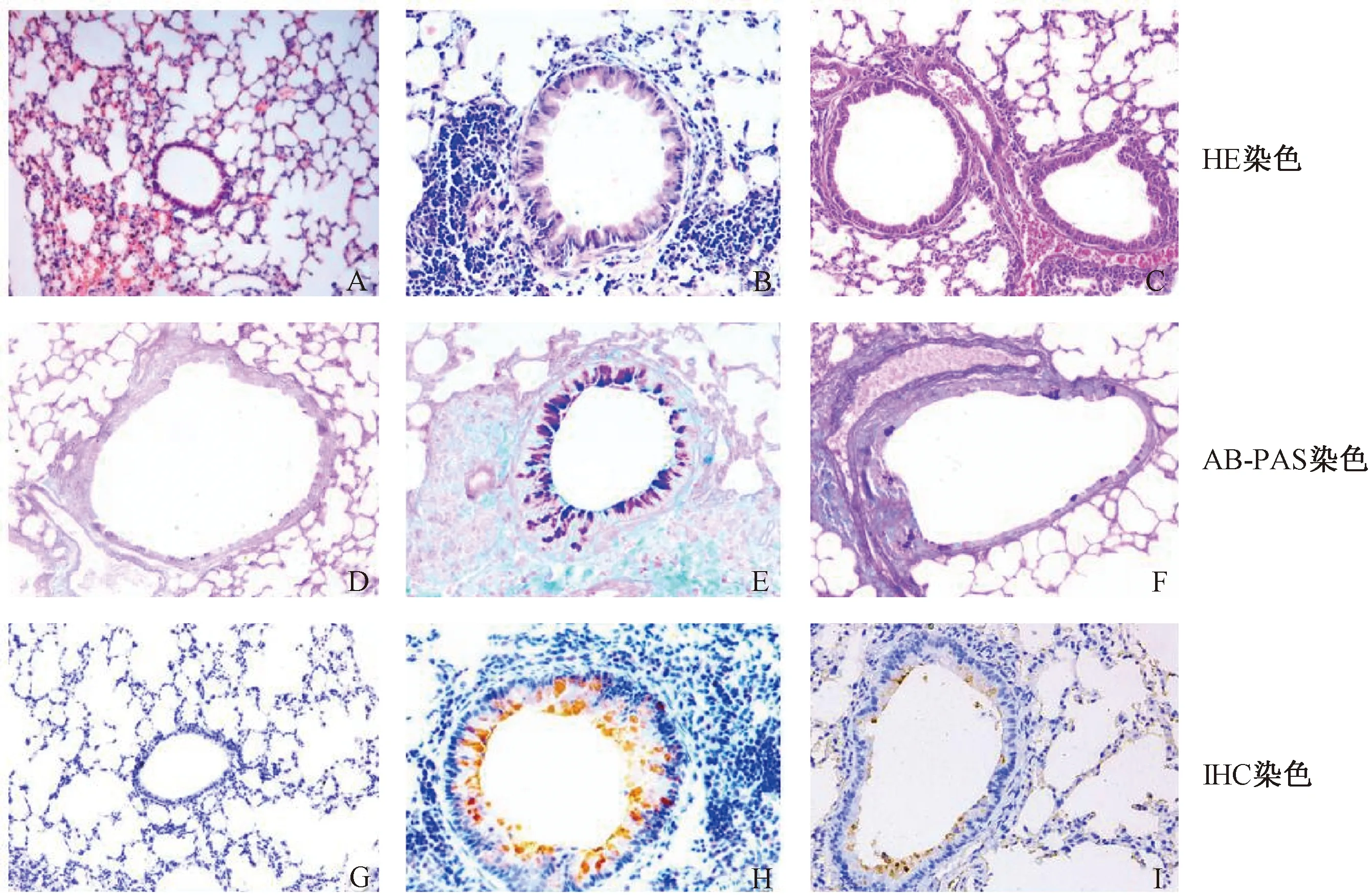
2.1哮喘小鼠模型的构建本研究首先建立了小鼠哮喘模型,测定了与哮喘相关的细胞学、病理学和生物化学指标。主要指标包括BALF中细胞总数、嗜酸性粒细胞数与IL-5浓度、气道炎症评分和气道黏液分泌状况。肺组织切片HE染色的结果显示N组支气管管壁及肺泡壁结构完整,未见炎性细胞浸润,无明显杯状细胞增生及黏液分泌(见图1 A);A组气道及血管周围可见以嗜酸性粒细胞为主的大量炎性细胞浸润。支气管黏膜上皮少量脱落,不完整,可见杯状细胞增生,气道黏液增多,管壁增厚,支气管管腔变窄,炎症细胞浸润评分高于N组及D组,差异有统计学意义(P=0.000,P<0.01)(见图1B和表2)。D组气道及血管周围见少量炎性细胞浸润,偶见嗜酸性粒细胞,无明显杯状细胞增生及黏液分泌 (见图1C);BALF中细胞总数、嗜酸性粒细胞百分比及绝对值A组明显高于N组及D组(P均=0.000<0.01)(详见表1)。ELISA结果显示,A组小鼠BALF中IL-5水平高于N组及D组(P=0.000<0.01)(详见表1)。AB-PAS染色的结果显示N组小鼠气道上皮未见杯状细胞,管腔内未见黏液分泌(见图1D);A组小鼠气道上皮可见大量增生杯状细胞(染成紫红色,见图1E),D组见少量杯状细胞(图1F)。A组气道上皮杯状细胞及黏液物质阳性相对着色面积较N组明显增高(P=0.000<0.01)(详见表2)。Muc5ac的IHC结果显示Muc5ac蛋白阳性表达主要在气道上皮杯状细胞及管腔内,N组未见Muc5ac蛋白表达(图1G),A、D组可见Muc5ac蛋白表达(见图1H,I),且A组较N、D两组明显增加(P=0.000<0.01)(详见表2)。以上结果表明我们构建的哮喘小鼠模型具备哮喘的病理学改变特征,即哮喘组(A组)BALF嗜酸性粒细胞数与IL-5浓度、气道炎症评分、气道黏液分泌较正常组(N组)均升高(P=0.020<0.05),而地塞米松干预组(D组)上述指标较A组降低(P=0.060>0.05)(见表1,2;图1)。

表1 3组小鼠BALF中细胞计数及IL-5的变化
注:与N组比较,##P<0.01;与A组比较,△△P<0.01.N, 正常组; A, 哮喘组; D,地塞米松干预组
Note: Compared with N group,##P<0.01;Compared with A group,△△P<0.01.N, Normal group; A, Asthma group; D, Dexamethasone intervention group
2.2唾液酸受体表达的定性分析为了观察对比流感病毒唾液酸a2,3-半乳糖(SAa2,3-gal)和唾液酸a2,6-半乳糖(SAa2,6-gal)受体在模型鼠气道组织中的分布和表达,以及地塞米松干预对其表达的影响, 本研究应用特异性结合SAa2,3-gal的植物凝集素MAA-I、MAA-II,以及特异性结合SAa2,3-gal的植物凝集素SNA作为一抗,经荧光素Fluorescent Avidin DCS标记,运用荧光显微镜观察各组肺组织荧光信号。结果显示,阳性信号呈绿色荧光,位于细支气管上皮面向管腔的顶端细胞膜及肺泡上皮细胞表面,DAPI染色的细胞核呈细颗粒状,显蓝色荧光。SNA、MAA-II在3组气道上皮均呈阳性,SNA均为局灶性分布,MAA-II在N组呈局灶性分布,在A、D两组呈连续性线性分布;MAA-I在N组未见表达,A组偶见表达,D组局灶性分布。空白对照组未见阳性表达(见表3和图2)。以上结果表明,流感病毒唾液酸SAa2,3-gal、SAa2,6-gal受体在正常组小鼠、哮喘组小鼠以及地塞米松干预组小鼠的气道组织中均有表达。
2.3唾液酸受体表达的定量分析为了解流感病毒唾液酸SAa2,3-gal、SAa2,6-gal受体在各组表达量的差异,我们对各组唾液酸受体的表达进行了定量分析。结果显示A组中MAA-II的平均阳性率高于N组,而且差异有统计学意义(P=0.000<0.01)。A组中SNA和MAA-I的平均阳性率高于N组,但是差异无统计学意义(P=0.070>0.05)。3种凝集素(SNA、MAA-I、MAA-II)在D组的平均阳性率均高于A组和N组(MAA-II,D组与A组比较,P=0.001<0.05,余组间比较P=0.000<0.01),差异有统计学意义。空白对照组气道上皮未见阳性表达(见表4)。以上研究结果表明,SAa2,3-gal在哮喘组的表达较正常组增强;而地塞米松干预组,SAa2,3-gal、SAa2,6-gal较正常组及哮喘组表达均增强。
2.4唾液酸受体表达的综合分析综上所述,结合定性分析及定量分析结果显示,唾液酸受体阳性表达位于细支气管及肺泡上皮。SAa2,3-gal和SAa2,6-gal在各组均有表达。哮喘组气道上皮细胞SAa2,3-gal较正常组升高,地塞米松干预组气道上皮细胞SAa2,3-gal和SAa2,6-gal表达均较正常组和哮喘组升高(P=0.000<0.05)。
HE染色(20×)观察正常组(A)、哮喘组(B)和地塞米松干预组(C)小鼠气道组织炎症改变;AB-PAS 染色(20×)观察正常组(D)、哮喘组(E)和地塞米松干预组(F)小鼠气道组织黏液分泌;IHC染色(20×)观察正常组(G)、哮喘组(H)和地塞米松干预组(I)Muc5ac蛋白表达
图1 哮喘小鼠模型构建相关指标观察
HE staining (20×) observed changes in airway tissue inflammation in normal group (A), asthma group (B), and dexamethasone intervention group (C);AB-PAS staining (20×) was used to observe mucus secretion in airway tissue of normal group (D), asthma group (E) and dexamethasone intervention group (F);IHC staining (20×) observed Muc5ac protein expression in normal group (G), asthma group (H) and dexamethasone intervention group (I)
Fig.1 Observation of related indicators for asthma mouse model

注:与N组比较,##P<0.01;与A组比较,△△P<0.01.N, 正常组; A, 哮喘组; D,地塞米松干预组
Note: Compared with N group,##P<0.01;Compared with A group,△△P<0.01..N, Normal group; A, Asthma group; D,Dexamethasone intervention group
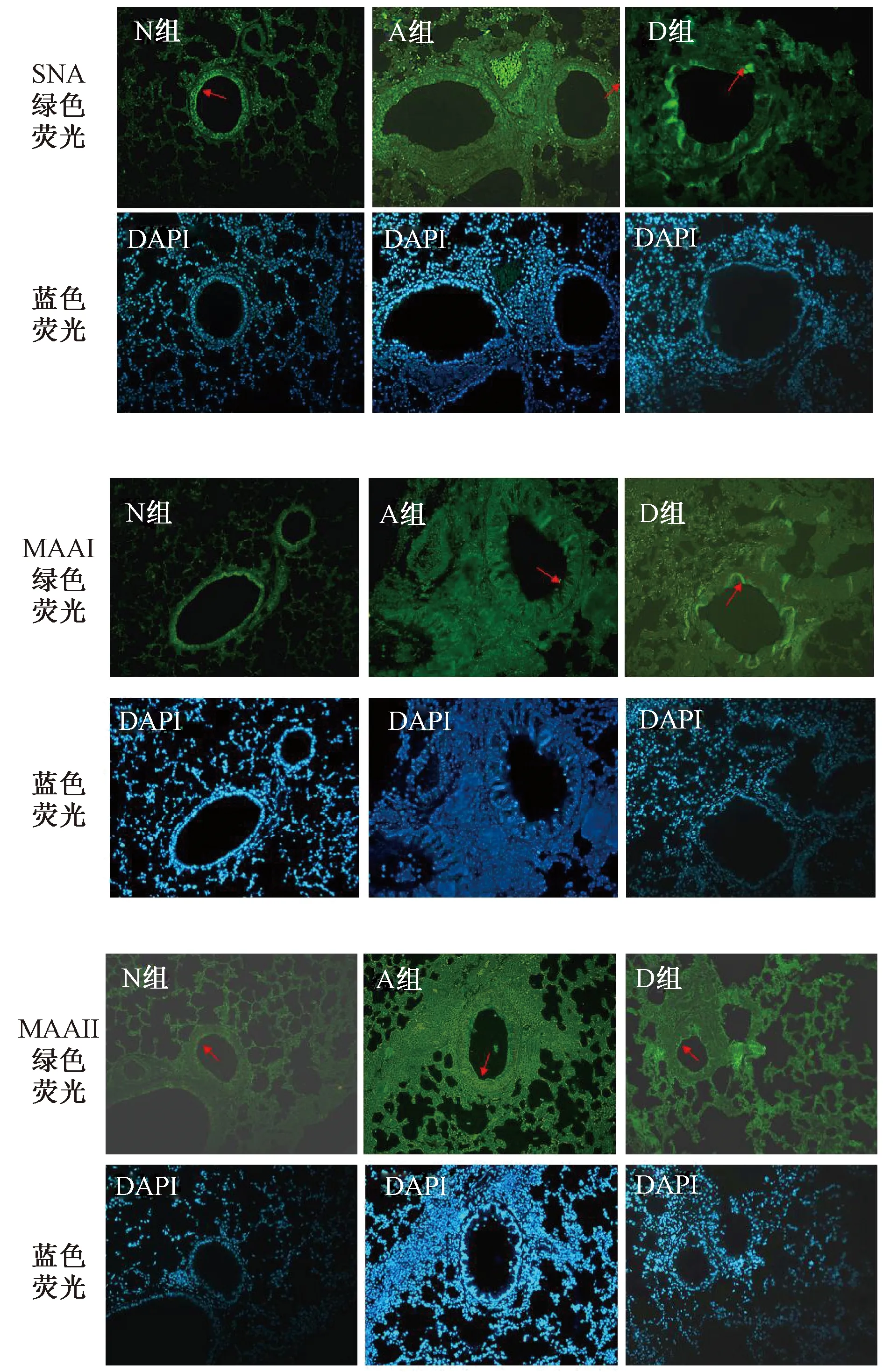
图2 免疫荧光(20×)镜下观察3种凝集素在各组小鼠气道上皮中的表达
Fig.2 Immunofluorescence (20×) observation of the expression of three lectins in airway epithelium of mice
表3甲型流感病毒唾液酸受体在各组小鼠气道组织分布的定性分析
Tab.3Qualitative Analysis of Airway Tissue Distribution of Influenza A Virus Sialoid Receptor in Each Mouse Group
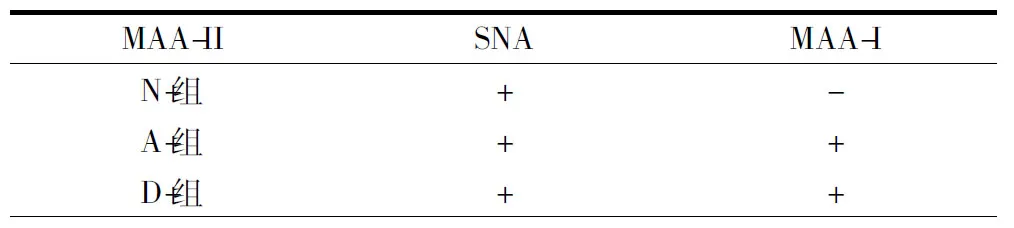
注:“-”表示阴性,“+”表示阳性.N, 正常组; A, 哮喘组; D,地塞米松干预组
Note:“-”means negative;“+”means positive. N, Normal group; A, Asthma group; D, Dexamethasone intervention group

表4 3组小鼠气道上皮阳性细胞率的变化
Tab.4Change of airway epithelial cell positive rate in the three groups of mice
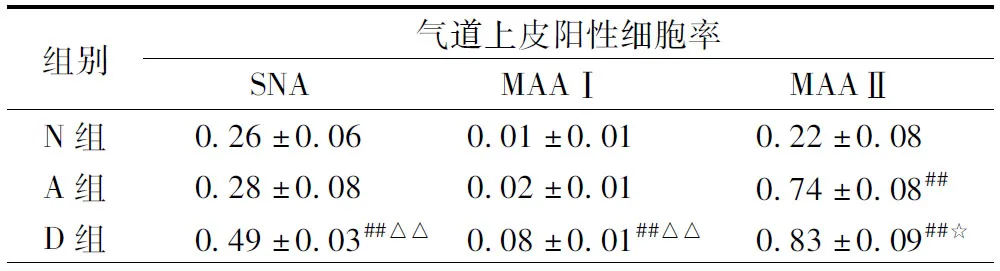
注:与N组比较,##P<0.01;与A组比较,☆P<0.05;△△P<0.01.N, 正常组; A, 哮喘组; D,地塞米松干预组
Note: Compared with N group,##P<0.01;Compared with A group,☆P<0.05;;△△P<0.01. N, Normal group; A, Asthma group; D, Dexamethasone intervention group
3 讨论
气道慢性炎症是哮喘的本质特征,嗜酸性粒细胞是参与气道炎症的重要炎性细胞,被认为几乎参与了哮喘发病机制的各个方面[2],IL-5则是嗜酸性粒细胞强力趋化因子。本研究结果显示,哮喘组BALF中细胞总数明显高于正常对照组,且细胞分类计数表明以嗜酸性粒细胞为主,与气道周围大量嗜酸性粒细胞浸润相符,ELISA结果显示BALF中IL-5水平明显增高,表明哮喘组小鼠出现典型的以嗜酸性粒细胞浸润为主的气道炎症改变。气道黏液高分泌是哮喘重要的病理生理特征之一,是哮喘发病和致死的高危因素[3]。气道黏蛋白Muc5ac表达量是反映哮喘气道黏液分泌强度的重要指标。小鼠气道组织AB-PAS染色结果提示,哮喘组气道杯状细胞增生和黏液物质分泌均高于正常对照组,IHC观察气道组织Muc5ac蛋白表达也较正常组增高,提示哮喘小鼠存在以Muc5ac增高为标志的气道上皮杯状细胞增生和黏液高分泌。因此,本研究成功构建了以气道慢性炎症和气道黏液高分泌为特征的哮喘小鼠模型。
呼吸道合胞病毒、鼻病毒等病毒所致呼吸道感染在诱发哮喘急性发作的作用已经得到足够的重视[4-5],但流感病毒感染与哮喘发病的关系常被忽视。近年来研究发现,流感病毒感染与哮喘气道炎症、气道高反应性及气道重塑均有关[6]。Kloepfer等[1]对95名哮喘患儿和66名非哮喘儿童的观察结果显示,人鼻病毒等其他呼吸道病毒在哮喘与非哮喘组患者的感染率无明显差异,而哮喘组流感病毒H1N1的感染率却是非哮喘组的两倍,其机制尚不清楚。研究表明,呼吸道上皮细胞表面的唾液酸受体(SAa2,3-gal、SAa2,6-gal)是甲型流感病毒侵入机体并进行细胞内病毒增殖的重要门户。禽和人流感病毒HA分别与SAa2,3-gal和SAa2,6-gal特异性结合,这种结合特性可能是流感病毒感染不同宿主的决定性因素[7-8]。因此,宿主呼吸道上皮细胞表面SAa2,3-gal和SAa2,6-gal的表达是流感病毒感染机体的关键。
免疫荧光技术是目前观察流感病毒唾液酸受体表达的常用方法,两种外源性植物凝集素SNA和MAA可以分别特异性结合SAa2,6-Gal和SAa2,3-Gal,其中MAA有两种异构体MAA-I和MAA-II。通过观察阳性细胞表达,可以定性分析判断受体的分布。Wang等[9]研究发现,单纯的定性分析存在一定局限性,而定量分析的方法正在受到更多研究者们的重视。
根据文献报道[10-12],MAA-I广泛结合在上、下呼吸道上皮细胞,MAA-II主要局限地结合于肺泡细胞上,由此反映a2,3唾液酸在呼吸道与肺组织的分布不同。本研究采用SNA、MAA-I、MAA-II 三种凝集素通过免疫荧光法分别观察Sa2,6-gal、SAa2,3-gal在哮喘小鼠气道组织的表达。本研究结果表明,定性分析发现SNA、MAA-II 在各组小鼠气道均呈阳性,提示正常组、哮喘组及地塞米松干预组小鼠气道组织均有SAa2,6-gal和SAa2,3-gal表达;定量分析发现,SNA、MAA-I、MAA-II在各组小鼠气道上皮均表达,正常组和哮喘组SNA、MAA-I阳性率均无明显差异,而哮喘组MAA-II阳性率较正常对照组升高,提示正常组和哮喘组两组间相应的唾液酸受体SAa2,6-gal和SAa2,3-gal的表达水平并无不同,而哮喘组气道上皮唾液酸受体SAa2,3-gal表达高于正常对照组。哮喘组与正常对照组MAA-I和MAA-II在反映SAa2,3-gal表达的不同,其可能是两种MAA与SAa2,3-gal糖苷键结合有差异,MAA-I 特异性结合 SAa2,3Galb1,4GlcNac,MAA-II特异性结合SAa2,3Galb1,3GlcNac,MAA-I与SAa2,3Galb1,4GlcNac结合力较弱;与正常组相比,哮喘组SAa2,6-gal表达无明显变化,但SA2a,3-gal表达增强。哮喘组气道上皮杯状细胞增生明显,Zhang 等[13]研究表明流感病毒感染后杯状细胞增生和SAa2,3-gal表达可能具有一定相关相关性。因此,我们推测,哮喘气道上皮增生的杯状细胞上流感病毒唾液酸受体SAa2,3-gal表达的增强,可能是导致机体对甲型流感病毒易感性增加的机制之一。
本研究定量分析结果显示,3种凝集素在地塞米松干预组的阳性细胞率均高于哮喘和正常对照组,提示地塞米松干预可上调哮喘小鼠气道流感病毒唾液酸SAa2,3-gal和SAa2,6-gal两种受体的表达,其结果可能促进流感病毒在小鼠气道上皮细胞内的复制,最终导致机体排出流感病毒的时间延长。由此推测,糖皮质激素治疗可能引起哮喘患者对流感的易感性增高。
Furuya 等[14]对宿主黏膜免疫功能方面的研究结果显示,哮喘可使继发的异源性流感病毒感染增加。此外,唾液酸拓扑结构也可能是决定流感病毒的组织和宿主趋向性的重要因素[15]。因此,在今后的实验研究中我们可采用不同来源的流感病毒来感染正常、哮喘及地塞米松干预小鼠,并观察不同流感病毒在正常、哮喘及地塞米松干预小鼠中的复制和致病性方面的差异,从而进一步深入研究流感病毒唾液酸受体的分布和表达在哮喘致流感病毒易感性升高发生机制中的作用。
利益冲突无
参考文献
[1] Kloepfer KM,Olenec JP,Lee WM,et al. Increased H1N1 infection rate in children with asthma[J]. Am J Respir Crit Care Med, 2012, 185(12): 1275-1279.DOI: 10.1164/rccm.201109-1635OC.
[2] Wegmann M. Targeting eosinophil biology in asthma therapy[J]. Am J Respir Cell Mol Biol, 2011, 45(4): 667-674.DOI: 10.1165/rcmb.2011-0013TR.
[3] Lai HY,Rogers DF. Mucus hypersecretion in asthma: intracellular signalling pathways as targets for pharmacotherapy[J]. Curr Opin Allergy Clin Immunol, 2010, 10(1): 67-76.DOI: 10.1097/ACI.0b013e328334643a.
[4] Darveaux JI, Lemanske RF Jr. Infection-related asthma. J Allergy Clin Immunol Pract. 2014,2(6):658-663. DOI: 10.1016/j.jaip.2014.09.011
[5] Matsumoto K, Inoue H. Viral infections in asthma and COPD. Respir Invest. 2014, 52(2):92-100.DOI: 10.1016/j.resinv.2013.08.005
[6] 周亮,张建勇. 支气管哮喘合并流感病毒感染的研究进展[J]. 遵义医学院学报, 2013, 36(1): 80-84.DOI: 10.3969/j.issn.1000-2715.2013.01.024.
[7] Zhang H. Tissue and host tropism of influenza viruses: importance of quantitative analysis. Sci China C Life Sci,2009,52(12):1101-1110. DOI: 10.1007/s11427-009-0161-x.
[8] 董方圆,王昕,丁小满,等.α-2,6唾液酸受体结合特异性的H7N9流感病毒的筛选[J].中华实验和临床病毒学志,2016,30(2):123-128.DOI:10.3760/cma.j.issn.1003-9279.2016.02.004.
[9] Wang B,Liu B,Chen L,et al.. Qualitative and quantitative analyses of influenza virus receptors in trachea and lung tissues of humans, mice, chickens and ducks[J]. Sci China Life Sci, 2012, 55(7): 612-617.DOI: 10.1007/s11427-012-4341-8.
[10] Nicholls JM,Bourne A J,Chen H,et al. Sialic acid receptor detection in the human respiratory tract: evidence for widespread distribution of potential binding sites for human and avian influenza viruses[J]. Respir Res, 2007, 8: 73.DOI:10.1186/1465-9921-8-73.
[11] Shinya K, Ebina M, Yamada S, et al. Avian flu: influenza virus receptors in the human airway[J]. Nature, 2006, 440(4): 435-436.DOI:10.1038/440435a.
[12] van Riel D, Munster VJ, de Wit E, et al. H5N1 virus attachment to lower respiratory tract[J]. Science, 2006, 312(5772):399.DOI:10.1126/science.1125548.
[13] Zhang S, Wei T, Tianv H, et al. Small intestinal injury in mice infected with respiratory influenza A virus: evidence for virus induced gastroenteritis.[J]. Biotechnol Lett, 2015, 37(8):1585.DOI:10.1007/s10529-015-1847-8.
[14] Furuya Y1, Roberts S1, Hurteau GJ,et al. Asthma increases susceptibility to heterologous but not homologous secondary influenza.[J]. J Virol. 2014,88(16):9166-9181.DOI: 10.1128/JVI.00265-14.
[15] Chandrasekaran A,Srinivasan A,Raman R,et al. Glycan topology determines human adaptation of avian H5N1 virus hemagglutinin[J]. Nat Biotechnol, 2008, 26(1): 107-113.DOI: 10.1038/nbt1375.

