氢氧化钠法提取镁元素的资源化利用研究★
王 倩 林冠豪 孙明明 于海琴
(1.北京交通大学土建学院,北京 100044; 2.北京交通大学土木工程国家级实验教学示范中心,北京 100044)
1 概述
当今社会,镁盐作为功能性材料的性能越来越受到重视[1],但镁元素的开发却一直以来依赖的是矿石类资源,并没有充分利用海水中的镁元素。海水中含有大量的镁元素,其含量仅次于钠元素,淡化后的浓盐水更是将海水里面的元素浓缩了近2倍,因此在海水淡化浓盐水中实现镁元素的提取利用拥有很好的经济前景。
目前海水提镁的原理主要是向海水中投加碱,使其中的镁元素以Mg(OH)2的形式沉淀下来[2-5],主要方法有氨法、钙法以及烧碱法三大类,其中钙法又包括清烧白云石法和石灰法。氨法指用氨气或氨水作为沉淀剂,去沉淀海水中的镁元素的方法,此法合成的氢氧化镁虽纯度高,但原料氨水利用率低,产品收率也低,并易对环境造成污染[6];钙法使用石灰乳做沉淀剂,虽然原料廉价易得,但产品杂质含量高、过滤工序动力、材料消耗大[7];而烧碱法使用氢氧化钠沉淀镁元素,不仅工艺简单,原料来源广泛,价格低廉,而且不引入新的杂质[8]。因此,本试验选用NaOH与Mg2+反应,提取氢氧化镁后产生的副产品,可在后续生产NaCl中被利用。
2 试验内容和方法
2.1 浓水成分
试验所用浓水取自某公司海水淡化工程一期项目,水质状况见表1。

表1 浓盐水组成(20 ℃)
2.2 试验方法
依据溶度积原理[9],采用Na2CO3做脱钙剂,制备脱钙母液。设计正交实验[10],通过改变Na2CO3的加入量与溶液中Ca2+的物质的量之比,反应温度,搅拌反应时间以及反应后静置时间对Ca2+去除率及Mg2+损失率的影响,从而确定最佳的脱钙条件。
利用在最佳脱钙条件下制备得到的脱钙母液,向其中滴加NaOH溶液,改变其物质的量、反应温度、反应时间及静置时间,考察其对Mg(OH)2产率及纯度的影响,从而得出氢氧化钠法提镁的最佳工艺方案。
2.3 分析测试方法
各成分分析监测方法见表2。

表2 成分监测方法
3 实验结果与讨论
3.1 脱钙影响因素分析
3.1.1反应物物质的量比、温度、静置时间的影响
考虑成本及Mg2+的影响,Na2CO3的添加量不宜过多,且反应时间不宜过长。因此设计了三组水平对照试验,实验结果如表3,表4所示。

表3 正交实验设计及结果分析
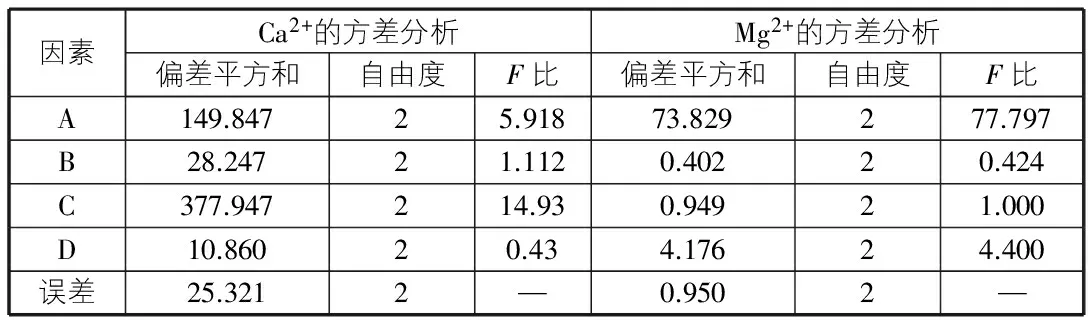
表4 Ca2+,Mg2+的方差分析
因此,在进行脱钙反应时,在保证Ca2+的去除率的条件下应控制Na2CO3的投加量,静置时间,增加反应(搅拌)时间。从实验结果看,制备脱钙母液的最佳反应条件是:Na2CO3与Ca2+的物质的量之比为1.2∶1,反应时间为6 min,反应温度为25 ℃,静置时间为30 min,可保证Ca2+去除率达90%,Mg2+损失率在12.5%左右。
3.1.2反应时间的影响
在Na2CO3与Ca2+的物质的量之比为1.2∶1,反应温度为25 ℃,静置时间为30 min,搅拌器转速为600 rpm的条件下,研究不同反应时间对Ca2+的去除率及Mg2+的损失率的影响。
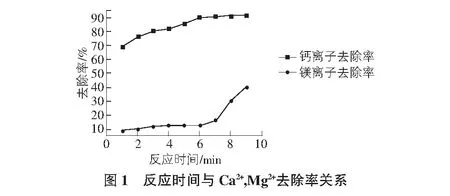

在Na2CO3与Ca2+的物质的量之比为1.2∶1,反应温度为25 ℃,搅拌器转速为600 rpm的条件下,反应时间为5 min~6 min,静置时间为30 min时脱钙效果最好。
3.2 沉淀Mg(OH)2影响因素分析
3.2.1反应物物质的量比、温度、反应时间的影响
利用最佳脱钙条件下制备得的脱钙母液(Ca2+浓度约为5.50 mmol/L,Mg2+浓度约为235 mmol/L),按照上述实验方法设计正交实验,实验结果以及方差分析见表5,表6。

表5 正交实验设计及结果分析

表6 Mg(OH)2产率方差分析
影响Mg(OH)2产率主要因素为NaOH与Mg2+物质的量之比,其次是静置时间。反应温度跟搅拌反应时间对Mg(OH)2的沉淀几乎无影响。随NaOH量的增加,Ca2+开始析出,其析出率仅与NaOH的投加量有关。NaOH的量对Mg(OH)2的影响最大,但随着NaOH的增加,Ca2+析出率增加,在NaOH与Mg2+物质的量之比为1.1∶1,析出率约为3.3%,NaOH于Mg2+物质的量之比为1.2∶1时,析出率增加到5.6%,故选择NaOH与Mg2+物质的量之比为1.1∶1最合适。
3.2.2反应静置时间的影响
静置时间为影响Mg(OH)2产量的一个重要因素,且静置时间的增加不会影响Ca2+析出量,故有必要控制NaOH与Mg2+物质的量之比为1.1∶1,探究不同静置时间对Mg(OH)2产量的影响。实验结果如图2所示。

由图2可知在NaOH于Mg2+物质的量之比为1.1∶1的条件下,Mg(OH)2产率随静置时间的增加而增加。静置时间在6 h~24 h内,Mg(OH)2产率的增长速率基本不变,超过24 h,Mg(OH)2产率的增长速率减缓。由此可见当静置时间超过24 h后,延长静置时间的收益将大大减少。因此,选择24 h为该工艺的静置时间最合适。
4 结语
1)采用Na2CO3为脱钙剂,来去除浓海水中的Ca2+不引入杂质,能提高Mg(OH)2的纯度。在投加比为1.2∶1,反应温度为25 ℃,搅拌时间为5 min~6 min,静置时间为30 min的条件下,脱钙率可达90%,镁损失率为12.5%。
2)采用NaOH为沉淀剂,Mg(OH)2的产率随OH-的增加而增加,随静置时间的增加而增加,与反应温度、搅拌时间无明显关系,控制NaOH与Mg(OH)2物质的量之比为1.1∶1;静置时间为24 h时,氢氧化镁产率可达60%,而继续增加NaOH的量及增加静置时间对产率影响逐渐减少,在实际工程中易造成资源浪费。故NaOH与Mg(OH)2物质的量之比为1.1∶1;静置时间为24 h为最佳工艺条件。
参考文献:
[1] 袁俊生,刘燕兰.大有发展前途的海洋无机盐晶须材料[J].海湖盐与化工,2000(2):5-7.
[2] 邓绍雄.海水高纯氧化镁的生产历史回顾与展望[J].海洋科学,1995,3(2):1-3.
[3] 袁俊生,韩慧茹.海水提钾技术研究进展[J].河北工业大学学报,2004,33(2):140-147.
[4] 林 源,王浩宇,周亚蓉,等.海水提溴技术的发展与研究现状[J].无机盐工业,2012,44(9):5-7.
[5] 刘立平.浓海水提溴方法及存在问题的研究[J].盐业与化工,2012,41(1):38-40.
[6] 陈向锋,黄西平,魏炳举,等.一种生产环保型氢氧化镁的新工艺[J].盐业与化工,2008,37(1):43-45.
[7] 刘玉胜,刘 翠,马培华.利用盐湖卤水制取氢氧化镁的技术探索[J].盐湖研究,2004,12(2):51-55.
[8] 宋彦梅,衣守志.氢氧化镁的生产及应用技术进展[J].海湖盐与化工(现《盐业与化工》),2002,35(2):15-20.
[9] 吴性良,朱万森,马 林.分析化学原理[M].北京:化学工业出版社,2004.
[10] 衣丽霞,董景岗.浓盐水制备高纯氢氧化镁过程中钙杂质的去除研究[J].徐州师范大学学报(自然科学版),2009(4):62-65.

