急性心肌梗死患者血巨噬细胞移动抑制因子的变化及临床意义
邓湘宁 王新宇 于海奕 陈少敏 张幼怡 杜晓军 高炜
100191 北京大学第三医院心血管内科,卫生计生委心血管分子生物学与调节肽重点实验室,心血管受体研究北京市重点实验室
巨噬细胞移动抑制因子(macrophage migration inhibitory factor,MIF)是一种通过诱导单核巨噬细胞募集,进而促进炎症细胞活化和细胞因子释放,参与体内一系列炎性病理生理过程的上游促炎因子[1]。MIF与缺血性心脏病关系紧密[1-3],急性心肌梗死(acute myocardial infarction,AMI)患者发病早期循环MIF水平即升高,且与心肌梗死面积相关[4-5]。但接受急诊经皮冠状动脉介入治疗(percutaneous coronary intervention,PCI)的ST段抬高型心肌梗死(ST-segment elevated myocardial infarction,STEMI)患者早期循环MIF水平与远期预后关系的研究尚未见报道。本研究旨在探讨STEMI患者发病早期血浆MIF水平的动态变化,并探讨其可能的临床意义及与远期预后的关系。
1 对象和方法
1.1 研究对象
本研究为前瞻性队列研究。入选2012年9月至2014年3月因STEMI[6]就诊于北京大学第三医院的患者共204例,入选标准:年龄大于18岁;发病至就诊<12 h;行急诊PCI。选取同期性别、年龄匹配的稳定性心绞痛(stable angina pectoris,SAP)[7]患者30例、健康体检者65名作为对照组。排除标准:合并心脏瓣膜病、心肌病、先天性心脏病、心原性休克;合并感染、恶性肿瘤、血液和免疫相关疾病;接受抗生素、类固醇激素及其他抗炎性药物治疗;严重肝肾功能不全;不同意参加本研究。研究方案经北京大学第三医院伦理委员会批准,审批号码:[2012]104(2)。所有入组患者均签署知情同意书。
1.2 标本采集与储存
STEMI组患者分别于就诊时、急诊PCI术后24 h和72 h抽取静脉血4 ml,SAP组患者、健康组于清晨空腹静息状态抽取静脉血4 ml。血标本用ED-TA抗凝管收集,2500 r/min离心15 min,分离血浆,冻存于-80°C冰箱。
1.3 血浆MIF及生化指标检测
MIF的测定采用美国R&D公司的ELISA试剂盒。采用全自动分析仪检测血常规、肌酸激酶同工酶MB(creatine kinase-MB,CK-MB)、高敏肌钙蛋白T(high-sensitive troponin T,hs-TnT)、N末端B型利钠肽原(N-terminal pro-brain natriuretic peptide,NT-proBNP)、高敏C反应蛋白(high-sensitivity C-reactive protein,hs-CRP)及其他生化指标。使用Cockcroft公式估算肾小球滤过率。
1.4 冠状动脉造影及超声心动图检测
STEMI患者均行急诊冠状动脉造影和PCI治疗,记录冠状动脉病变血管支数、Gensini评分、PCI术中使用替罗非班情况、术后罪犯血管TIMI血流分级和住院期间不完全血运重建情况。病变血管定义为冠状动脉管腔狭窄≥50%,不完全血运重建定义为至少1支直径≥1.5 mm的冠状动脉主支或分支血管存在≥50%的狭窄。入院72 h内行超声心动图检查,采用双平面Simpson法测量并计算左心室射血分数(left ventricular ejection fraction,LVEF)。
1.5 随访
STEMI患者出院后常规门诊或电话随访,随访周期36个月,分别记录出院后1、3和6个月以及之后每6个月的主要不良心脑血管事件(major adverse cardiovascular and cerebral events,MACCE),包括全因死亡、心脏性死亡、非致死性心肌再梗死、再次血运重建、因心力衰竭再次入院和脑卒中。首次终点事件发生即停止随访。
1.6 统计学方法

2 结果
2.1 患者一般情况
本研究共入选STEMI患者204例,男性比例为82.4%,平均年龄(59.3±13.1)岁,30例SAP患者及65名健康者经年龄、性别匹配。STEMI患者发病至就诊时间<6 h者159例(77.9%),左主干病变11例(5.4%),多支病变133例(65.2%);PCI术中使用替罗非班58例(28.4%),术后罪犯血管TIMI血流3级者196例(96.1%);住院期间不完全血运重建89例(43.6%)。SAP组吸烟比例低于STEMI组,但糖尿病患者比例更高,STEMI患者的血白细胞计数、hs-CRP显著高于其他两组,低密度脂蛋白胆固醇(LDL-C)水平显著高于健康组,其他临床指标差异均无统计学意义(均为P>0.05),见表1。
2.2 血浆MIF水平及动态变化
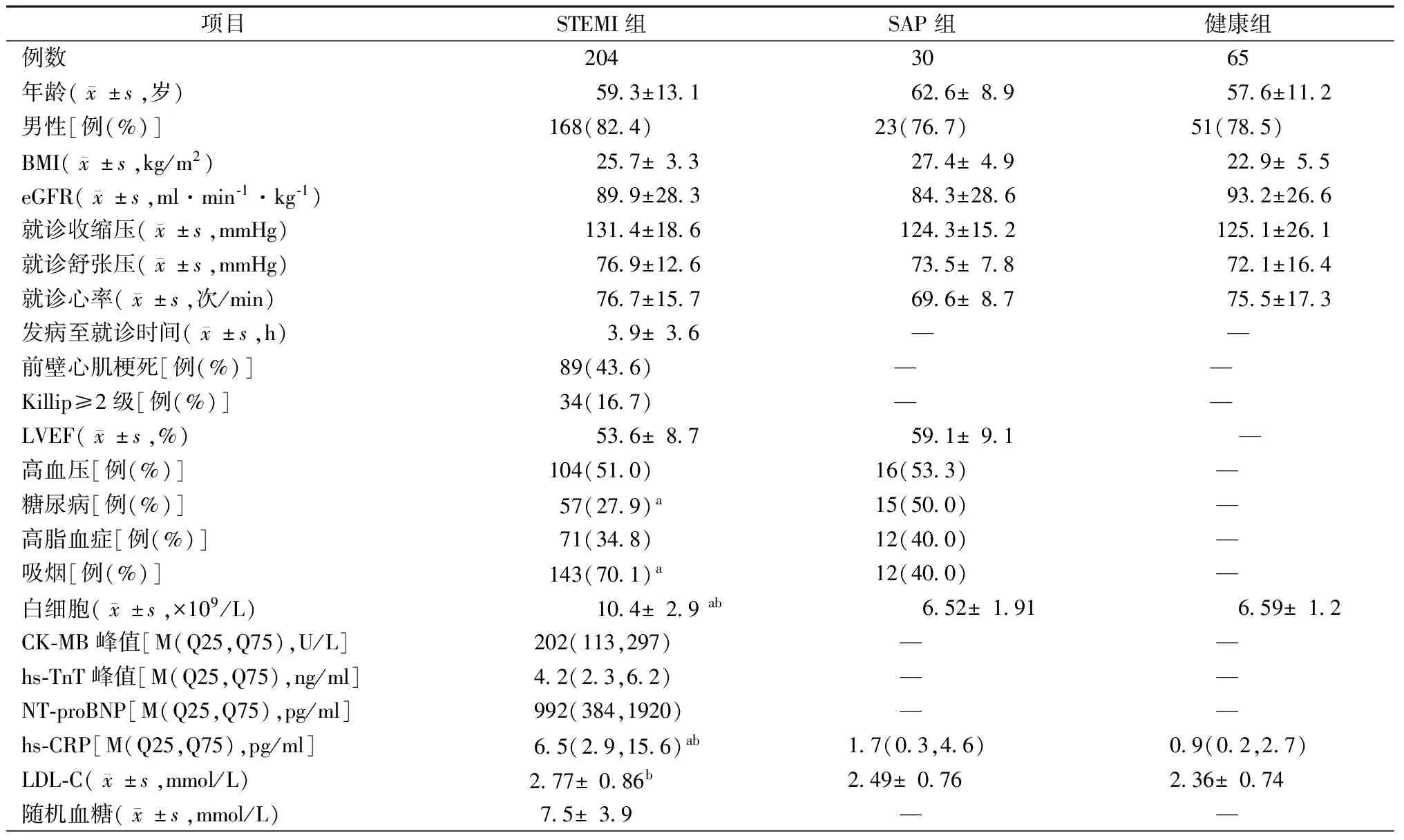
表1 3组患者的临床资料比较
注:BMI:体质指数; eGFR:估计肾小球滤过率;LVEF:左心室射血分数;CK-MB:肌酸激酶同工酶MB; hs-TnT:高敏肌钙蛋白T;NT-proBNP:N末端B型利钠肽原;hs-CRP:高敏C反应蛋白;LDL-C:低密度脂蛋白胆固醇。与SAP组比较,aP<0.05;与健康组比较,bP<0.05
STEMI患者就诊时血浆MIF水平即显著高于SAP组和健康对照组[53.1(36.4,81.9)ng/ml比 17.5(10.9,34.6)ng/ml和16.9(12.8,22.9)ng/ml,均为P<0.001],PCI术后24 h和72 h的血浆MIF水平仍维持在较高水平[53.8(40.7,67.7)ng/ml和50.8(38.9,66.0)ng/ml,均为P<0.001],但无明显动态改变(F=1.110,P=0.331,图1)。

与健康组比较,aP<0.05;与SAP组比较,bP<0.05图1 STEMI患者MIF水平变化及与对照组比较
2.3 STEMI患者血浆MIF水平与临床指标相关性
STEMI患者就诊时血浆MIF水平与年龄、性别、就诊时间、既往病史、病变血管支数、肾小球滤过率、LDL-C均不相关(均为P>0.05)。
就诊时MIF水平与CK-MB和hs-TnT峰值、Gensini评分呈正相关(r=0.439、0.316和0.257,均为P<0.001);与发病24~72 h的NT-proBNP呈正相关(r=0.241,P=0.001);与急性期LVEF呈负相关(r=-0.338,P<0.001)。PCI术后24 h和72 h的血浆MIF水平与上述指标均无显著相关性。
根据MIF中位数将STEMI患者分为就诊时MIF高水平组(≥53.1 ng/ml)和低水平组(<53.1 ng/ml)。就诊时MIF高水平组患者发生前壁心肌梗死(23.5%比9.8%,P=0.009)和Killip≥2级(52.0%比35.3%,P=0.016)的比例更高。
STEMI患者就诊时及PCI术后24 h血浆MIF水平均与发病24~72 h的hs-CRP呈正相关(r=0.173和0.148,均为P<0.05)。就诊时MIF水平与发病72 h内的白细胞、中性粒细胞和就诊时的单核细胞数呈正相关,PCI术后24 h、72 h的MIF水平与发病72 h内的单核细胞数相关,与中性粒细胞、淋巴细胞数未见显著相关性(表2)。
2.4 MIF水平与STEMI患者远期预后的相关性
对204例STEMI患者进行为期36个月临床随访,期间40例(19.6%)发生MACCE,包括全因死亡9例(4.4%),其中心原性死亡6例(2.9%),此外脑卒中12例(5.9%)、心力衰竭住院9例(4.4%)、再发心肌梗死5例(2.5%)、再次血运重建5例(2.5%)。Kaplan-Meier生存分析提示,就诊时MIF高水平(≥53.1 ng/ml)患者发生MACCE的风险高(P=0.005,图2),急诊PCI术后24 h和72 h的MIF水平与MACCE无显著相关性(均为P>0.05)。在校正了年龄、性别、肾小球滤过率、糖尿病、就诊时间、前壁心肌梗死、Killip心功能分级、三支血管病变、住院期间不完全血运重建后,就诊时MIF≥53.1 ng/ml仍是发生MACCE的独立预测危险因素(HR=2.41,95%CI:1.12~5.20,P=0.025)。
3 讨论

表2 STEMI患者血浆MIF水平与外周血炎症细胞的相关性

图2 STEMI患者MIF水平预测MACCE的生存曲线
MIF是一种具有炎性趋化因子、神经内分泌激素及酶等生物活性的多效蛋白,在心肌细胞、血管内皮细胞、炎症细胞和骨骼肌均有不同程度的表达[2],在心肌细胞MIF的基因表达水平超过骨骼肌细胞中的30倍,蛋白水平超过10倍[8]。在缺血早期,MIF能调节代谢及氧化还原反应保护心肌细胞;但随着缺血加重,MIF则会激活炎症网络并加重心肌损伤[2 -3]。本课题组[5]及Müller等[4]已分别验证了急性心肌梗死患者的就诊MIF水平能反映酶学估算或心脏磁共振成像显示的最终心肌梗死面积。本研究进一步探讨了STEMI患者血浆MIF水平的动态变化,发现就诊时MIF(近80%就诊时间<6 h)即显著升高,至发病后24~72 h仍维持高循环水平,与Yu等[9]和White等[10]的小样本研究结果大致相符。
与其他细胞因子合成分泌模式不同,MIF储存于心肌细胞胞质细胞池中,在缺血、缺氧等刺激下直接、大量、快速地释放[1-2]。本课题组前期在小鼠冠状动脉闭塞模型中发现缺血后受损心肌内的MIF含量减少约40%,免疫组化也提示了心肌细胞池内MIF染色的缺失[5]。本研究发现,就诊时血浆MIF水平不仅与酶学峰值、急性期LVEF和炎症指标相关,还与反映心功能的Killip分级、NT-proBNP和反映冠状动脉病变严重程度的Gensini评分相关;而发病后24 h和72 h的MIF水平与上述反映心肌梗死面积、心功能的临床指标均不相关,也进一步佐证了心肌梗死后MIF可能直接从坏死心肌细胞急速释放的特性。
MIF能够通过介导单核细胞趋化因子(monocyte chemoattractant protein 1,MCP-1)的表达进而促进机体单核巨噬细胞募集,刺激单核巨噬细胞分泌更多的MIF及其他炎症因子。MIF与单核巨噬细胞的相互作用,放大了心肌梗死后系统炎症反应[2,11]。White等[10]发现,STEMI患者在发病72 h时外周血单个核细胞中MIF的表达较就诊时成倍升高,提示循环中MIF可能来自单核细胞。本研究观察到,STEMI患者发病后24 h外周血单核细胞水平才升高达峰,至72 h仍无明显下降,这与其他炎症细胞计数不断下降的过程不同。心肌梗死后24~72 h的血浆MIF水平与外周血单核细胞数呈正相关,提示单核细胞可能是STEMI后使MIF保持高循环水平的重要来源。
相关研究表明,生物标记物是早期进行冠心病危险分层的重要手段[13]。本研究不仅观察到MIF与心肌梗死后炎症指标相关,还发现STEMI患者就诊时血浆MIF水平≥53.1 ng/ml是发生MACCE的独立预测因素,提示就诊时MIF不仅能协助STEMI患者的早期诊断[5],还可能具有远期MACCE的预测价值。MIF还是心脏重构和纤维化的内源性调节因子,在缺血/再灌注模型中,MIF基因敲除或使用MIF中和抗体治疗的小鼠在心肌梗死后1周,梗死区域的胶原含量减少[10,12]。有证据表明,MIF还能影响心肌梗死后非梗死区域的间质纤维化程度[14]。推测其可能的机制与炎症反应及心脏重构有关。
综上,急性STEMI患者早期血浆MIF水平持续升高,不仅与反映心肌梗死面积、心功能的指标相关,还与早期外周血单核细胞数相关。就诊时MIF高水平是远期预后不良的独立预测因素。不过,本研究样本量小,采血次数较少,尚难以完全准确地反映STEMI患者血浆MIF水平的变化趋势,有待今后进一步的研究。
利益冲突:无
参 考 文 献
[1] Zernecke A,Bernhagen J,Weber C.Macrophage migration inhibitory factor in cardiovascular disease [J].Circulation,2008,117(12):1594-1602.DOI:10.1161/ CIRCULATIONAHA.107.729125.
[2] Dayawansa NH,Gao XM,White DA,et al.Role of MIF in myocardial ischaemia and infarction:insight from recent clinical and experimental findings [J].Clin Sci(Lond),2014,127(3):149-161.DOI:10.1042/CS20130828.
[3] Tilstam P,Qi D,Leng L,et al.MIF family cytokines in cardiovascular diseases and prospects for precision-based therapeutics [J].Expert Opin Ther Targets,2017,21(7):671-683.DOI:10.1080/14728222.2017.1336227.
[4] Müller I,Müller K,Schönleber H,et al.Macrophage migration inhibitory factor is enhanced in acute coronary syndromes and is associated with the inflammatory response [J].PLoS One,2012,7(6):e38376.DOI:10.1371/journal.pone.0038376.
[5] Chan W,White D,Wang X,et al.Macrophage migration inhibitory factor for the early prediction of infarct size [J].J Am Heart As-soc,2013,2(5):e000226.DOI:10.1161/JAHA.113.000226.
[6] Antman EM,Hand M,Armstrong PW,et al.2007 Focused Update of the ACC/AHA 2004 Guidelines for the Management of Patients With ST-Elevation Myocardial Infarction:a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines:developed in collaboration With the Canadian Cardiovascular Society endorsed by the American Academy of Family Physicians:2007 Writing Group to Review New Evidence and Update the ACC/AHA 2004 Guidelines for the Management of Patients With ST-Elevation Myocardial Infarction,Writing on Behalf of the 2004 Writing Committee [J].Circulation,2008,117(2):296-329.DOI:10.1161/CIRCULATIONAHA.107.188209.
[7] 中华医学会心血管病学分会.慢性稳定性心绞痛诊断与治疗指南 [J].中华心血管病杂志,2007,35(3):195-206.DOI:10.3760/j.issn:0253-3758.2007.03.002.
Chinese Society of Cardiology of Chinese Medical Associati-on.Guideline for diagnosis and treatment of patients with chronic stable angina [J].Chin J Cardiol,2007,35(3):195-206.DOI:10.3760/j.issn:0253-3758.2007.03.002.
[8] Fan F,Fang L,Moore X,et al.Plasma Macrophage Migration Inhibitor Factor Is Elevated in Response to Myocardial Ischemia [J].J Am Heart Assoc,2016,5(7).pii:e003128.DOI:10.1161/JAHA.115.003128.
[9] Yu CM,Lau CP,Lai KW,et al.Elevation of plasma level of macrophage migration inhibitory factor in patients with acute myocardial infarction [J].Am J Cardiol,2001,88(7):774-777.DOI:10.1016/S0002-9149(01)01850-1.
[10] White DA,Su Y,Kanellakis P,et al.Differential roles of cardiac and leukocyte derived macrophage migration inhibitory factor in inflammatory responses and cardiac remodelling post myocardial infarction [J].J Mol Cell Cardiol,2014,69:32-42.DOI:10.1016/j.yjmcc.2014.01.015.
[11] Rassaf T,Weber C,Bernhagen J.Macrophage migration inhibitory factor in myocardial ischaemia/reperfusion injury [J].Cardiovasc Res,2014,102(2):321-328.DOI:10.1093/cvr/cvu071.
[12] Liehn E,Kanzler I,Konschalla S,et al.Compartmentalized protective and detrimental effects of endogenous macrophage migration-inhibitory factor mediated by CXCR2 in a mouse model of myocardial ischemia/reperfusion [J].Arterioscler Thromb Vasc Biol,2013,33(9):2180-2186.DOI:10.1161/ATVBAHA.113.301633.
[13] 余晗俏,俞章平,钟忆周,等.老年冠心病患者血清B型利钠肽和高敏C反应蛋白水平与临床预后的关系 [J].中国心血管杂志,2017,22(2):113-116.DOI:10.3969/j.issn.1007- 5410.2017.02.008.
Yu HQ,Yu ZP,Zhong YZ,et al.Serum levels of serum B-type natriuretic peptide and high sensitivity C-reactive protein in elderly patients with coronary heart disease and its clinical significance [J].Chin J Cardiovasc Med,2017,22(2):113-116.DOI:10.3969/j.issn.1007-5410.2017.02.008.
[14] Chan W,Duffy SJ,White DA,et al.Acute left ventricular remodeling following myocardial infarction:coupling of regional healing with remote extracellular matrix expansion [J].JACC Cardiovasc Imaging,2012,5(9):884-893.DOI:10.3760/j.issn:0253-3758.2007.03.002.

