TSG-6调控PI3K/Akt-Bcl-2通路影响人瘢痕疙瘩凋亡机制的研究
田小雨,李小静,李心怡,李 涛
瘢痕疙瘩是由皮肤伤害和刺激造成的,其形成过程中人瘢痕疙瘩成纤维(human keloid fibroblast,HKF)细胞数量不断增多、凋亡减少是瘢痕不断增生的细胞学基础之一[1]。前期课题组研究[2]证实肿瘤坏死因子α刺激基因6(tumor necrosis factor alpha stimulated gene-6,TSG-6 )mRNA及蛋白表达在病理性瘢痕组织中比瘢痕周围正常皮肤明显降低,差异有统计学意义。Tan et al[3]以无瘢痕愈合皮肤作对照组,发现瘢痕疙瘩中TSG-6表达水平明显降低,推测无瘢痕皮肤愈合可能与TSG-6蛋白大量表达相关。综上,诱导病理性瘢痕形成的因素之一可能是TSG-6蛋白表达不足。TSG-6的大量表达可以有效抑制病理性瘢痕形成,但作用机制尚不完全明确。该实验旨在进一步探讨TSG-6是否通过负向调控3-磷酸肌醇激酶/丝/苏氨酸蛋白激酶-B淋巴细胞瘤-2基因(phosphatidylinositol 3 kinase/protein kinase B-B cell lymphoma-2,PI3K/Akt-Bcl-2)促进HKF凋亡而抑制瘢痕疙瘩增生。
1 材料与方法
1.1材料8例组织标本来自安徽医科大学第一附属医院整形外科门诊、住院患者明确诊断,手术切除弃用的典型瘢痕疙瘩。取材标本术前均未接受药物及其他治疗且均获得本人或其监护人同意。质粒载体pLVX-puro和pLVX-shRNA1购自美国Clontech公司,由安徽医科大学微生物教研室提供大肠杆菌DH5a和293T细胞。
1.2主要试剂Transcriptor First Strand cDNA Syn-thesis Kit购自瑞士Roche公司;Trizol、Lipofectamine 2000购自美国Life Technologies公司;One Step SYBR® PrimeScriptTMRT-PCR Kit购自大连宝生物TAKARA工程有限公司;CCK-8试剂盒购自日本DOJINDO公司;Annexin V凋亡检测试剂盒及兔抗人PI3K、AKT、鼠双微基因2(murine double minute 2,MDM2)、P53、Bcl-2抗体均购自英国Abcam公司。
1.3实验方法
1.3.1HKF的原代培养及鉴定 手术取得标本后加入配置好的IV型胶原酶溶液,于37 ℃恒温振荡器震荡10 h消化标本,将HKF接种至细胞培养瓶,培养3~5 d观察细胞贴壁率达75%以上传代。细胞传至第3代时进行实验。
1.3.2构建重组慢病毒表达载体pLVX-pour-TSG-6及干扰载体pLVX-shRNA1-TSG-6 参考GenBank中TSG-6全基因扩增引物,设计上游引物为[4]:5′-GGAATTCATGATCATCTTAATTTACT-3′,下游引物为:5′-CGGGATCCTAAGTGGCTAAATC-3′。 提取HKF总RNA,逆转录成cDNA行PCR扩增。将成功扩增的PCR产物和pLVX-Puro行双酶切。再设计TSG-6干扰载体序列后设计互补序列并使之形成双链DNA片段行双酶切。扩增培养阳性克隆,依据无内毒素质粒提取试剂盒说明书提取质粒备用。
1.3.3慢病毒包装及转染、细胞分组 制备携带pLVX-Puro-TSG-6质粒的慢病毒。48 h后检测慢病毒滴度,-80 ℃冻存。同样方法将pLVX-Puro空质粒、pLVX-shRNA1-TSG-6、pLVX-shRNA1空质粒用慢病毒包装,检测后-80 ℃冻存。HKF细胞胰酶消化后接种,24 h后加入各组病毒液继续培养。1周后再感染一次,48 h后筛选。得TSG-6过表达组、TSG-6干扰组、过表达对照组、干扰对照组。提取RNA、蛋白行PCR及Western blot方法检测表达水平。
1.3.4流式细胞术检测细胞凋亡 收集细胞,加75%乙醇4 ℃固定24 h,调整细胞浓度为1×106/ml,配置Annexin V标记液和Binding Buffer,避光室温孵育15 min后加PI,余组处理同前。15~30 min内用流式细胞仪完成检测。细胞凋亡率(%)=(凋亡细胞数/正常细胞数)×100%。
1.3.5CCK-8法检测各组细胞增殖能力 调整各组细胞浓度至1×104个/ml,向96孔板每孔加入0.1 ml细胞悬液和10 μl CCK-8混匀后,培养0、24、48、72、96 h后在酶标仪上检测在450 nm波长下各组细胞的吸光度。以空白孔为对照,周围以PBS作为湿化孔,每个时间点检测6个复孔,实验重复三次取平均值。
1.3.6RT-PCR 提取各组总RNA,用表1中引物行PCR扩增。采用日本TAKARA公司One Step SYBR® PrimeScriptTMRT-PCR Kit (Perfect Real Time)试剂盒,按说明书操作,反应条件为95 ℃、45 s,95 ℃、5 s,60 ℃、30 s,共40个循环。每个样品做3个复孔。
1.3.7Western blot 采用RIPA裂解液法提取各组细胞蛋白并采用BCA试剂盒经酶标仪检测后计算出蛋白浓度,经SDS-PAGE法电泳后转膜。5%脱脂奶粉室温封闭1 h,用相应的一抗4 ℃孵育过夜;再经二抗(1 ∶10 000)室温孵育1 h,ECL显色,在化学发光成像系统中拍摄照片。β-actin做内参。


表1 RT-PCR检测所用的引物
2 结果
2.1TSG-6对HKF细胞凋亡的影响流式细胞术分析细胞凋亡情况:HKF组、过表达对照组、干扰对照组、TSG-6过表达组、TSG-6干扰组的细胞凋亡比例分别为12.57%、13.60%、13.00%、22.23%、8.13%。上调TSG-6基因对细胞凋亡有明显的促进作用。与HKF组对比,TSG-6过表达组的细胞凋亡率显著升高(P<0.05);TSG-6干扰组结果则相反(P<0.05);过表达对照组、干扰对照组、HKF组间差异无统计学意义。见图1。
2.2TSG-6对HKF细胞增殖能力的影响对各组细胞培养0、24、48、72、96 h后观察,上调TSG-6基因的表达对细胞增殖有显著抑制作用。与HKF组比较,TSG-6过表达组的细胞增殖显著减缓(P<0.05);TSG-6干扰组细胞增殖效应显著升高(P<0.05);过表达对照组、干扰对照组、HKF组间差异无统计学意义。见图2。
2.3TSG-6对HKF细胞PI3K/Akt-Bcl-2信号通路的影响与HKF组相比,TSG-6过表达组PI3K、AKT、MDM2、Bcl-2明显降低,P53显著升高(P<0.05);与HKF组相比,TSG-6干扰组PI3K、AKT、MDM2、Bcl-2显著升高,P53明显降低(P<0.05);过表达对照组、干扰对照组、HKF组间差异无意义,见图3、4。
3 讨论
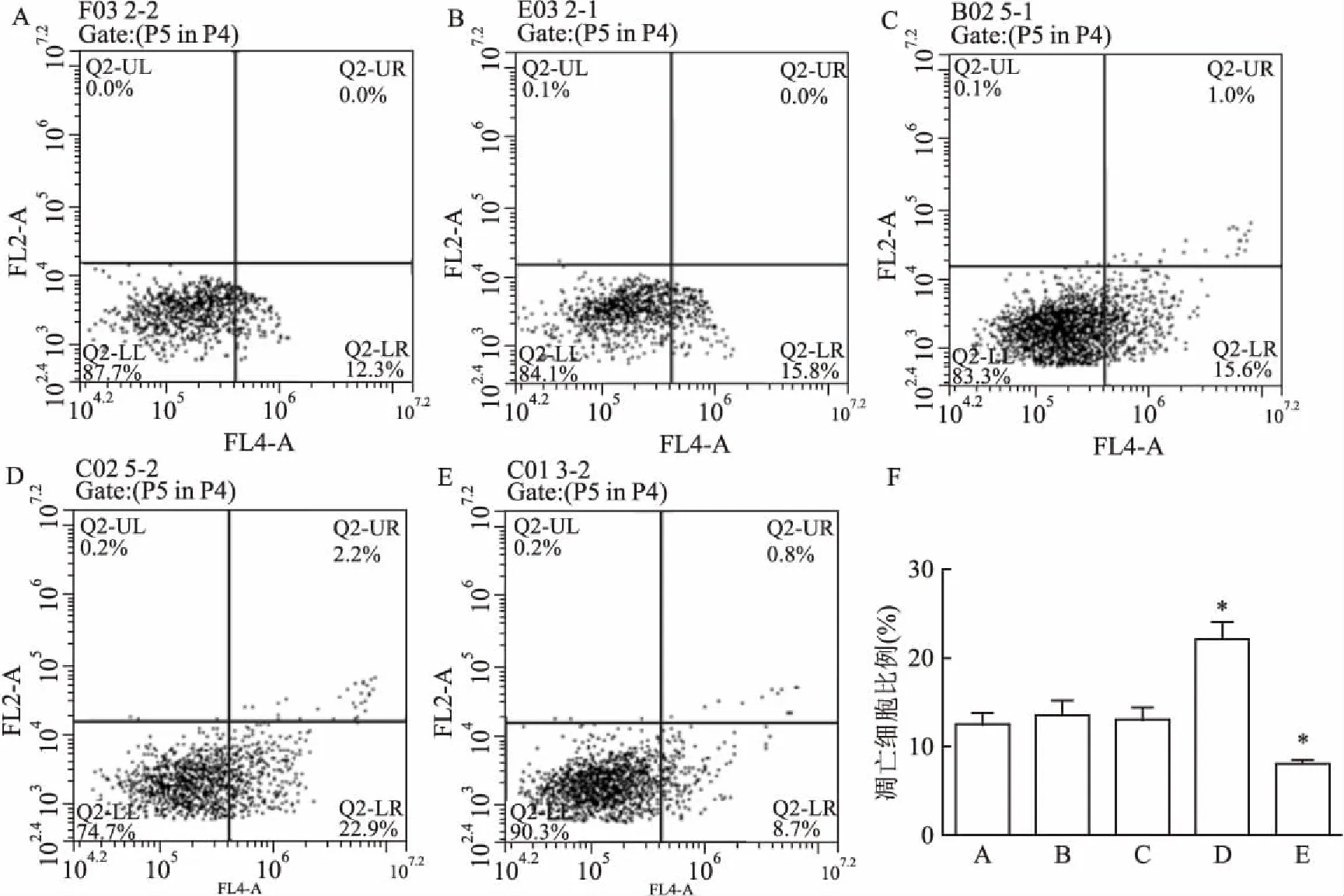
图1 流式细胞术检测细胞凋亡
A:HKF组;B:过表达对照组;C:干扰对照组;D:TSG-6过表达组;E:TSG-6干扰组;F:各组细胞凋亡百分比比较;与HKF组比较:*P<0.05
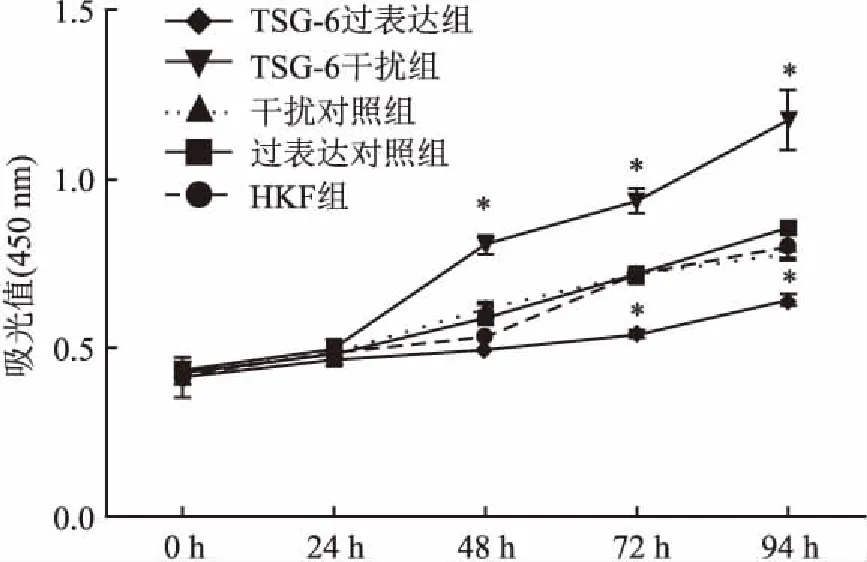
图2 CCK-8法检测各组细胞增殖能力
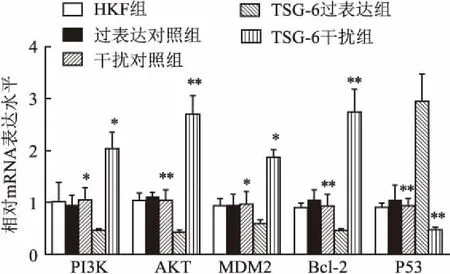
图3 RT-PCR检测PI3K、AKT、MDM2、Bcl-2、P53的mRNA表达
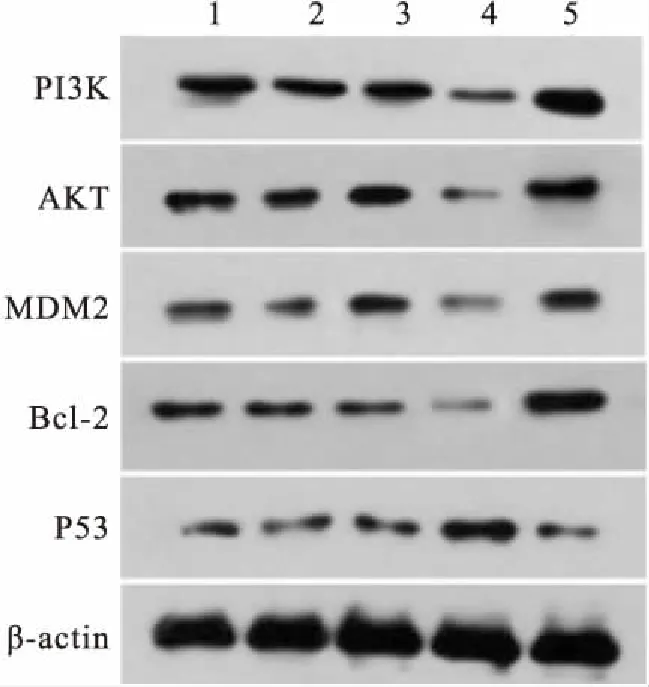
图4 Western blot检测PI3K、AKT、MDM2、Bcl-2、P53表达
瘢痕疙瘩又称为结缔组织增生症,是创面愈合后所形成的过度生长的异常瘢痕组织。病理性瘢痕所致的外观及功能障碍严重影响患者身心健康和生活质量,目前无满意治疗方案。组织学研究[5-6]显示:HKF增殖加快,进入非正常凋亡途径,因此,治疗病理性瘢痕的关键之一即使HKF增殖减缓或凋亡增快。相关研究证实,PI3K/Akt通路在所有哺乳动物细胞中存在[7],并促进HKF增殖[8]。TSG-6基因是在筛选肿瘤坏死因子α干预的人成纤维细胞cDNA表达文库时首次发现的,在人体内编码为TNFAIP6基因,该基因是一种有透明质酸结合的链域a,其编码的蛋白包含277个氨基酸,是30 ku的分泌蛋白[9]。随着研究的不断深入,已证实该基因在正常皮肤成纤维细胞中无表达,若在炎性因子的刺激下,TSG-6蛋白在成纤维细胞中的表达会增加。本实验构建TSG-6慢病毒表达、干扰载体及其对应空质粒载体并转染HKF,观察瘢痕疙瘩形成过程中TSG-6对成纤维细胞增殖和凋亡的相关性,结果显示与HKF相比,TSG-6过表达组细胞增殖减缓,凋亡率显著升高;TSG-6干扰组则相反;余组间差异无统计意义。RT-PCR、Western blot检测显示TSG-6过表达组抑制PI3K、Akt、MDM2、Bcl-2表达,促进P53表达。TSG-6干扰组促进PI3K、Akt、MDM2、Bcl-2表达,抑制P53表达;余组间差异无统计意义。
课题组前期实验研究[9]证实:TSG-6提高HKF的凋亡率效果显著。本实验运用不同方法更充分地证实这一结论。相关研究[10]证实,在兔角膜损伤模型中,将重组人TSG-6蛋白在创伤早期应用于损伤部位,可抑制白介素-6 、白介素-1β的表达及中性粒细胞浸润。在小鼠关节炎模型中,TSG-6蛋白可促使炎症局部化并减轻关节水肿和软骨、骨质损害[11]。TSG-6在结膜松弛症中也对结膜基质层及Tenon囊细胞凋亡有促进作用[12]。PI3K/Akt-Bcl-2通路在维持细胞正常生理功能中起到及其关键作用[13]。Bcl-2蛋白是B淋巴细胞瘤-2原癌基因的编码产物,是一种内膜蛋白,有关Bcl-2基因在肿瘤细胞中表达的研究较多,多项实验研究均证实其在肿瘤细胞中超正常高表达,提示该基因有抑制凋亡作用。在兔耳瘢痕模型实验中,采用免疫组织化学方法检测正常皮肤与瘢痕组织时,观察到Bcl-2蛋白在瘢痕组织中的表达阳性率明显更高,提示Bcl-2的抗凋亡作用可能与瘢痕组织中成纤维细胞富集存在关联,但具体机制不明确[14]。本实验显示TSG-6过表达组与HKF组相比,PI3K、AKT、MDM2、Bcl-2 mRNA及蛋白的表达量明显降低,P53显著升高;TSG-6干扰组则相反。而HKF组、过表达对照组以及干扰对照组组间差异无统计学意义。相关研究[15]证实PI3K被激活后,间接激活AKT, 增加其下游分子MDM2、Bcl-2的表达而抑制P53的表达。而在此实验中TSG-6作用于HKF降低了PI3K、AKT、MDM2、Bcl-2的蛋白表达,上调P53蛋白表达量。本实验提示,TSG-6在影响HKF增殖与凋亡的过程与PI3K/Akt-Bcl-2途径相关。调控细胞凋亡的多条途径是相互交织、互相关联的,而TSG-6本身具有多种诱导调控功能,且瘢痕的发生发展与皮肤损害密不可分,相关研究[16]已证实在瘢痕形成过程中NF-κB等通路也有参与,但是否与这些通路之间具有协同作用,还有待进一步研究。
参考文献
[1] Ogawa R.Keloid and hypertrophic scars are the result of chronic inflammation in the reticular dermis[J].Int Mol Sci,2017,18(3): E606.
[2] 洪学哲,李小静,宁金龙.TSG-6在病理性瘢痕中的表达及意义[J].安徽医科大学学报,2013,48(6):685-7.
[3] Tan K T,McGrouther D A,Day A J,et al.Characterization of hyaluronan and TSG-6 in skin scarring: differential distribution in keloid scars, normal scars and unscarred skin[J]. Eur Acad Dermatol Venereol,2011,25(3):17-27.
[4] Gauglitz G G, Korting H C, Pavicic T,et al. Hypertrophic scarring and keloids: pathomechanisms and current and emerging treatment strategies[J]. Mol Med, 2011, 17(1-2):113-25.
[5] van der Veer W M,Bloemen M C,Ulrich M M, et al. Potential cellular and molecular causes of hypertrophic scar formation[J]. Burns, 2009,35(1): 15-29.
[6] Kim E H,Suresh M.Role of PI3K/Akt signaling in memory CD8 T cell differentiation[J].Front Immunol,2013,4:20.
[7] 刘剑毅,李世荣.PI3K/Akt信号通路与结缔组织生长因子促人增生性瘢痕纤维化[J].重庆医学,2008,37(9):920-1.
[8] Wang H,Chen Z,Li X,et al.TSG-6 treatment promoted apoptosis in human fibroblasts of pathological scar[J].Cell Molr Biol (Noisy-le-qrand),2016,62(6):33-7.
[9] Oh J Y,Roddy G W,Choi H,et al.Anti-inflammatory protien TSG-6 reduces inflammatory damage to the comea following chemical and mechanical injury.[J]Proc Natl Acad Sci U S A,2010,107(39):16875-80.
[10] Bárdos T,Kamath R V,Mikecz K,et al. Anti-fnflammatory and chondroprotective effect of TSG-6 (tumor necrosis factor-alpha-stimulated gene-6)in murine models of experimental arthritis[J].Am J Pathol,2001,159(5):1711-21.
[11] Guo P,Zhang S Z,He H,et al.TSG-6 controls transcription and activation of matrix metalloproteinase 1 in conjunctivochalasis[J].Invest Ophthalmol Vis Sci,2012,53(3):1372-80.
[12] 慕生枝,孙要文,王国栋.下调miR-21通过PDCD4抑制人增生性瘢痕成纤维细胞增殖并抑制PI3K/Akt信号通路[J].中国美容医学,2015,24(23):39-43.
[13] Wang H,Chen Z,Li X J,et al.Anti-inflammatory cytokine TSG-6 inhibits hypertrophic scar formation in a rabbit ear model[J].Eur J Pharmacol,2015,751:42-9.
[14] Hers I,Vincent E E,Tavaré J M,Akt signalling in health and disease[J].Cell Signal,2011,23(10):1515-27.
[15] 王佳妮,李小静,李 涛,等.TSG-6促进瘢痕疙瘩成纤维细胞凋亡及其NF-κB信号通路影响的实验研究[J].安徽医科大学学报,2017,52(9):1266-70.

