厚朴酚对猪链球菌的抑制作用及对其感染巨噬细胞的影响
魏婧瑶,尤 佳,卢会奇,宋悦阳,张 玲
(锦州医科大学畜牧兽医学院,辽宁锦州 121001)
猪链球菌作为一种人畜共患病病原菌,其引发的猪链球菌病一直是困扰我国养猪业的主要传染病之一。有报道指出,从带菌猪体内分离出的猪链球菌对大环内酯类、林可酰胺类和四环素类等抗生素已产生了高度耐药性;人体内分离出的猪链球菌也对诺氟沙星产生了耐药性 (何彩美,2012)。寻找对该菌既有抗菌作用又不易产生耐药性的天然中药,将为防治猪链球菌病提供新方案,其结果势必具有重大的临床意义。厚朴酚作为中药厚朴的有效提取成分(国家药典委员会,2010),已证实对大肠杆菌、金黄色葡萄球菌、沙门氏杆菌、枯草芽孢杆菌等都有较好的抑制作用 (付云贺,2013),并且研究发现厚朴酚对猪链球菌感染的动物模型有治疗作用(张玲等,2016)。本研究体外观察厚朴酚对猪链球菌的抑制作用及对其感染巨噬细胞的影响,旨在进一步完善厚朴酚的药理作用和抗菌机制,为兽医临床挑选防治猪链球菌病的兽药提供理论依据和试验数据。
1 材料与方法
1.1 材料
1.1.1 主要仪器 SPX-250生化培养箱,购自上海跃进医疗器械厂;SW-CJ-1G超净工作台,购自苏州净化设备有限公司;Thermo science 3111型CO2细胞培养箱,赛默飞世尔科技实验室;THZ-300恒温培养摇床,上海一恒科技有限公司;Bio-Rad iMarkTM型酶标检测仪,购自美国Thermo Fisher Scientific公司。
1.1.2 主要试剂和菌种 厚朴酚(批号:563421),购自西安开来生物工程有限公司(纯度为98%),试验前,取适量甲醇将其溶解,接着用蒸馏水稀释至试验所需浓度,最后在超净台下将溶液经0.2μm微孔滤膜过滤,备用;MTT,购自美国Sigma公司;脑心浸液培养基,购自中国检验检疫科学研究院北京陆桥技术有限公司;DMEM培养基和胎牛血清(FBS),购自Gibco公司;猪链球菌2型临床分离株,从辽宁省锦州市屠宰场的50头猪病料中分离得到,并由中国兽药监察所鉴定;小鼠巨噬细胞系RAW264.7细胞株,购自中国科学院上海细胞生物学研究所。
1.2 细菌培养 取临床分离的猪链球菌菌种接种于含血清的脑心浸液固体培养基,37℃培养18~24 h,挑单个菌落接种于含血清的脑心浸液液体培养基中,再37℃静置培养13~14 h,待用。
1.3 猪链球菌生长曲线的测定 调整厚朴酚药液终浓度为50μmol/L,与猪链球菌接触后,每隔4 h取样一次,然后每孔加入5 mg/mL的MTT溶液20μL,37℃继续培养4 h后加入100μL DMSO,用酶标仪振荡10 min,在波长为580 nm处测定培养液的OD值,每个取样点重复3次,取平均值。以时间为横坐标,OD值为纵坐标,绘制不同组别的猪链球菌生长曲线。
1.4 猪链球菌细胞膜通透性的测定 调整厚朴酚药液终浓度为50μmol/L,与猪链球菌接触后,分别在培养 0、1、2、3、4、5、6、7 h 和 8 h 后取上清液,用电导仪测定其电导率值,以等体积的无水乙醇作对照。每个时间点重复3次,取平均值。
1.5 DNA、RNA等大分子物质的测定 按Chen等(2002)所述方法,测定终浓度为 50μmol/L厚朴酚溶液与猪链球菌分别接触 0、1、2、3、4、5、6、7 h和 8 h,取上清液,检测其中的DNA、RNA等大分子物质的吸光值。以不加药组为对照。重复3次,取平均值。
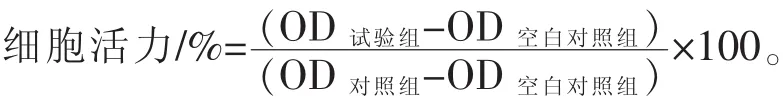
1.6 巨噬细胞细胞活性的测定 用含10%FBS的DMEM培养液调整RAW264.7浓度(1.0×106个/mL)接种到6孔板,培养过夜。将菌液浓度按感染复数(MOI)为 1∶100 的比例加入培养板,以 1000 r/min室温离心细胞培养板 5min(Wood,2001),置 37 ℃、5%CO2培养箱培养24 h,即为猪链球菌组;细胞与细菌混合后分别再加入厚朴酚,调至终浓度为 25、50、100 μmol/L,即为 25 μmol/L 厚朴酚组、50μmol/L厚朴酚组和100μmol/L厚朴酚组,继续培养24 h。按1.3中的方法,在波长为570 nm处测定各组光密度OD值,每组重复3次。将对照组的细胞活性设为100%,其他处理组OD值与对照组相比较计算其细胞活性。细胞活力按照下列公式计算:
1.7 巨噬细胞吞噬细菌数量的测定 按1.6中的方法将细胞进行分组培养。培养到期后,用PBS洗掉细胞外游离细菌,并添加青霉素至100U/mL,继续培养1 h杀灭细胞外细菌。弃上清,用细胞刮子刮取细胞,收集细胞悬液并混匀,取1 mL,以2000 r/min离心10 min,去上清,加入1 mL 0.1%Triton X-100 PBS混匀并裂解细胞20 min(Zhou等,2007)。 将混悬液(中菌落数)做 1∶10 的倍比稀释,取各稀释度10μL接种到固体培养基上,37℃培养过夜。计数平板菌落数。
1.8 炎症因子水平的测定 按1.6中方法分组培养细胞24 h,然后取细胞上清液,待测。所有试剂使用前置于室温,标准品及样品至少做三个重复,而且每次分析均做标准曲线。向每个酶标板孔中加入100μL标准品稀释液或样品,再各加入50μL抗体稀释液,封板,振荡孵育3 h。每孔加入100μL辣根过氧化物酶标记的抗生物素蛋白,封板,室温孵育30min。弃液,洗板,每孔依次加入显色剂底物TMB和终止液。反应终止后30min内读取吸光值,检测炎症因子:肿瘤坏死因子(TNF-α)、 白细胞介素-1β (IL-1β)、 白细胞介素-6(IL-6)和白细胞介素-8(IL-8)的水平。
2 结果
2.1 厚朴酚对猪链球菌生长曲线的影响 由图1可知,猪链球菌经过培养初期的迟缓生长后,快速进入对数期;而被厚朴酚干预的细菌的生长幅度则较猪链球菌组低约68.8%,差异具有显著性(P<0.05),说明厚朴酚可以显著抑制猪链球菌生长,使其不能进入对数生长期。
2.2 厚朴酚对猪链球菌细胞膜通透性的影响由图2a可知,厚朴酚作用猪链球菌后,培养液的电导率随时间增加而增大,且除0 h外,厚朴酚组各时间点的电导率较猪链球菌组均有4.2%左右的增加,具有统计学差异 (P<0.05);在厚朴酚作用后的培养液内,大分子物质的吸光值并没有与细菌组有明显差别,如图2b所示。上述结果表明,厚朴酚能够改变猪链球菌细胞膜的通透性,但并不能将其破坏,说明猪链球菌细胞膜不是厚朴酚作用的靶点。
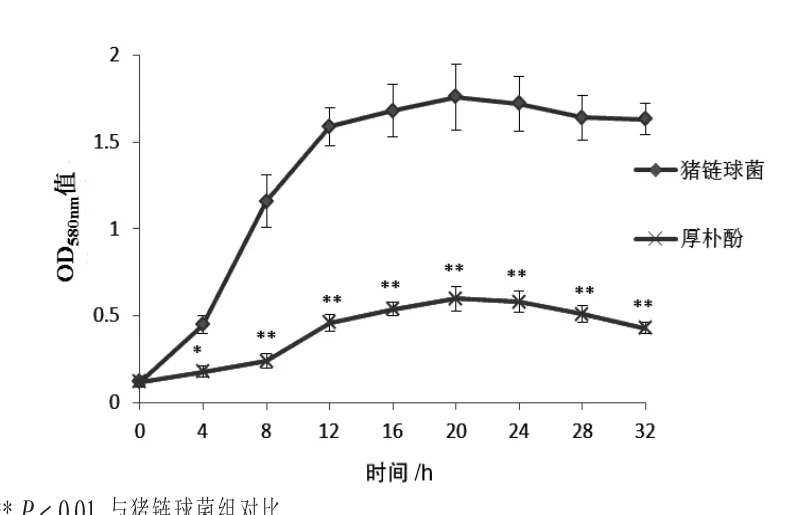
图1 厚朴酚对猪链球菌生长曲线的影响
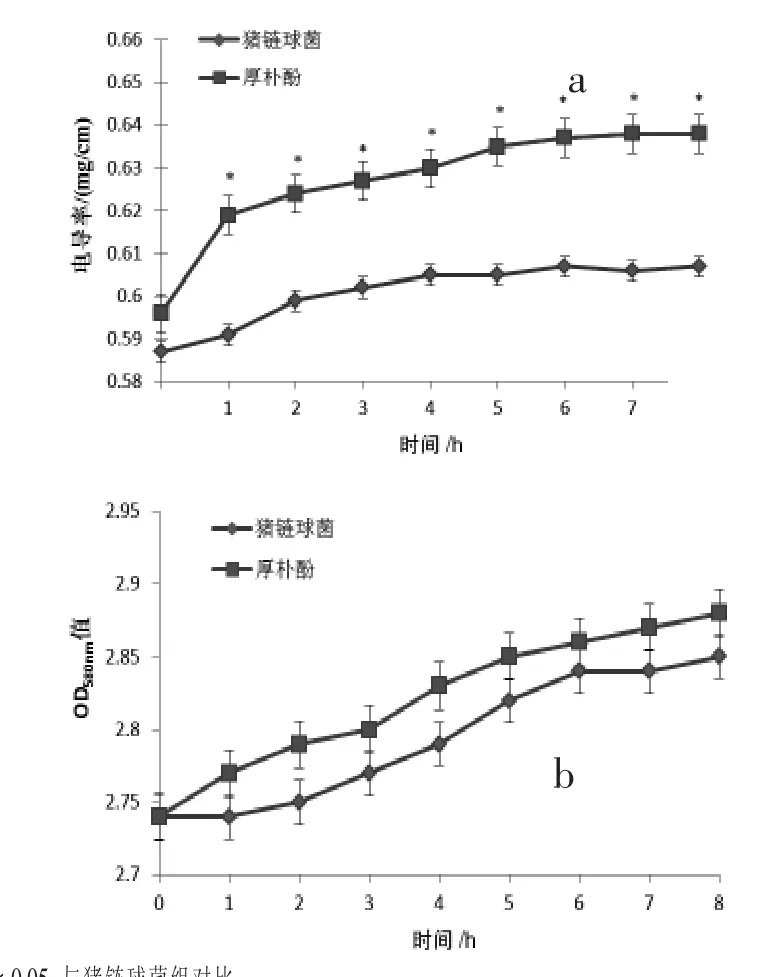
图2 厚朴酚对猪链球菌培养液电导率(a)和大分子物质吸光值(b)的影响
2.3 厚朴酚对感染猪链球菌巨噬细胞活性的影响 由图3可知,各组细胞处理24 h后,猪链球菌组的细胞活性较空白组降低38.4%(P<0.01),而三个厚朴酚处理组的细胞活性均较猪链球菌组有显著性改善(P<0.05),分别提升了9.8%、19.19%和26.8%,且细胞活性的改善与厚朴酚浓度呈正相关,但与空白组仍存在差异(P < 0.05)。
2.4 厚朴酚对染菌巨噬细胞吞噬细菌数量的影响 由表1可见,猪链球菌与厚朴酚接触后,三个用药组的巨噬细胞吞噬细菌数量较猪链球菌组分别有2倍、3倍和5倍量的增加,差异具有显著性(P<0.01),且被吞噬细菌的数量与厚朴酚的浓度呈正相关,不同药物组之间也有明显差别。
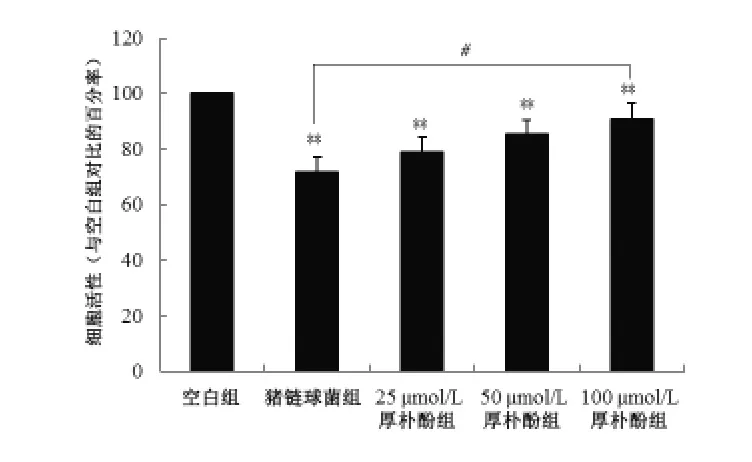
图3 厚朴酚对感染猪链球菌巨噬细胞活性的影响

表1 厚朴酚对染菌巨噬细胞吞噬细菌数量的影响(n=6)
2.5 厚朴酚对巨噬细胞炎症因子水平的影响如表2所示,猪链球菌组TNF、IL-1β、IL-6和IL-8的水平分别较空白组提高4.6倍、19.7倍、40.31倍和2.85倍(P<0.01);使用不同剂量厚朴酚干预后,炎症因子水平均较猪链球菌组有统计学意义上的下降(P<0.01),其中最大剂量100μmol/L厚朴酚组的四个炎症因子水平较猪链球菌组分别降低了65.5%、72.8%、69.5%和65.1%,但与空白组间仍有统计学差异(P<0.01);炎症因子水平随着药物浓度的增加而下降。
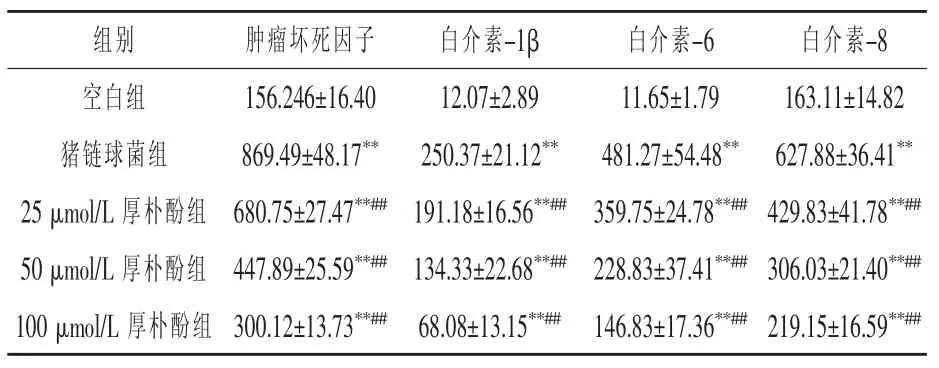
表2 厚朴酚对巨噬细胞炎症因子水平的影响 (n=3) pg/mL
3 讨论
本试验研究厚朴酚对猪链球菌的作用,发现该药可通过改变细菌细胞膜的通透性发挥抑菌作用,但对细胞膜并没有达到破坏效果,说明猪链球菌细胞膜并不是厚朴酚作用的靶点。本次研究还发现,厚朴酚可显著改善被猪链球菌感染的巨噬细胞活性,可有效提高巨噬细胞对细菌的吞噬数量(P<0.01),且这些改善效果都与药物浓度呈正相关。说明厚朴酚对猪链球菌感染的疗效与改善巨噬细胞活性和吞噬力有关。
细胞因子是固有免疫应答阶段产生的免疫效应分子,根据细胞因子的作用特点将其划分为促炎细胞因子和抗炎细胞因子。TNF-α、IL-1β、IL-6和 IL-8等促炎细胞因子可增强机体或细胞的炎症反应,其浓度变化是考察炎症发生程度和药物治疗效果的一个重要指标。受细菌或者病毒刺激的组织或细胞也通过释放促炎细胞因子诱发炎症(Tosi等,2005)。而抗炎介质,如抗炎药物及抗炎细胞因子等,在炎症发生时可通过下调促炎因子的水平,降低炎症反应(仲伟婷等,2012)。本次研究发现厚朴酚可有效下调被猪链球菌感染的巨噬细胞释放促炎细胞因子水平,与仲伟婷等(2012)的厚朴酚可下调LPS诱导细胞因子释放的结果相一致。关于厚朴酚抑制猪链球菌感染的相关作用位点和信号通路还有待进一步研究。
参考文献
[1]付云贺.厚朴酚抗炎作用及机制研究[D].长春:吉林大学,2013.
[2]国家药典委员会.中华人民共和国药典[M].一部,北京:中国医药科技出版社,2010,235.
[3]何彩美.猪链球菌型对氟喹诺酮类抗生素耐药性的机制研究[D].南宁:广西大学,2012.
[4]张玲,王金莉,高春华,等.厚朴酚对多重耐药性猪链球菌2型感染模型的影响[J].饲料研究,2016,15:1 ~ 5.
[5]仲伟婷,霍美霞,郭维霄,等.厚朴酚在体外对LPS诱导细胞因子释放及ERK通路激活的影响 [J].中国兽医学报,2012,32(1):79 ~ 82.
[6]Chen C Z,Cooper S L.Interactions between dendrimer biocides and bacterialmembrance[J].Biomaterials,2002,23:3359 ~ 3368.
[7]TosiM F,New M D,York N Y.Innate immune responsesto infection[J].JournalAllergy Clinical Immunology,2005,116:241 ~ 249.
[8]W ood GE,Dutro SM,Totten PA,et al.Haemophilusducreyi inhibits phagocytosis by U-937 cells,a human macrophage-like cell line[J].Infect Immun.2001,69(8):4726 ~ 4733.
[9]Zhou H,Kobzik L.Effect of Concentrated ambient particles on macrophage phagocytosis and killing of streptococcus pneumoniae[J].Am JRespir CellM ol Biol.2007,36(4):460 ~ 465.

