免疫诱导剂处理的黑李叶片蛋白质组学分析
张 青,肖文斐,裘劼人,陈初尉,忻 雅,柴伟国,阮松林,*
(1.杭州市农业科学研究院,浙江 杭州310024; 2.杭州市临安区农林技术推广中心,浙江 杭州 311300)
植物免疫诱导剂又称植物疫苗,主要通过激发植物自身的免疫抗性,使其产生抗菌物质,从而达到抑制病原菌的目的,具有防病、增产、改善品质等功效。免疫诱导剂可分为非生物来源和生物来源两大类。无机盐、有机酸、寡糖类、寡核苷酸、小分子多肽和免疫蛋白等为非生物源的诱导剂,而生物来源的诱导剂包括有源自植物的寡聚半乳糖、源自细菌的过敏素(harpin) 、病毒衣壳蛋白、糖蛋白类等。自2000年以来,国内外相继开发出了商品化的免疫诱导剂,如美国Eden Bioscienes公司的Messenger、Redox Chemicals公司的Oxycom、Morse公司的KeyPlex、中国科学院的壳寡糖、中国农业科学院植物保护研究所的寡糖链蛋白(阿泰灵)等[1]。近年来,杭州市农科院植物免疫诱抗剂研发团队利用含生物活性钾的免疫增效分子(IEM)与壳寡糖复合成功研制出新型高效免疫诱抗剂——保康灵1号,该制剂在水稻、玉米、葡萄、黄瓜、西瓜等作物上应用表现出抗病和促生长功效[2-5],主要表现能够促进叶片生长,增加叶片面积和厚度;提高叶绿素含量,促进光合作用增强;提高抗病性相关酶如苯丙氨酸解氨酶活性,对靶标病原菌的防效达60%~95%;提高果实产量和品质;可减施农药量30%以上,促进品质提升和食用安全性提高。
黑李属于蔷薇科李属,从美国引进,因果的颜色是紫黑色而得名,又称其为美国黑李,是美国布朗李优质品种之一,树势强旺、早结丰产,含丰富蛋白质、维生素及多种矿物质,色味极佳,既适合鲜食,又适合加工果干、果酱、蜜饯、罐头等产品,市场前景好。为了研究免疫诱导剂保康灵1号对黑李叶片生长的影响,我们检测诱导剂处理后黑李叶片的大小、厚度、叶绿素及多酚氧化酶指标,结果发现,保康灵1号处理后叶片变大变厚,叶绿素含量和多酚氧化酶活性增加,明显促进叶片生长。目前,在如桃、银杏和杏仁等其他李属物种上有关于果实软化、自交不亲和、果仁蛋白等蛋白质组学方面的报道[6-8],但在黑李的生长发育方面尚未见蛋白质组学的相关报道。但是。为了揭示免疫诱导剂保康灵1号对黑李叶片的诱导促生长作用,本文拟从形态结构、生理生化和蛋白质组学技术层次研究诱导剂保康灵1号处理后黑李叶片形态结构、生理生化及蛋白质组的变化,试图找出促长相关的功能基因及关键途径,将有助于揭示其对黑李叶片的诱导促生长机制。
1 材料与方法
1.1 实验材料
本实验以黑李品种黑宝石李为试材,在浙江省杭州市临安区秀水阔滩红梅农庄种植基地内进行。该基地黑李种植面积3 335 m2,地势平坦,土壤肥力均衡,土质为砂壤土。株龄4年,株距1 m,行距2.6 m,为拱圆式东西向连栋棚架避雨栽培,每个拱形棚宽2.6 m,顶高3.5 m,侧高1.8 m,每个拱形棚种植一行,每行35株。每年2月下旬至3月初覆薄膜进行避雨,10月下旬除去薄膜。各试验植株生长势相对一致,树势均中庸,栽培管理水平较好。免疫诱导剂保康灵1号由杭州市农业科学研究院提供。
1.2 实验方法
1.2.1 免疫诱导剂处理
自2017年4月初开始,试验设保康灵1号和清水对照处理。每一处理选取2行进行喷施,每隔15 d喷施1次,连喷3次。然后随机采集每一处理(共10株)20片叶片,对其叶片面积、叶片厚度、叶绿素含量和多酚氧化酶活性进行测定。另取10片叶片,装入离心管,置于超低温冰箱贮存备用。
1.2.2 叶片面积和厚度测定
随机选取部位相同的10张黑李叶片,重复3次,利用叶面积仪(YMJ-B,浙江托普云农科技股份有限公司)测定叶片面积,同时利用厚度仪(YH-1,浙江托普云农科技股份有限公司)测定叶片厚度。
1.2.3 叶片横切面番红固绿染色观察
(1)制作切片。固定,叶片组织于固定液中固定 3~5 d;修块,从固定液中取出组织,修整为适当的形状及厚度;脱水,组织块经过 80%、90%、95%、100%乙醇Ⅰ、100%乙醇Ⅱ、100%乙醇Ⅲ进行脱水处理;透明,二甲苯Ⅰ 30 min、二甲苯Ⅱ 20 min;浸蜡,石蜡Ⅰ1 h、石蜡Ⅱ3 h;包埋,按照取材面向下的原则,用石蜡包埋起组织,待蜡块冷却凝固后置于-20 ℃冷藏;切片,切片厚度4 μm;烤片:切片放入65 ℃恒温箱中6~12 h;保存,装盒,常温保存。
(2)番红-固绿染色。二甲苯脱蜡,梯度酒精复水,二甲苯Ⅰ20 min-二甲苯Ⅱ20 min-100%乙醇Ⅰ5 min-100%乙醇Ⅱ5 min-95%乙醇 5 min-80%乙醇 5 min-PBS洗3次,每次3 min;番红-固绿染色,0.1%番红染液染色30 min,自来水洗1 min,0.5%固绿染色1 min,自来水洗1 min;脱水、透明、封固,80%乙醇0.5 min、95%乙醇Ⅰ0.5 min、95%乙醇Ⅱ0.5 min、无水乙醇Ⅰ0.5 min、无水乙醇Ⅱ0.5 min、二甲苯Ⅰ透明3 min、二甲苯Ⅱ透明3 min,取出后用中性树胶封片,拍照。
(3)数据处理。显微镜下找到组织,随机选择3个视野拍照。用Image-Pro Plus软件测量叶片的上表皮、下表皮、栅栏组织、海绵组织的细胞和组织的整体厚度,每个样本各测量3次,结果以平均值及标准误表示。
1.2.4 叶绿素含量测定
称取黑李叶片0.25 g且重复3次,置于研钵中,加入5 mL 95%乙醇与少许石英砂,充分研磨至组织变白,再加入10 mL 95%乙醇,冲洗研钵后转至离心管内,静止3~5 min,定容至15 mL,3 000 r·min-1离心15 min,取上清液用95%乙醇定容至15 mL;取提取液1 mL,加95%乙醇4 mL,以95%乙醇为空白对照,用UV-2550型分光光度计测定波长665 nm、649 nm、470 nm下的吸光度,按公式计算叶绿素含量。
1.2.5 多酚氧化酶活(PPO)性测定
多酚氧化酶酶液的提取及活性测定参照邱德文[9]方法进行。称取0.1 g叶片,加1.5 mL磷酸缓冲液(50 mmol·L-1,pH 6.8)磨成匀浆,离心后取0.5 mL上清,加50 mmol·L-1儿茶酚1.5 mL,2 mL磷酸缓冲液,40 ℃水浴1 h,525 nm测量吸光值。以每克鲜质量每小时的D值大小表示酶活力。
1.2.6 黑李叶片总蛋白的提取
称取新鲜黑李叶片0.5 g,用液氮研磨成粉末,装入10 mL离心管中,迅速加入5 mL预冷的蛋白提取液Ⅰ(含10%三氯乙酸的丙酮溶液)进行沉淀粗蛋白(-20 ℃,1 h)期间晃匀5~6次,4 ℃下13 000 r·min-1离心20 min。取沉淀,加入10 mL预冷的蛋白提取液Ⅱ(含0.07% β-巯基乙醇的丙酮溶液)(-20 ℃,1 h)清洗,4 ℃下13 000 r·min-1离心20 min。再重复清洗2次。取沉淀,真空抽干得粗蛋白干粉。用裂解液UTC (7 mol·L-1尿素,10 mmol·L-1DTT,2 mmol·L-1EDTA,1 mmol·L-1PMSF)溶解沉淀,室温放置1 h(涡旋5~6次)。取上清得蛋白样品,用改良型Bradford法测定试剂盒(酶标法)测定蛋白浓度。
1.2.7 还原烷基化和蛋白酶解
取150 μg蛋白样品于1.5 mL EP管并加入100 mmol·L-1NH4HCO3至100 μL,加入11 μL 100 mmol·L-1的二硫苏糖醇(DTT)使其终浓度为10 mmol·L-1,适度旋涡,放于37 ℃的金属浴上反应1 h。加入12 μL 500 mmol·L-1的IAA使其终浓度为50 mmol·L-1左右,避光室温反应30 min。将上述反应液转移至超滤管中,4 ℃ 12 000 r·min-1离心15 min。弃收集管中废液,再向超滤管中加入150 μL 100 mmol·L-1NH4HCO34 ℃ 12 000 r·min-1离心15 min。重复清洗1次。更换新的收集管,超滤管中加入100 mmol·L-1NH4HCO3至总体积为100 μL,按照蛋白质量∶Trypsin=25∶1的比例加入Trypsin(1 μg·μL-1),于37 ℃金属浴上过夜(12~16 h)。然后于4 ℃ 12 000 r·min-1离心15 min,再向超滤管中加入100 μL 100 mmol·L-1NH4HCO3重复离心1次即得肽段溶液。
1.2.8 除盐
在上述肽段溶液中加入5%三氟乙酸(TFA)至其终浓度为0.1%~1.0%,使肽段酸化。将C18 tip 紧密固定在100 μL移液器上,吸取100 μL 50% 乙晴(CAN)后打出,重复一次以润湿C18填料。吸取吹打0.1%TFA 2次以平衡C18 tip。吸取吹打肽段样品50次以达到最佳吸附效果。吸取吹打0.1% TFA/5% ACN 10次以清洗肽段样品。依次缓慢吸取50 μL 0.1% TFA至50%、60%、70%、80% ACN以洗脱肽段,并将洗脱液收集到新的1.5 mL EP管中。得到终体积200 μL的样本,真空旋转抽干。加入80 μL 0.1% TFA适当涡旋溶解,转移至样品瓶中上机检测。
1.2.9 质谱数据采集
利用Easy-nano LC 1000液相仪和Q Exactive质谱仪(ThermoScientific)进行质谱分析。保护柱,Acclaim PepMap 100(75 μm内径×2 cm长,3 μm颗粒C18);分析柱,Acclaim PepMap RSLC(50 μm内径×15 cm长,3 μm颗粒C18);液相梯度,0~4min,4%~7% B;4~66 min,7%~14%B;66~88 min,14%~19%B;88~104 min,19%~34%B;104~120 min,34%~84% B(A,0.1%FA,H2O;B,0.1%FA,ACN)。喷针电压2.0 kV,毛细管温度320 ℃,S-lens 55%,碰撞能量27% HCD。分辨率设置,一级70 000@m/z 200,二级 17 500@m/z 200;母离子扫描范围 m/z 300~2 000;子离子扫描范围m/z 100。以DDA模式(Data-dependent)采集前20(TOP20)的肽段。
1.2.10 质谱数据分析
原始文件(raw file)使用 Maxquant 软件(版本1.6.0.1)进行Label-free定性和定量分析,搜索李属、蔷薇科和绿色植物等物种的蛋白数据库。具体搜库参数如下:前体离子质量偏差10×10-6;碎片离子质量偏差25 mmu ;固定修饰,半胱氨酸(Cysteine)烷基化(+57.021 Da);动态修饰,甲硫氨酸(Methionine)氧化;乙酰化(N-端);酶trypsin;漏切位点2。数据库来自 UNIPROT(http://www.uniprot.org/)。
1.2.11 差异蛋白筛选
利用Perseus软件(版本1.6.0.2)分析差异蛋白质。有效值过滤条件,最小有效值为3。采用2个样品测验:Welch test S0=2 both side;Permutation based FDR=0.01 report q-value;Number of randomizations=250;-log10(Pvalue)。数据筛选标准:-log Welch’s T-testP-value>1.3 (即Pvalue<0.05);Welch’s T-test Difference>0.585(即fold change>1.5) ;或 Welch’s T-test Difference<-0.585(即fold change<2/3)。
1.2.12 GO分类和KEGG途径分析
利用DAVID 6.8 (https://david.ncifcrf.gov/)开源软件分析GO分类和KEGG途径。参数设置:分析组件DAVID Functional Annotation Tool;阈值(minimum count)为2,EASE为0.1;显示Benjamini。根据蛋白数据库中的各蛋白GO注释,并结合其来源,人工选择鉴定所得到的蛋白最可能的细胞成分、分子功能和生物学途径,并对其进行基因富集度计算和图示化。
1.2.13 数据统计分析及作图
所有叶片形态与生理数据均采用DPS 7.0软件分析方差及显著性,百分率数据在方差分析前经反正弦平方根转换,然后通过SSR法比较处理间的差异性。所有图中直方柱上显示小写字母的显著性在0.05水平,而显示大写字母的显著性在0.01水平。本文中所有图均采用Sigmaplot 10.0软件作图获得。
2 结果与分析
2.1 免疫诱导剂与对照处理的黑李叶片表型比较分析
为了研究免疫诱导剂保康灵1号对黑李叶片表型的影响,我们比较分析免疫诱导剂与对照处理布朗李叶片大小、厚度等性状,结果发现,与对照相比,免疫诱导剂保康灵1号处理后叶片明显变大(图1-A),叶面积增加(图1-B),叶片变厚(图1-C)。进一步对叶片横切面进行观测,结果发现免疫诱导剂保康灵1号处理后叶片栅栏组织、海绵组织和下表皮明显增厚,而上表皮无明显变化(图1-D和表1),说明免疫诱导剂保康灵1号处理后叶片内栅栏组织、海绵组织和下表皮的厚度增加,从而使叶片明显变厚。
2.2 免疫诱导剂处理对黑李叶片叶绿素含量和多酚氧化酶活性的影响
为了明确免疫诱导剂保康灵1号处理后黑李叶片变化的生理生化基础,我们测定了黑李叶片叶绿素含量和多酚氧化酶活性,结果发现,与对照相比,免疫诱导剂保康灵1号处理后叶片叶绿素含量(图2-A)和多酚氧化酶活性(图2-B)明显增加,说明免疫诱导剂保康灵1号处理后具有促进黑李叶片光合作用和诱导抗病的潜在作用。
2.3 差异表达蛋白质数量分析
为了从蛋白质组学水平上揭示免疫诱导剂保康灵1号对黑李叶片促生长作用,我们对免疫诱导剂保康灵1号和对照处理黑李叶片蛋白的质谱采集数据并进行多库搜索分析,共鉴定770个蛋白质。然后利用Perseus软件,并结合Welch’s t-test筛选出157个差异蛋白(图3-A),其中上调蛋白75个(上调1.5倍且P<0.05),下调蛋白82个(下调1.5倍且P<0.05)(图3-B)。

A,叶片表型;B,叶片面积;C,叶片厚度;D,叶片横切面;a,上表皮;b,栅栏组织;c,海绵组织;d,下表皮。A,Phenotype of leaf;B,Leaf area;C,Leaf thickness;D,Blade transverse section;a,Upper epidermis;b,Palisade tissue;c,Spongy tissue;d,Lower epidermis.图1 免疫诱导剂处理与对照的黑李叶片大小和厚度比较Fig.1 Comparison of size and thickness of leaves treated with immunity inducer and control

表1 免疫诱导剂保康灵1号对黑李叶片组织厚度的影响Table 1 Effect of immunity inducer Baokangling No.1 on thickness of black plum leaf tissue
同一列不同行数据后没有相同小写字母表示差异显著(P<0.05)。
The values in the same column with different lowercase letters showed the significant difference(P<0.05).
2.4 共同差异表达蛋白质GO分类
2.4.1 差异上调表达蛋白质GO
我们对75个差异上调蛋白(或基因)进行细胞组分、分子功能及生物过程等方面的GO分类,结果发现14个差异蛋白(或基因)被富集并指定分布在6个细胞组分中,包括液泡膜(GO:0005774)、植物型细胞壁(GO:0009505)、叶绿体(GO:0009507)、甘氨酸裂解复合体(GO:0005960)、叶绿体被膜(GO:0009941)和叶绿体基质(GO:0009570)。20个差异蛋白(或基因)被富集并指定具有4种分子功能,包括钙离子结合(GO:0005509)、转录共阻遏物的活性(GO:0003714)、金属离子结合(GO:0046872)和半胱氨酸型内肽酶抑制剂的活性(GO:0004869)。有4个差异蛋白(或基因)被富集并参与2种生物过程,包括通过甘氨酸裂解系统的甘氨酸脱羧(GO:0019464)和氧脂素生物合成过程(GO:0031408)(表2)。

图2 免疫诱导剂处理与对照的黑李叶片叶绿素含量(A)和多酚氧化酶活性(B)比较Fig.2 Comparison of chlorophyll content (A) and PPO activity (B) of black plum leaves treated with immunity inducer and control

A,火山图显示的差异蛋白,浅灰色点表示上调1.5倍且P<0.05的蛋白,黑色点表示下调1.5倍且P<0.05的蛋白;B,差异上调和下调蛋白数量。A,Volcano plot of differential proteins. Light grey dots represent proteins with up to 1.5 fold and P<0.05. Black dots represent proteins with down to 1.5 fold and P<0.05; B,The number of differentially up-regulated and down-regulated proteins.图3 在免疫诱导剂处理与对照的黑李叶片中差异表达蛋白数量Fig.3 Number of differential expression proteins of black plum leaves treated with immunity inducer and control
2.4.2 差异下调表达蛋白质GO
同样,我们对82个差异下调蛋白(或基因)进行细胞组分、分子功能及生物过程等方面的GO分类,结果发现15个差异蛋白(或基因)被富集并指定分布在5个细胞组分中,包括叶绿体基质(GO:0009570)、叶绿体被膜(GO:0009941)、光系统Ⅰ(GO:0009522)、线粒体呼吸链复合体Ⅰ(GO:0005747)和非原质体(GO:0048046)。47个差异蛋白(或基因) 被富集并指定具有9种分子功能,包括氧化还原酶活性(GO:0016491)、磷酸丙糖异构酶活性(GO:0004807)、作用于酯键的水解酶活性(GO:0016788)、L-苹果酸脱氢酶活性(GO:0030060)、黄素单核苷酸结合(GO:0010181)、辅酶NADP结合(GO:0050661)、核酮糖二磷酸羧化酶的活性(GO:0016984)、丝氨酸内肽酶活性(GO:0004252)和甘氨酸羟甲基转移酶活性(GO:0004372)。有42个差异蛋白(或基因)参与11种生物过程,包括生物刺激反应(GO:0009607)、光合作用(GO:0015979)、糖酵解过程 (GO:0006096)、碳水化合物代谢过程(GO:0005975)、苹果酸代谢过程(GO:0006108)、防御反应(GO:0006952)、四氢叶酸转换(GO:0035999)、甘氨酸的代谢过程(GO:0006544)、碳固定(GO:0015977)、光呼吸作用(GO:0009853)和L-丝氨酸的代谢过程(GO:0006563)(表3)。

表2 差异上调基因GO分类Table 2 GO classification of differentially up-regulated genes

表3 差异下调基因GO分类Table 3 GO classification of differentially down-regulated genes
2.5 差异表达蛋白质的KEGG分析
2.5.1 差异上调表达蛋白质的KEGG分析
为了明确75个差异上调蛋白(或基因)功能,我们对其进行KEGG分析,结果发现有34个差异上调蛋白(或基因)被富集并指定参与10个途径,包括核苷酸切除修复 (ath03420)、甘氨酸、丝氨酸和苏氨酸代谢 (ath00260)、磷脂酰肌醇信号系统(ath04070、osa04070、gmx04070、pxb04070、mdm04070、zma04070、sot04070、zma04070)、剪接体(ath03040、sly03040)、过氧化物酶体(vvi04146、sly04146、osa04146、ath04146)、氧化磷酸化(fve00190、ath00190)、光合作用-天线蛋白(pxb00196)、光合作用(ath00195)、氨酰tRNA生物合成(vvi00970)和亚油酸代谢(mdm00591)(图4-A)。
2.5.2 差异下调表达蛋白质的KEGG分析
同样,我们对82个差异下调蛋白(或基因)进行KEGG分析,结果发现有51个差异下调蛋白(或基因)被富集并指定参与14个途径,包括乙醛酸和二羧酸代谢(ath00630)、植物-病原菌互作(ath04626)、精氨酸生物合成(osa00220)、柠檬酸循环(三羧酸循环)(ath00020)、光合作用(sly00195、sot00195、zma00195、ath00195、tcc00195、fve00195、pxb00195)、甘氨酸、丝氨酸和苏氨酸代谢(ath00260、sot00260)、过氧化酶体(zma04146、osa04146、ath04146、sly04146)、糖酵解/糖异生(ath00010、osa00010、zma00010)、嘌呤代谢(osa00230、ath00230)、淀粉和蔗糖代谢(ath00500)、内质网中蛋白质加工(rcu04141)、α-亚麻酸代谢 (osa00592)、半乳糖代谢(ath00052)和核糖体 (ath03010)(图4-B)。
3 讨论
本研究发现,免疫诱导剂保康灵1号处理后黑李叶片明显变大,叶面积增加,叶片变厚,叶绿素含量和多酚氧化酶活性增加。叶片横切面显示,诱导剂处理后叶片内栅栏组织、海绵组织和下表皮明显增厚。众所周知,叶片内叶绿体主要分布于栅栏组织和海绵组织中,因此,我们认为诱导剂处理后叶片内栅栏组织和海绵组织增厚,不仅能够引起叶片变厚,而且可能导致叶绿素含量增加。

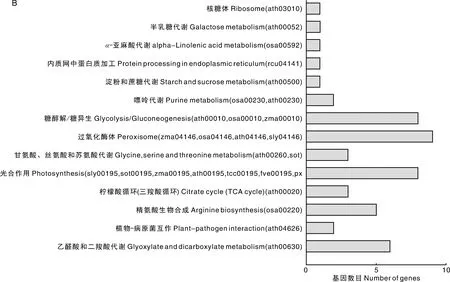
A,差异上调基因途径分析;B,差异下调基因途径分析。A,Pathway analysis of differentially up-regulated genes; B,Pathway analysis of differentially down-regulated genes.图4 差异表达基因途径分析Fig.4 Pathway analysis of differentially expressed genes
差异蛋白质组分析结果表明,无论是差异上调蛋白还是差异下调蛋白GO分类均被指定与叶绿体有关,差异上调蛋白主要分布在叶绿体、叶绿体膜和叶绿体基质中,而差异下调蛋白主要分布在叶绿体基质、叶绿体被膜和光系统Ⅰ。代谢途径分析结果表明,无论是差异上调蛋白还是差异下调蛋白均被富集并指定参与光合作用。因此,我们认为免疫诱导剂保康灵1号通过调节黑李叶片光合作用相关蛋白表达,促进叶片生长发育。除光合作用途径外,其他共同途径如甘氨酸、丝氨酸和苏氨酸代谢和过氧化物酶体也均出现在差异上调蛋白和差异下调蛋白途径分类上,只是基因及其表达程度不同,说明免疫诱导剂保康灵1号对这些途径的蛋白表达调节保持平衡。
此外,本研究还发现有4个上调蛋白β-半乳糖苷酶(M5XSN6)、紫色酸性磷酸酶(M5VQF9和M5VPK4)、α-甘露糖苷酶(M5WR08)被定位在细胞壁中,其中β-半乳糖苷酶和α-甘露糖苷酶主要参与细胞壁中糖代谢过程,可能与细胞壁结构中糖的合成与降解有关。而2个紫色酸性磷酸蛋白(M5VQF9和M5VPK4)具有金属离子结合活性,主要能够与Fe2+、Zn2+或Mn2+结合。研究表明在烟草中,NtPAP12(紫色酸性磷酸酶)对α-木糖苷酶和β-葡糖苷酶的活性起抑制作用而促进细胞壁的合成[10-12]。因此,我们推测这些蛋白表达可能与黑李叶片细胞壁合成有关。由于细胞壁合成可能与组织抗病性有关,进而推测免疫诱导剂保康灵1号上调这些蛋白的表达,促进胞壁合成,诱导黑李抗病性。有待后续试验进一步证实。
参考文献(References):
[1] 邱德文.植物免疫诱抗剂的研究进展与应用前景[J].中国农业科技导报,2014,16(1):39-45.
QIU D W. Progress and prospect of plant immunity inducer[J].JournalofAgriculturalScienceandTechnology,2014,16(1):39-45. (in Chinese with English abstract)
[2] 肖文斐,裘劼人,阮松林,等.免疫诱抗剂“保康灵1号”浸种处理对水稻苗期生长的影响[J].杭州农业科技,2017(1):28-31.
XIAO W F,QIU J R,RUAN S L,et al. Effect of soaking with immune inducer “Baokangling No.1” on the growth of rice seedling[J].HangzhouAgricultureandTechnology,2017(1): 28-31. (in Chinese)
[3] 胡伟民,肖文斐,忻雅,等.免疫诱抗剂保康灵1号对鲜食糯玉米产量和抗病性的影响[J].浙江农业科学,2016,57(4):604-606.
HU W M,XIAO W F,XIN Y,et al. Effect of immunity inducer Baokangling No.1 on yield and disease resistance of waxy maize[J].JournalofZhejiangAgriculturalSciences,2016,57(4): 604-606.(in Chinese)
[4] 沈国正,刘辉,肖文斐,等.免疫诱抗剂保康灵1号对葡萄促生长与抗病的效应[J].浙江农业科学,2016,57(8):1193-1196.
SHEN G Z,LIU H,XIAO W F,et al.Effect of immunity inducer Baokangling No.1 on grape growth and disease resistance[J].JournalofZhejiangAgriculturalSciences,2016,57(8):1193-1196. (in Chinese)
[5] 阮松林,肖文斐,忻雅,等.植物免疫诱抗剂保康灵 1 号在水稻等作物上的使用技术要点[J].杭州农业科技,2016(3):46-47.
RUAN S L,XIAO W F,XIN Y,et al.Technical points of use of Plant immunity inducer Baokangling No. 1 in rice and other crops[J].HangzhouAgricultureandTechnology,2016(3):46-47. (in Chinese)
[6] RICARDO N P,REINALDO C,ARIEL O. Assessment ofPrunuspersicafruit softening using aproteomics approach[J].JournalofProteomics,2012,75(5):1618-1638.
[7] FENG J,CHEN X,YUAN Z,et al.Proteome comparison following self-and across-pollination in self-incompatible apricot (PrunusarmeniacaL.)[J].ProteinJournal,2006,25(5):328-335.
[8] LI S,GENG F,WANG P,et al.Proteome analysis of the almond kernel(Prunusdulcis)[J].JournaloftheScienceofFood&Agriculture,2016,96(10):3351-3357.
[9] 邱德文. 蛋白质生物农药[M]. 北京:科学出版社,2010.
[10] KAIDA R,HAYASHI T,KANEKO T S.Purple acid phosphatase in the walls of tobacco cells[J].Phytochemistry,2008,69(14):2546-2551.
[11] KAIDA R,SATOH Y,BULONE V,et al.Activation of α-glucan synthases by wall.bound purple acid phosphatase in tobacco cells[J].PlantPhysiology,2009,150(4):1822-1830.
[12] KAIDA R,SERADA S,NORIOKA N,et al.Potential role for purple acid phosphatase in the dephosphorylation of wall proteins in tobacco cells[J].PlantPhysiology,2010,153(2):603-610.

