质粒介导的tet(A)突变体对肺炎克雷伯氏菌替加环素耐药的影响
荆 炜,程于梦,单新新,李德喜,姚 红,杜向党
(河南农业大学 牧医工程学院,河南 郑州 450046)
肺炎克雷伯氏菌(Klebsiellapneumoniae)是重要的条件致病菌,常引起肺炎、呼吸道感染、泌尿道感染、腹膜炎等严重医院内感染,与屎肠球菌(Enterococcusfaecium)、金黄色葡萄球菌(Staphylococcusaureus)、鲍氏不动杆菌(Acinetobacterbaumannii)、铜绿假单胞菌(Pseudomonasaeruginosa)、肠杆菌属(Enterobacter)细菌共同被美国传染病学会评定为耐药情况最严峻的6类细菌,简称ESKAPE[1]。由于抗生素的不合理使用,多重耐药肺炎克雷伯氏菌在全球范围内迅速散播,临床调查显示,它对氨基糖苷类、青霉素类、头孢菌素类、碳青霉烯类药物等呈现不同程度的耐药[2]。替加环素是继米诺环素后开发的新一代四环素类抗生素,通过可逆结合细菌核糖体30S亚基,阻断tRNA进入核糖体A位点来抑制蛋白质合成,达到抗菌目的[3]。其与核糖体的亲和力比四环素高十几倍,具有更高的抗菌活性。作为治疗多重耐药肺炎克雷伯氏菌感染的重要敏感储备药物,其耐药机制备受国内外关注。
本实验从临床分离到一株替加环素耐药的肺炎克雷伯氏菌,利用电转化、酶切、克隆、测序分析、药敏实验等方法,对其耐药机制进行研究。结果证实,tet(A)突变是导致肺炎克雷伯氏菌对替加环素耐药的重要机制,且该tet(A)突变体位于一个接合性质粒上,可加速该基因突变体的流行及传播。这一发现扩展了人们对肺炎克雷伯氏菌抗替加环素的耐药机制认识,并为该类型耐药基因的扩散控制提供了新依据。
1 材料与方法
1.1 工程菌株、载体试剂和药物
大肠埃希菌DH5α,载体PBSK由本实验室保存。替加环素购自成都思天德生物科技有限公司,米诺环素购自兰旭生物有限公司,四环素、环丙沙星、庆大霉素、头孢噻圬、氨苄西林、PremixTaq酶均购自宝生生物有限公司。DL2000 DNA Marker、DL10000 DNA Marker、λ/HindⅢ DNA Marker购自北京百泰克生物技术有限公司。细菌基因组DNA提取试剂盒购自天根生化科技有限公司。
1.2 野生菌株的分离与鉴定
根据欧盟药敏实验标准(EUCAST)推荐的替加环素最低抑菌浓度(minimal inhibition concentrations, MIC): 1 mg·L-1判定为中介,≥2 mg·L-1判定为耐药,配制含有替加环素终浓度2 mg·L-1的LB琼脂板(新鲜配制,避光)[4]。将分离得到的菌株三区划线于替加环素药板,37 ℃恒温培养12~24 h,观察菌落生长情况。
将以上分离纯化得到的细菌接种于普通培养基中培养24 h,再接种菌液于葡萄糖、乳糖、麦芽糖、甘露醇、蔗糖、枸橼酸盐、硫化氢、吲哚、尿素、硝酸盐、明胶、鸟氨酸脱羧酶、M.R、V-P等微量生化管进行生化实验。同时制备模板DNA:挑取单个菌落于LB肉汤中,37 ℃摇床培养至对数期,使用细菌基因组DNA提取试剂盒提取DNA。根据文献[5],合成16S rRNA细菌种属鉴定引物,扩增PCR,测序。
1.3 电转化实验
接200 μL菌液于300 mL LB 肉汤中,37 ℃摇床培养14 h,使用美国QIAGEN公司中提试剂盒(QIAGEN®Plasmid Midi Kit)提取野生株细菌质粒。根据文献[6]提供的方法,制备感受态细胞,将细胞按80 μL等份装入微量离心管,保存于-80 ℃备用。根据文献[7]进行电转化实验,转移转化后的细胞至替加环素(终浓度为2 mg·L-1)加药培养基中,37 ℃培养24~48 h,观察电转子。
1.4 功能性实验
提取电转子质粒:细菌电转子质粒的提取方法同1.3节,保存于-80 ℃备用。
质粒的酶切、连接与转化(克隆):用5 μLEcoRⅠ酶、5 μL 10×H Buffer与5 μL电转子质粒或5 μL PBSK载体混合,加纯水补齐至50 μL,37 ℃酶切3 h;65 ℃ 20 min 终止酶切反应;将上述酶切产物分别与2 μL SAP酶和5 μL 10×SAP Buffer混合,纯水补齐至50 μL,37 ℃ 15 min 去磷酸化;65 ℃ 15 min 终止酶切反应;将上述去过磷酸化的质粒DNA酶切产物和PBSK酶切产物一同与0.3 μL T4 连接酶、1 μL 10×T4 Buffer混合,纯水补齐至10 μL,16 ℃ 过夜连接。
连接子的电转化:方法同1.3节,转移细胞至替加环素(终浓度为2 mg·L-1)和氨苄青霉素(终浓度为128 mg·L-1)的双抗板上,37 ℃培养24~48 h,观察电转子。
1.5 连接电转子质粒的提取和测序
细菌连接电转子质粒的提取方法同1.3节。根据PBSK载体通用引物M13-F/M13-R,送至北京华大基因公司进行测序。
1.6 药敏实验
对野生菌、电转子、连接电转子、空载体、DH5α进行药敏实验,药物有环丙沙星、庆大霉素、头孢噻圬、四环素、米诺环素和替加环素,通过微量肉汤稀释法测定MICs[8]。当第12孔阴性对照无菌落生长、而第11孔阳性对照有明显生长时,读取该次实验结果。
2 结果与分析
2.1 菌株的分离和鉴定结果
分离得到一株在替加环素(2 mg·L-1)琼脂板上生长的野生菌株。生化鉴定实验显示,该菌发酵葡萄糖、乳糖、麦芽糖、甘露醇、蔗糖,不产生硫化氢,不利用枸橼酸盐,不还原硝酸盐,产生吲哚,液化明胶,鸟氨酸脱羧酶、M.R、V-P均呈阳性,与肺炎克雷伯氏菌的生化特性一致。16S PCR扩增结果如图1,测序为肺炎克雷伯氏菌,命名为kp-15-72。
2.2 野生菌株质粒的提取与电转化
从图2可以看出,对分离的替加环素耐药的肺炎克雷伯菌kp-15-72进行质粒抽提可获得多个质粒,而电转化仅得到含单一替加环素耐药质粒的电转子,该电转子命名为Tkp-1,表明引起该株肺炎克雷伯菌替加环素耐药的基因位于质粒上。
2.3 耐药基因克隆
提取电转子Tkp-1质粒进行EcoRⅠ酶切、连接、克隆、电转化等实验,得到一个含有约5 kb的克隆片段的阳性菌株,命名为DH5α[PBSK+tet(A) variant],说明肺炎克雷伯菌替加环素耐药的产生是由该5 kb的片段引起,见图3。
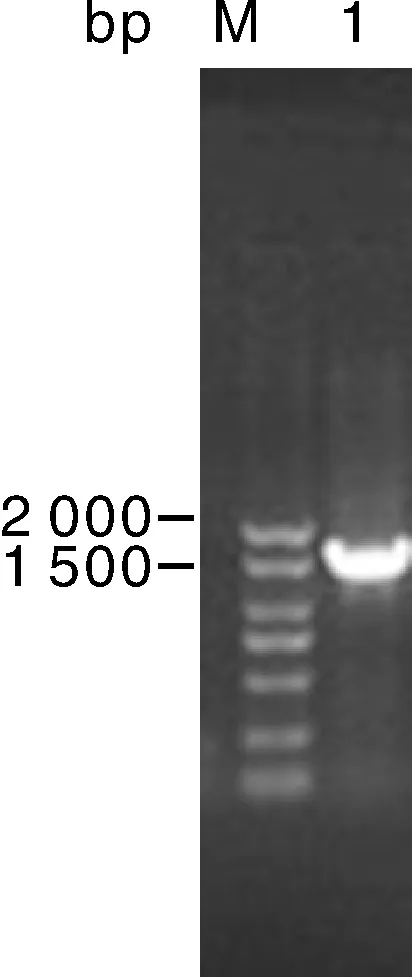
M,Marker;1,kp-15-72.图1 菌株16S PCR扩增结果Fig.1 16S PCR amplification results
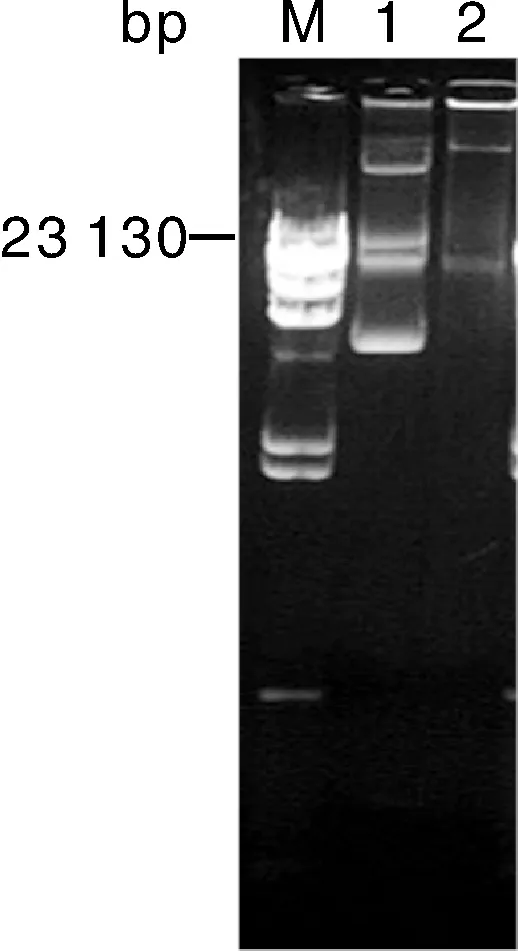
M,Marker;1,kp-15-72;2,TKP-1(电转子)。图2 野生菌及其电转子的质粒图谱Fig.2 Plasmid profiles of wild-type strains and their transformants
2.4 测序
根据PBSK载体通用引物M13-F/M13-R,对连接电转子再酶切片段进行测序,经NCBI Blast比对分析,该质粒中tet(A)基因发生了双移码突变,从野生型AGCTTCGTTC突变为GCTTCGTTCC。
2.5 药敏实验
按EUCAST标准测定野生株kp-15-72,电转子Tkp-1,DH5α[PBSK+tet(A) variant],DH5α[empty PBSK vector],DH5α对几个常用药物的药敏实验,结果如表1,说明tet(A)突变体同时贡献了对替加环素、四环素和米诺环素不同程度的耐药性。

表1 野生株kp-15-72、电转子Tkp-1、DH5α[PBSK+tet(A) variant]、DH5α[empty PBSK vector]和DH5α的药物敏感性检测Table 1 Antimicrobial susceptibility tests of wild-type strain kp-15-72,transformant Tkp-1,DH5α[PBSK+tet(A) variant],DH5α[empty PBSK vector] and DH5α
3 讨论
近几年来,肺炎克雷伯氏菌的耐药性已经超过同属肠杆菌科的大肠埃希菌,特别是自2001年美国出现第一株碳青霉烯类耐药肺炎克雷伯杆菌后,多重耐药的肺炎克雷伯氏菌很快在全世界多国家、多地区播散和流行[9]。替加环素成为仅剩的有效抗生素,且被目标性应用于治疗多重耐药肺炎克雷伯杆菌及其他碳青霉烯类耐药肠杆菌的感染病例[10]。然而随着替加环素使用的增加,世界多地出现了替加环素耐药肺炎克雷伯杆菌,使肺炎克雷伯氏菌感染陷入无药可治的困境,严重威胁人畜健康[11]。
整理与肺炎克雷伯氏菌对替加环素耐药的所有研究,主动外排系统是导致K.pneumoniae对替加环素耐药的主要机制,其中AcrAB-TolC外排泵和OqxAB外排泵上调引起的耐药最为广泛[12-16]。除此之外,Nielse等[17]和Hawser等[18]在肺炎克雷伯菌的外排泵操纵子上游发现了一个IS5插入序列,将其导入缺失kpgABC基因的菌株中,发现外排泵KpgABC表达上调使替加环素MIC值上升4倍,说明单独的KpgABC外排系统可导致肺炎克雷伯菌对替加环素的耐药水平大幅度升高。Villa等[19]和Beabout等[20]得到一株对替加环素耐药的肺炎克雷伯菌,测序显示位于核糖体30S亚基中与替加环素作用靶点相邻的S10核糖体蛋白的编码基因rpsJ发生了点突变,功能验证发现,rpsJ突变可改变替加环素结合位点附近的核糖体结构,扰乱Mg2+离子配位,导致替加环素与16S rRNA的结合减弱,敏感性下降。本研究得到一个携带tet(A)突变的质粒,药敏实验和功能实验证实tet(A)突变可导致肺炎克雷伯氏菌对替加环素低浓度耐药,且质粒有加速这种耐药传播的可能,为抗菌药耐药性风险评估和控制提供了依据。
综上所述,如何减少替加环素耐药肺炎克雷伯菌的出现,延长替加环素的使用寿命成为一个全世界关注的热点问题。对耐药机制进行深入研究,可为改进现有抗生素、开发新型抗菌药物提供新思路。鉴于替加环素在治疗多重耐药菌株肺炎克雷伯菌的重要性,迫切需要加强对替加环素耐药肺炎克雷伯菌的监测和隔离控制。
参考文献(References):
[1] PENDLETON J N,GORMAN S P,GILMORE B F. Clinical relevance of the ESKAPE pathogens[J].ExpertReviewofAnti-infectiveTherapy,2013,11(3):297-308.
[2] 康燕菲,田平芳,谭天伟. 肺炎克雷伯氏菌毒力因子的研究进展[J]. 微生物学报,2015,55(10):1245-1252.
KANG Y F,TIAN P F,TAN T W. Research progress on virulence factor ofKlebsiellapneumonia[J].JournalofMicrobiology,2015,55(10):1245-1252. (in Chinese with English abstract)
[3] 孙桂凤,陈頔,孙钊. 新一代抗菌药物替加环素的研究进展[J]. 药品评价,2014(12):21-23.
SUN G F,CHEN Y,SUN Z. Progress in the research of tigecycline,a new generation of antibacterials[J].DrugEvaluation,2014(12):21-23. (in Chinese with English abstract)
[4] European Committee on Antimicrobial Susceptibility Testing (EUCAST) Steering Committee. EUCAST technical note on tigecycline[J].ClinicalMicrobiology&Infection,2017,12(11):1147-1149.
[5] 雷正瑜. 16S rDNA序列分析技术在微生物分类鉴定中的应用[J]. 湖北生态工程职业技术学院学报,2006,4(1):4-7.
LEI Z Y. Application of 16S rDNA-sequential analysis in classification and determination of micro-organism[J].JournalofHubeiEcologyEngineeringCollege,2006,4(1):4-7. (in Chinese with English abstract)
[6] DOWER W J,MILLER J F,RAGSDALE C W. High efficiency transformation ofE.coliby high voltage electroporation[J].NucleicAcidsResearch,1988,16(13):6127-6145.
[7] 朱森康,黄磊,李燕飞,等. 制备高效大肠杆菌电转化感受态细胞和电转化条件的研究[J]. 生物技术通报,2011(10):206-209.
ZHU S K,HUANG L,LI Y F,et al. Preparation of efficient electrotransformation comptent cell ofEscherichiacoliand condition of electrotransformation[J].BiotechnologyBulletin,2011(10):206-209. (in Chinese with English abstract)
[8] European Committee for Antimicrobial Susceptibility Testing (EUCAST) of the European Society of Clinical Microbiology and Infectious Dieases (ESCMID). Determination of minimum inhibitory concentrations (MICs) of antibacterial agents by agar dilution[J].ClinicalMicrobiology&Infection,2000,6:509-515.
[9] 何建新,吴荣辉,金小珍,等. 替加环素、米诺环素、多黏菌素B对碳青霉烯类敏感性降低和不敏感肺炎克雷伯菌的体外抗菌活性[J]. 浙江医学,2015,37(21):1761-1763.
HE J X,WU R H,JIN X Z,et al. Effects of tigecycline minocycline and polymyxin B againstKlebsiellapneumoniawith decreased or no susceptibility to carbapenemsinvitro[J].ZhejiangMedical,2015,37(21):1761-1763. (in Chinese with English abstract)
[10] LIVERMORE D M. Tigecycline: what is it,and where should it be used?[J].JournalofAntimicrobialChemotherapy,2005,56(4):611-614.
[11] OLSON M W,RUZIN A,FEYFANT E,et al. Functional,biophysical,and structural bases for antibacterial activity of tigecycline[J].AntimicrobialAgents&Chemotherapy,2006,50(6):2156-2166.
[12] VELEBA M,SCHNEIDERS T. Tigecycline resistance can occur independently of theramAgene inKlebsiellapneumoniae[J].AntimicrobAgentsChemother,2012,56(8):4466-4467.
[13] ZHONG X,XU H,CHEN D,et al. First emergence of acrAB and oqxAB mediated tigecycline resistance in clinical isolates ofKlebsiellapneumoniaepre-dating the use of tigecycline in a Chinese hospital[J].PLoSOne,2014,9(12):e115185.
[14] He F,Fu Y,Chen Q,et al. Tigecycline susceptibility and the role of efflux pumps in tigecycline resistance in KPC-producingKlebsiellapneumoniae[J].PLoSOne,2015,10(3):e0119064.
[15] WANG X,CHEN H,ZHANG Y,et al. Genetic characterisation of clinicalKlebsiellapneumoniaeisolates with reduced susceptibility to tigecycline: role of the global regulator RamA and its local repressor RamR[J].InternationalJournalofAntimicrobialAgents,2015,45(6):635-640.
[16] LIN Y T,HUANG Y W,HUANG H H,et al.Invivoevolution of tigecycline-non-susceptibleKlebsiellapneumoniaestrains in patients: relationship between virulence and resistance[J].InternationalJournalofAntimicrobialAgents,2016,48(5):485-491.
[17] NIELSEN L E,SNESRUD E C,ONMUSLEONE F,et al. IS5 element integration,a novel mechanism for rapid in vivo emergence of tigecycline nonsusceptibility inKlebsiellapneumoniae[J].AntimicrobialAgents&Chemotherapy,2014,58(10):6151-6156.
[18] HAWSER S P,BOUCHILLON S K,HACKEL M,et al. Trending 7 years of in vitro activity of tigecycline and comparators against Gram-positive and Gram-negative pathogens from the Asia-Pacific region: Tigecycline evaluation surveillance trial (TEST) 2004-2010[J].InternationalJournalofAntimicrobialAgents,2012,39(6):490-495.
[19] VILLA L,FEUDI C,FORTINI D,et al. Genomics of KPC-producingKlebsiellapneumoniaesequence type 512 clone highlights the role of RamR and ribosomal S10 protein mutations in conferring tigecycline resistance[J].AntimicrobialAgents&Chemotherapy,2014,58(3):1707-1712.
[20] BEABOUT K,HAMMERSTROM T G,PEREZ A M,et al. The ribosomal S10 protein is a general target for decreased tigecycline susceptibility[J].AntimicrobialAgents&Chemotherapy,2015,59(9):5561-5566.

