精胺诱导烟草愈伤组织的研究
, , , , , , , ,
(1.广西壮族自治区烟草公司百色市公司, 广西 百色 533000; 2.广西大学农学院, 南宁 530004)
烟草的愈伤组织(callus)不仅是获得再生植株,而且是获得遗传变异,进行农艺性状改良的重要材料。同时,烟草作为植物生物技术研究的常用模式植物,其愈伤组织还是细胞生物学、分子生物学和基因学等基础研究的重要试验材料。所以,国内外涉及如何获得烟草愈伤组织的技术研究报告颇多。梳理相关研究报告可以发现:现有获得烟草愈伤组织的方法中,外植体多用叶片;基本培养基绝大多数是用MS(Murashige和Skoog,1962),偶尔有用H(Bourgin和Nitsch,1967);而诱导剂则几乎全部都是局限于两类5种植物生长物质,即生长素类(auxins)中的2,4-D(2,4-二氯苯氧乙酸),NAA(萘乙酸)和IBA(吲哚丁酸) 3种及细胞分裂素类(cytokinins)中的BA(N6-苄基腺嘌呤)和KT(激动素) 2种。而且,往往是必须同时用其中的2种,甚至是几种(生长素类和细胞分裂素类至少各1种)进行复配使用,才能达到诱导愈伤组织的效果。例如:余光辉等[1]和钟林森[2]都以MS为基本培养基,用2,4-D 2.0+KT 0.20~0.25作诱导剂获得了烟草叶片的愈伤组织;刘卫群等[3]用2,4-D 2.0+BA 0.5获得了“诱导愈伤组织的最好效果”;岳彩鹏等[4]认为MS+NAA 1.0+BA 0.5为“诱导愈伤组织的最佳配方”。实践证明,现有诱导烟草愈伤组织技术的缺陷是:外植体在诱导培养基上直接获得愈伤组织速度慢,产量低,质量差。且未见有直接用来继续诱导器官再分化的,都必须及时将愈伤组织转入由另外成分配成的专用继代培养基进行扩繁,同时还要频繁地更新继代培养基。否则,愈伤组织很快就会板结,褐化,甚至死亡。例如刘卫群等[3]是转入MS+NAA 0.1+BA 3.0;岳彩鹏等[4]则是转入MS+2,4-D 0.1+NAA 1.5+BA 0.3。显然,无论是诱导培养基,还是继代增殖培养基,从配制到使用,整体操作程序复杂费工。究其原因,显然是受制于2,4-D,NAA和IBA的毒性与残留,特别是2,4-D原本就是一种除草剂。所以探寻对外植体材料无毒无残留的新型愈伤组织诱导剂,开辟诱导烟草愈伤组织新的技术途径,是业内人士的共同愿望。
精胺(Spermine,Spm.)属于多胺类(polyamine)植物生长物质中的一种[5],是广泛存在于植物界的纯天然植物活性物质,对培养物没有毒副作用,而且作为重要的生长因子,可促进核酸、蛋白质合成与细胞分裂。莫淑媚等[6]报导Spm.可以强化LFS(灵发素)诱导罗汉果不定根的发生,使组培苗根系显得多、粗、短、壮。但是,尚未见有用Spm.作诱导剂诱导烟草愈伤组织的报告。
1 材料和方法
1.1 材 料
烟草品种为云烟97,其种子由广西区烟草公司百色市公司提供。精胺由中国医学科学院医药生物技术研究所许鸿章教授提供,重结晶品。
1.2 方 法
1.2.1 愈伤组织诱导剂的配制
依常规方法,按表1配制成7组愈伤组织诱导培养基,调pH值为5.8~6.0,灭菌,备用。
表1 烟草叶片愈伤组织诱导培养基
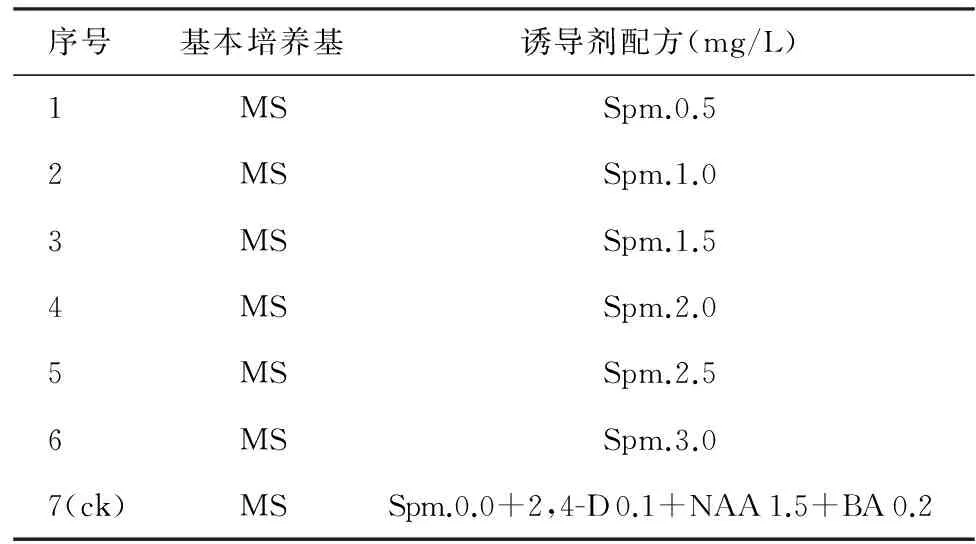
序号基本培养基诱导剂配方(mg/L)1MSSpm.0.52MSSpm.1.03MSSpm.1.54MSSpm.2.05MSSpm.2.56MSSpm.3.07(ck)MSSpm.0.0+2,4-D0.1+NAA1.5+BA0.2
注:该诱导剂配方是综合参考已有技术报告拟定。
1.2.2 叶片外植体的准备
由烟草种子先获得无菌烟草植株,当其长至5~6片叶时,自上至下取第3片叶,在无菌条件下,大约切除叶柄以上2 mm和叶尖以下2 mm的部分,再沿其主脉两侧分切成大约5 mm×5 mm的方片作烟草叶片外植体(下简称“方片”),备用。
1.2.3 愈伤组织诱导
将上述备用方片取15片,随机分为3组,每组5片。用扭力天平分别快速称其鲜重,计算每5个方片的平均鲜重FW1。其它备用方片依次接种于各组备用诱导培养基中。每组5瓶,每瓶5个方片,于实验室自然散射光下培养,温度为(27±1)℃。从第4天起,每天定时观察记录愈伤组织发生情况。培养至第10天,每组随机选3瓶,统计出愈率(%)=出愈方片数/接种叶方片数×100%,不论方片污染与否及出愈多少,记录每组的平均出愈率。培养至第20天终止试验,每组随机选定3瓶无污染者,除统计平均出愈率外,以瓶为单位统计:褐变率(%)=出愈方片褐变数/ 出愈方片数×100%;褐变程度:以“+”多少表示;板结率(%)=愈伤组织紧实难以增殖分化的方片数/出愈方片数×100%。最后小心去除培养基,称取培养物(含方片及其愈伤组织和附生物,无论褐化板结与否)的总鲜重FW2。计算平均每瓶愈伤组织净增鲜重(产量,g)FW=FW2-FW1。本试验做3次重复,最后记录3次重复的平均值。
2 结果与分析
从表2可见: 1) 在基本培养基(MS)、外植体和培养条件都相同的情况下,培养10 d,在传统诱导剂ck组中方片出愈率仅为33.3%,而在Spm.各组出愈率达46.7%~93.3%,为ck组的1.4~2.8倍。培养20 d终止试验时,ck组出愈率为73.3%,Spm.各组则达到80%~100%。2) 培养20 d,ck组平均每瓶愈伤组织净重FW为2.70 g,而Spm.各组可达3.16~8.29 g,相当于ck组的1.2倍至3.1倍。从而证明,Spm.作烟草愈伤组织诱导剂比之前常用诱导剂出愈早,生长快,产量高。
表3显示:ck组愈伤组织褐化、板结比较严重,致其生长慢,产量低,质量差。这可能与2,4-D等成分的
表2 不同烟草叶片愈伤组织诱导剂的出愈率和产量对比
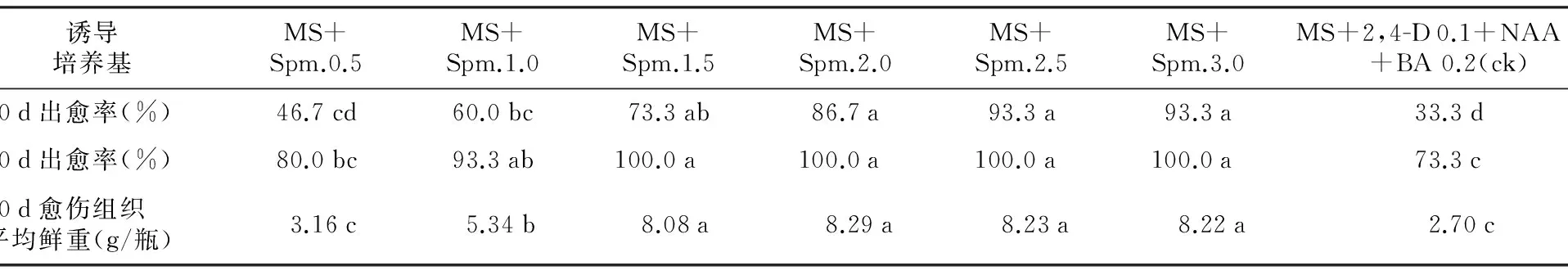
诱导培养基MS+Spm.0.5MS+Spm.1.0MS+Spm.1.5MS+Spm.2.0MS+Spm.2.5MS+Spm.3.0MS+2,4-D0.1+NAA1.5+BA0.2(ck)10d出愈率(%)46.7cd60.0bc73.3ab86.7a93.3a93.3a33.3d20d出愈率(%)80.0bc93.3ab100.0a100.0a100.0a100.0a73.3c20d愈伤组织平均鲜重(g/瓶)3.16c5.34b8.08a8.29a8.23a8.22a2.70c
注:数据后的不同小写字母表示处理间达到5%的显著差异水平。下同。
表3 不同诱导剂诱导烟草叶片愈伤组织的质量对比

诱导培养基MS+Spm.0.5MS+Spm.1.0MS+Spm.1.5MS+Spm.2.0MS+Spm.2.5MS+Spm.3.0MS+2,4-D0.1+NAA1.5+BA0.2(ck)20d褐变率(%)66.7a35.7b33.3b0.0c0.0c0.0c83.3a20d褐变程度+++————+++++20d板结率(%)41.7a13.3b0.0b0.0b0.0b0.0b55.6a
毒性累积有关。Spm.各组褐化、板结轻微,甚至没有,所以出愈早,增殖快、产量高,质量优。这为后续诱导器官再分化打下了良好基础。综合表2和表3可以看出,Spm.作为烟草叶片愈伤组织的诱导剂,适宜添加浓度为2.0~3.0 mg/L,最佳浓度为2.0 mg/L。
需要特别说明的是,用Spm.配制的烟草愈伤组织诱导培养基,还可直接用于愈伤组织的继代培养,进行增殖扩繁,无需再另配专用继代培养基,实际是一基多用,能显著提高整体工作效率。
3 讨 论
本研究证明Spm.能诱导烟草叶片愈伤组织的发生。但是李琳[5]的研究却证明,Spm.对半枝莲愈伤组织的诱导没有促进作用。这2种不同的结果,可能是因为不同种类的作物,对Spm.的生理反应不同所致。若继续求证,需要用更多种类的植物进行广泛试验研究才能得到规律性的结果。
4 结 论
用Spm.配制烟草愈伤组织诱导培养基,成分简单易于配制,诱导愈伤组织速度快,产量高,质量好,且一基多用,显著提高整体工作效率。适宜添加浓度为2.0~3.0 mg/L,最佳浓度是2.0 mg/L。
参考文献:
[1]余光辉,梅刘娟,余刘卉,等.烟草光能兼养型愈伤组织的诱导和培养条件[J].中南民族大学报(自然科学版),2012,31(2):42-44.
[2]钟林森.3个烟草品种愈伤组织诱导的比较[J].安徽农业科学,2011,39(27):16 494-16 495.
[3]刘卫群,刘巧真,石永春,等.烟草K 236叶片愈伤组织诱导及继代的初步研究[J].安徽农业科学,2006,34(2):263-266.
[4]岳彩鹏,李品,黄象男,等.烟草愈伤组织的诱导及悬浮培养体系的建立[J].烟草科技,2007(10):56-59.
[5]李合生主编.现代植物生理学(第2版)[M].北京:高等教育出版社,2007:230.
[6]莫淑媚,周凤珏,许鸿源,等.精胺(Spm.)对灵发素(LFS)诱导罗汉果不定根形成的影响[J].种子,2015,34(11):11-13.
[7]李琳.不同培养条件对半枝莲愈伤组织诱导及总黄酮积累的影响[D].南京师范大学,2016.

