实时剪切波弹性成像测量脾脏硬度评价肝硬化门静脉高压
王 鹏,唐少珊,任卫东
(中国医科大学附属盛京医院超声科,辽宁 沈阳 110004)
食管静脉曲张破裂出血和肝性脑病是失代偿期肝硬化的严重并发症,而门静脉高压(portal hypertension, PH)是导致食管静脉曲张破裂出血和肝性脑病的主要原因,因此监测肝硬化患者门静脉压力,对预防食管静脉曲张破裂出血尤为重要。目前主要采用肝静脉压力梯度(hepatic venous pressure gradient, HVPG)测定、上消化道内镜和造影等检查监测肝硬化患者的门静脉压力,但均有创、操作复杂且受检者耐受性差,对于服用门静脉降压性药物、外科或介入手术治疗后需多次监测并评估疗效的患者更难实施。研究[1]发现脾脏的解剖和血供特点与肝硬化门静脉高压密切相关,即脾脏弹性也可间接反映肝硬化时门静脉高压的情况。目前已有采用瞬时弹性弹性成像(transient elastrography, TE)、实时组织弹性成像(real-time tissue elastography, RTE)和声辐射力脉冲成像(acoustic radiation force impulse imaging, ARFI)等技术测量脾脏弹性评价肝硬化门静脉高压的相关研究[2-5]。实时剪切波弹性成像(shear wave elastography, SWE)技术通过检测组织的硬度反映组织病理生理状态,已用于对各种疾病的诊断,与其他超声弹性技术相比,SWE有其独特优点[6]。本研究采用SWE测量脾脏的弹性,探讨SWE测量脾脏硬度对肝硬化门静脉高压患者的诊断价值。
1 资料与方法
1.1 一般资料 收集2015年3月—2017年1月我院乙型肝炎肝硬化合并门静脉高压患者64例(PH组),男35例,女29例,年龄25~75岁,平均(54.3±10.4)岁。纳入标准为符合《慢性乙型肝炎防治指南(2015更新版)》[7],且参照Bayraktar等[8]标准,符合以下2项及以上标准并诊断为门静脉高压:①巨脾(超声检查脾脏长轴>13 cm);②血小板计数<100×109/L和/或白细胞计数<4.0×109/L(连续重复测量3次以上);③超声测量门静脉宽度>14 mm或脾静脉宽度>10 mm;④上消化道内镜或造影检查发现食管静脉曲张;⑤存在腹腔积液或胃底静脉曲张。排除标准:伴脂肪肝、糖尿病、心血管系统疾病等基础疾病者;接受门静脉高压的药物性、介入或外科等方法治疗;SWE多次测量脾脏硬度不成功。
收集同期无门静脉高压的乙型肝炎肝硬化患者62例为对照组,男37例,女25例,年龄20~68岁,平均(49.5±8.6)岁。纳入标准:符合上述乙型肝炎肝硬化的诊断标准;组织学或临床提示存在肝硬化的证据;病因学明确的乙型肝炎病毒感染证据。排除其他常见引起肝硬化的病因如丙型肝炎病毒感染、酒精性或药物性等。
1.2 仪器与方法 采用Surpersonic Aixplorer彩色多普勒超声诊断仪,SC6-1型凸阵探头,频率1~6 MHz。检查前空腹8 h左右。检查时嘱患者仰卧,左臂上抬置于头部,充分暴露左侧肋间隙。将探头置于左侧腋后线9~11肋间隙,使二维超声图像同时显示脾门及脾脏最大切面,测量脾脏厚度(脾门至对侧缘距离)和脾脏长径(脾脏上下端的距离)。嘱患者屏气,启动SWE,彩色标尺量程范围设置为0~70 kPa,SWE取样框(系统默认最大值4 cm×4 cm,扇形)避开脾内的管道结构,当弹性图像稳定5~6帧,且取样框内基本充满颜色、无噪声时,冻结图像并存储。蓝色表示组织硬度偏软,红色表示组织硬度偏硬。启动Q-BOX测量,在成像区域内选取直径为1.5 cm圆形ROI,记录杨氏模量平均值(SWE_mean),作为脾脏弹性值,单位为kPa。经3次独立采集弹性图像基本一致时,认为检查成功。所有测量均重复3次,取均值。如反复5次弹性成像测量不成功,则予以剔除。
1.3 统计学分析 采用SPSS 20.0和MedCalc 15.2统计分析软件。计量资料的正态性分析采用Kolmogrov-Smirnov检验,以±s表示。以两独立样本t检验比较2组间脾脏SWE_mean、脾脏厚度和脾脏长径;以临床诊断肝硬化门静脉高压为标准,构建脾脏SWE_mean、脾脏厚度及脾脏长径诊断肝硬化门静脉高压的ROC曲线,并计算曲线下面积(area under curve, AUC),采用DeLong检验比较AUC;以P<0.05为差异有统计学意义。以ROC曲线最大Youden指数确定脾脏SWE_mean诊断肝硬化门静脉高压的最佳界值,并计算相应的敏感度和特异度。
2 结果
2.1 组间各参数比较 PH组与对照组SWE_mean分别为(35.78±12.26)kPa、(15.86±4.07)kPa,差异有统计学意义(t=13.00,P<0.001);PH组与对照组脾脏厚度分别为(5.12±1.68)cm、(3.57±0.65)cm,差异有统计学意义(t=9.79,P<0.001);PH组与对照组脾脏长径分别为(13.93±3.27)cm、(9.85±1.43)cm,差异有统计学意义(t=8.74,P<0.001)。
2.2 脾脏SWE表现 对照组患者脾脏多表现为蓝、绿相间的混杂色,以蓝色为主(图1);PH组患者脾脏多表现为红黄相间的混杂色,以黄色为主(图2)
2.3 诊断界值及ROC曲线 SWE测量脾脏SWE_mean、脾脏厚度及脾脏长径诊断肝硬化门静脉高压的ROC曲线见图3。脾脏SWE_mean、厚度及长径的AUC分别为0.979[95%CI(0.944,0.989),P<0.001]、0.917[95%CI(0.854,0.926),P<0.001]和0.865[95%CI(0.775,0.928),P<0.001],脾脏SWE_mean与脾脏厚度和长径的AUC差异均有统计学意义(Z=2.036、2.861,P=0.041、0.003),脾脏厚度与脾脏长径AUC比较差异有统计学意义(Z=1.966,P=0.004)。脾脏SWE_mean诊断肝硬化门静脉高压的最佳界值为19.98 kPa,敏感度与特异度分别为95.78%和94.27%。
3 讨论
对于肝硬化门静脉高压患者,预防食管静脉曲张破裂出血是提高生存率的主要措施之一,因此快速、简便、准确地确定肝硬化时门静脉高压及严重程度有重要意义。既往超声检查常以脾脏增大作为诊断指标之一,但受个体差异和脾脏肿大评估标准不同等因素的影响,脾脏大小并不能准确反映肝硬化时门静脉高压的有无及其严重程度,且在肝硬化门静脉高压患者中,脾脏肿大者仅占60%~65%。
肝硬化时,由于肝脏血流量灌注下降和肝功能损伤,肝脏对血液中的前列腺素F、组胺和缓激肽等血管活性物质灭活障碍,引起扩张血管的物质升高,导致脾动脉扩张,脾脏的血流灌注增多而形成充血性脾脏肿大;同时,随着脾脏血流量增多、脾窦内压力增高而进一步导致脾脏髓索增厚、纤维化,使肝硬化门静脉高压时除脾脏充血性肿大外,还伴有脾脏组织增生以及脾脏纤维化[1,4,9]。而脾脏充血、组织增生及纤维化均可引起脾脏弹性的增加,故脾脏弹性可反映肝硬化门静脉高压的情况。Buechter等[2]发现,采用FibroScan技术测量脾脏硬度可鉴别肝硬化食管静脉曲张患者,但受肥胖、腹腔积液及患者肋间隙等因素影响较大。Hirooka等[3]采用RTE技术测量门静脉高压患者脾脏硬度,也发现肝硬化门静脉高压患者脾脏硬度增加。但RTE是一种助力式弹性成像技术,采用应变率比值法进行半定量分析,不能直接获得脾脏的弹性值,且RTE受主观因素与肥胖等因素影响也较明显。De Santis等[5]采用ARFI技术研究发现,监测门静脉高压时脾脏硬度优于肝脏硬度,但ARFI技术为点剪切波弹性成像,因取样面积有限而只能测量聚焦范围附近的组织弹性。上述弹性成像技术测量脾脏硬度诊断肝硬化门静脉高压有一定价值,但仍存在不足[9-11]。
SWE采用声辐射脉冲激励方法,以组织受到声辐射压力时发生形变的程度进行彩色编码,根据应变率提供组织硬度的定性参考,蓝色表示组织的偏软,红色表示组织偏硬,绿色表示中等硬度[12];同时也通过测量杨氏模量值直接获得组织的硬度后进行定量分析,操作过程中无需施加外力,可减少外部激励弹性成像的操作者依赖性,并在二维超声图像的基础上进行弹性成像,避开脾脏内的管道结构,提高可重复性和客观性[13]。本研究发现,实时SWE可在二维超声图像成像满意后进行弹性测量,在弹性彩色标尺设定为0~70 kPa的情况下,对照组患者脾脏显示为蓝色,提示硬度偏软,而PH组患者脾脏显示为红黄色,提示硬度偏硬,可初步定性判断肝硬化门静脉高压患者的脾脏硬度明显增加;同时直接在ROI测量杨氏模量值,可准确进行定量诊断,本研究中2组患者脾脏SWE_mean差异有统计学意义,提示SWE脾脏弹性成像对肝硬化门静脉高压在定性和定量诊断方面均具有诊断价值。本研究以临床诊断肝硬化门静脉高压作为诊断标准,绘制脾脏SWE_mean、脾脏厚度和脾脏长径诊断肝硬化门静脉高压的ROC曲线,发现脾脏SWE_mean的AUC大于脾脏厚度和脾脏长径的AUC,差异均有统计学意义,表明脾脏SWE_mean诊断效能较高,并通过最大Youden指数确定脾脏SWE_mean最佳诊断界值为19.98 kPa,相应的敏感度和特异度也较高。以上结果提示,作为一种无创性诊断方法,SWE测量脾脏SWE_mean可用于判断肝硬化门静脉高压的存在及其严重程度,且诊断效能优于测量脾脏厚度及长径。
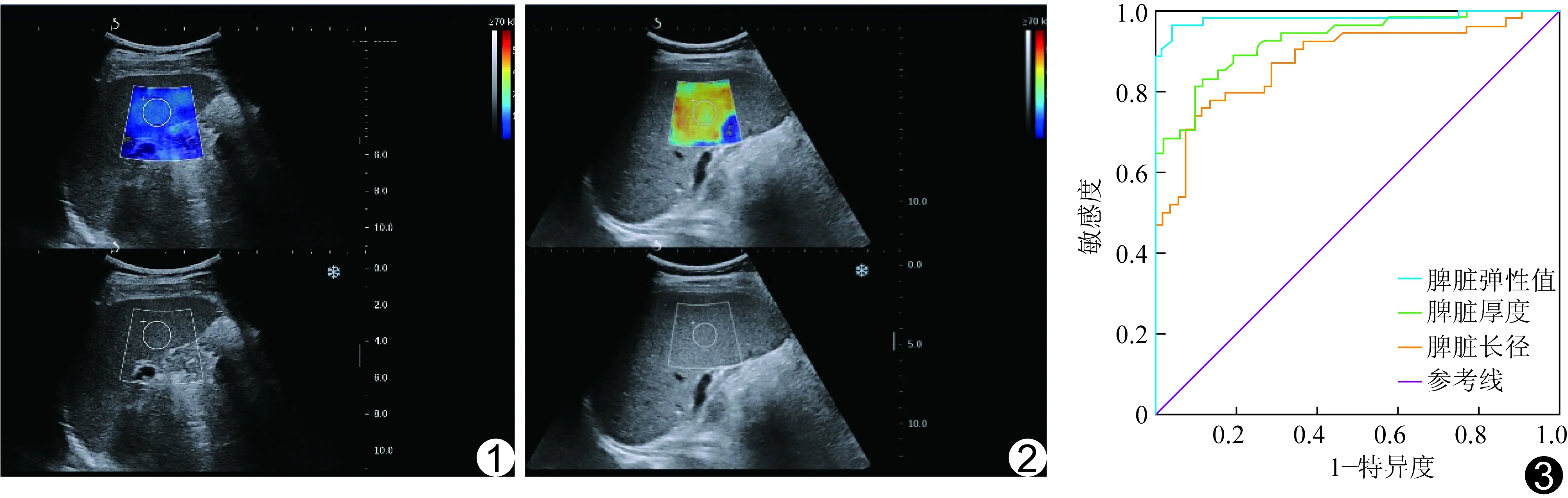
图1 患者男,44岁,对照组 脾脏显示为蓝色,硬度偏软,SWE_mean 为14.5 kPa 图2 患者男,48岁,PH组 脾脏显示为红黄色,硬度偏硬,SWE_mean 为42.7 kPa 图3 SWE测量脾脏弹性值、脾脏厚度、脾脏长径诊断肝硬化门静脉高压的ROC曲线
本研究的局限性:本组仅为单中心小样本病例对照研究,有必要通过多中心大样本量研究进一步确定更准确的诊断界值;肝静脉导管检查测量HVPG(>10 mmHg)[4]为肝硬化门静脉高压的诊断金标准,但由于为有创性检查多数患者难以接受,本研究未能采用;SWE技术测量脾脏SWE_mean受一些因素(如脾脏大小、肥胖程度和肋间隙宽窄等因素)影响,存在一定误差[6,13]。
总之,SWE可定性和定量测量脾脏硬度,SWE测量脾脏SWE_mean的诊断效率高于测量脾脏厚度和脾脏长径,可作为诊断肝硬化门静脉高压的参考指标之一。
[参考文献]
[1] Li L, Duan M, Chen W, et al. The spleen in liver cirrhosis: Revisiting an old enemy with novel targets. J Transl Med, 2017,15(1):111.
[2] Buechter M, Kahraman A, Manka P, et al. Spleen and liver stiffness is positively correlated with the risk of esophageal variceal bleeding. Digestion, 2016,94(3):138-144.
[3] Hirooka M, Ochi H, Koizumi Y, et al. Splenic elasticity measured with real-time tissue elastography is a marker of portal hypertension. Radiology, 2011,261(3):960-968.
[4] Berzigotti A. Non-invasive evaluation of portal hypertension using ultrasound elastography. J Hepatol, 2017,67(2):399-411.
[5] De Santis A, Nardelli S, Bassanelli C, et al. The modification of splenic stiffness on acoustic radiation force impulse parallels the variation of portal pressure induced by transjugular intrahepatic portosystemic shunt. J Gastroenterol Hepatol, 2018,33(3):704-709.
[6] 夏清蓉,段星星,李皓,等.实时剪切波弹性成像对正常儿童肝脏硬度的研究.中国医学影像技术,2017,33(9):1353-1356.
[7] 王贵强,王福生,成军,等.慢性乙型肝炎防治指南(2015年更新版).临床肝胆病杂志,2015,31(12):1941-1960.
[8] Bayraktar Y, Balkanci F, Uzunalimoglu B, et al. Is portal hypertension due to liver cirrhosis a major factor in the development of portal hypertensive gastropathy? Am J Gastroenterol, 1996,91(3):554-558.
[9] Berzigotti A, Seijo S, Arena U, et al. Elastography, spleen size, and platelet count identify portal hypertension in patients with compensated cirrhosis. Gastroenterology, 2013,144(1):102-111.
[10] Takuma Y, Nouso K, Morimoto Y, et al. Measurement of spleen stiffness by acoustic radiation force impulse imaging identifies cirrhotic patients with esophageal varices. Gastroenterology, 2013,144(1):92-101.
[11] Piscaglia F, Salvatore V, Mulazzani L, et al. Ultrasound shear wave elastography for liver disease. A critical appraisal of the many actors on the stage. Ultraschall Med, 2016, 37(1):1-5.
[12] Park SY, Choi JS, Han BK, et al. Shear wave elastography in the diagnosis of breast non-mass lesions: Factors associated with false negative and false positive results. Eur Radiol, 2017,27(9):3788-3798.
[13] Varbobitis IC, Siakavellas SI, Koutsounas IS, et al. Reliability and applicability of two-dimensional shear-wave elastography for the evaluation of liver stiffness. Eur J Gastroenterol Hepatol, 2016,28(10):1204-1209.

