白细胞介素⁃18在脓毒症血小板减少症中的表达及临床意义
李健 许华 王兵 王勇强
天津市第一中心医院重症医学科/天津市急救医学研究所(天津 300192)
据统计,35%~59%的脓毒症患者曾发生血小板减少,且其与生存率呈负相关,感染诱发的血小板减少症(thrombocytopenia,TCP)是脓毒症患者死亡的危险标志之一[1-3]。因此,及早发现并干预可能引起TCP的危险因素,及时恢复患者血小板低计数状态是降低脓毒症TCP患者病死率的关键所在。然而,目前关于脓毒症TCP的发病机制尚未完全阐明,它与机体全身炎症网络效应、免疫功能障碍以及宿主对不同感染病原微生物及其毒素的异常反应密切相关[4]。白细胞介素⁃18(IL⁃18)是一种在体内分布较为广泛的促炎细胞因子,研究显示IL⁃18能够准确反映脓毒症的严重程度并且与其预后密切相关[5-6]。而目前对IL⁃18在脓毒症TCP患者中的表达情况以及其与血小板减少的相关性尚鲜见报道。本研究通过收集并检测脓毒症患者及脓毒症TCP患者血清IL⁃18的表达水平及血小板计数和28 d生存率,初步探讨IL⁃18与脓毒症TCP的相关性及其临床意义。
1 资料与方法
1.1 一般资料 收集2012年6月至2014年5月入住天津市第一中心医院ICU的患者60例,其中脓毒症患者32例,脓毒症TCP患者28例。入选病例符合2001年国际脓毒症会议关于脓毒症诊断标准[7],观察期间两次或以上住入ICU,只第一次列入观察范围。排除标准:恶性肿瘤;免疫系统疾病,造血系统严重损伤及恶性肿瘤;年龄<14岁或>75岁,心肺复苏后,终末期肝或肾功能衰竭者,入院24 h内死亡者。疾病的严重程度采用急性生理和慢性健康状况评分Ⅱ(APACHEⅡ)进行评价。以外周血小板计数<100×109/L至少2次作为血小板减少的标准。全部患者的细菌培养(痰液、血液、尿液、引流液)均为阳性。
本研究符合医学伦理学标准,并经天津市第一中心医院伦理委员会批准,所有治疗方案均获得患者家属知情同意。
1.2 临床指标观察与检测 于入院24 h内取外周静脉血,检测血小板计数(PC)、全血白细胞计数(WBC)、C反应蛋白(CRP)及纤维蛋白原的表达情况。记录APACHEⅡ评分、ICU住院时间、出血事件、感染位点及28 d病死率。
1.3 外周血中IL⁃18表达检测 采用RT⁃PCR方法检测外周血单个核细胞中IL⁃18 mRNA水平的表达,采用密度梯度离心法分离外周血中单个核细胞,提取细胞总RNA,并检测RNA的纯度和浓度,A260/A280值均在1.8~ 2.0之间。之后将1 μg RNA逆转录为cDNA。RT⁃PCR引物均由上海生工生物工程股份有限公司合成(具体序列见表1)。选用SYBR Premix Ex Taq(TaKaRa公司)试剂盒以及ABI PRISM⁃7500扩增仪进行RT⁃PCR反应。反应条件设定参照试剂盒说明书。每样本设平行反应孔3个。以GAPDH为内参,取平均Ct值计算2⁃△△Ct值,作为各样本mRNA的相对表达量。
采用酶联免疫吸附法检测外周血中的IL⁃18,按照IL⁃18酶联免疫检测试剂盒(NeoBioscience Tech⁃nology公司)说明书将血液样本短暂离心并检测。

表1 RT⁃PCR引物序列Tab.1 Sequences of primers for real time PCR
1.4 统计学方法 所有数据以±s表示,采用SPSS 19.0软件进行统计分析。均数间差异统计学意义的检验采用t⁃test,P<0.05为差异有统计学意义。
2 结果
2.1 两组患者一般资料比较 脓毒症患者32例,脓毒症TCP患者28例,两组患者性别、年龄、APACHEⅡ评分、WBC、CRP及纤维蛋白原等比较差异均无统计学意义(P>0.05),见表2;初次感染位点、感染源、器官损伤种类及数量差异亦无统计学意义(P>0.05),见表3。
表2 两组患者临床特征比较Tab.2 Clinical characteristics of patients ±s

表2 两组患者临床特征比较Tab.2 Clinical characteristics of patients ±s
注:与脓毒症组比较,**P<0.001
临床特征性别(男/女)年龄(岁)APACHEⅡ评分(分)PC(× 109/L)WBC(× 109/L)CRP(mg/dL)纤维蛋白原(g/L)脓毒症组16/16 63(23 ~ 82)23.9±6.8 124.35±63.41 11.80±1.76 9.4(3.0 ~ 29.8)4.8±1.2脓毒症TCP组13/15 60(19 ~ 74)21.2±8.3 20.93±4.71**10.12±2.56 10(2.3 ~ 34.6)5.1±2.2
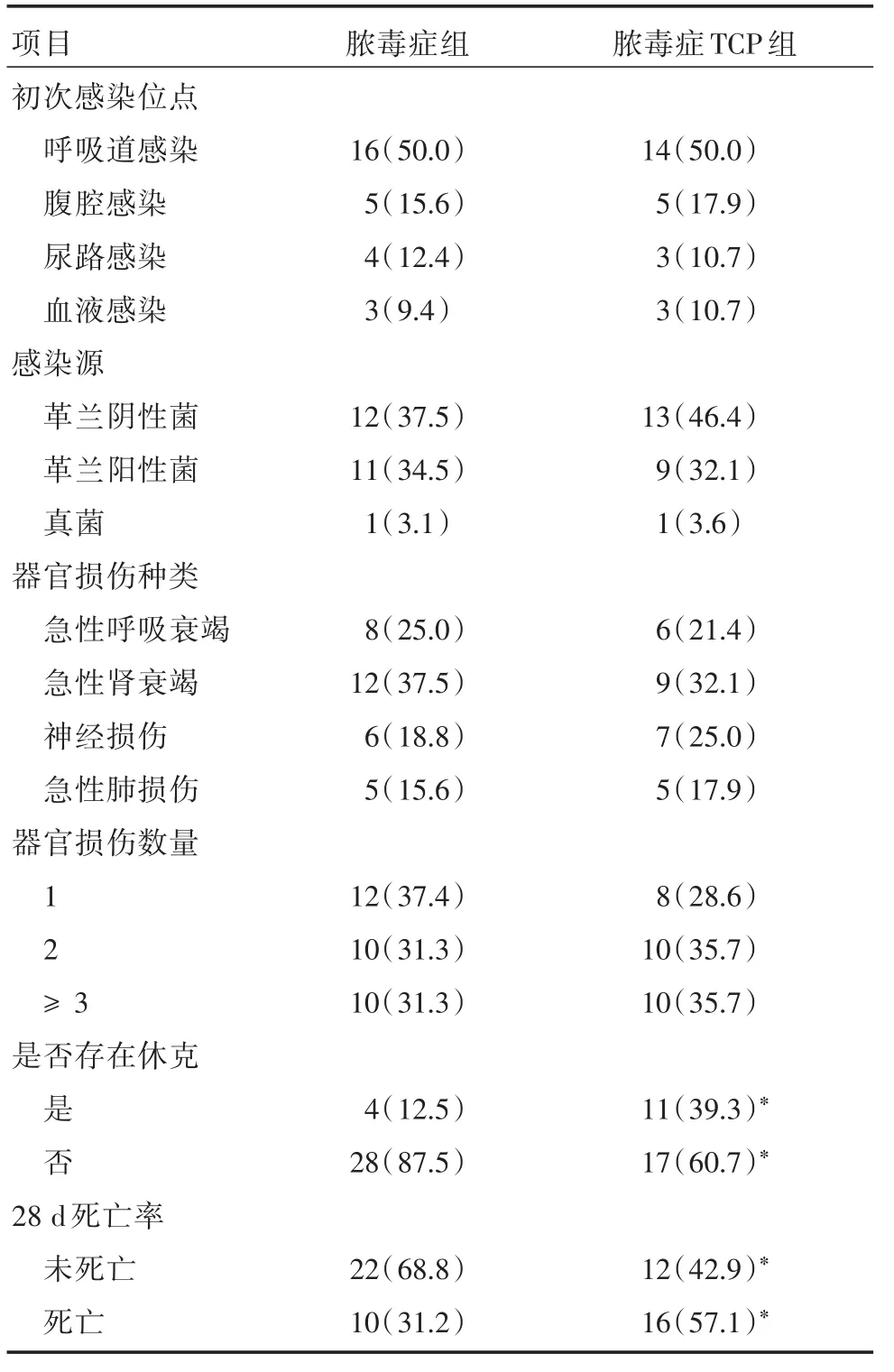
表3 两组患者感染位点、器官损伤等基线情况比较Tab.3 Baseline characteristics of sepsis patients and severe sepsis patients with thrombocytopenia 例(%)
2.2 外周血单个核细胞中IL⁃18的表达 脓毒症患者外周血单个核细胞中IL⁃18 mRNA的表达量高于脓毒症TCP患者(P=0.015,图1);通过对两组患者血清中IL⁃18含量的检测,结果显示脓毒症患者血清中IL⁃18的含量高于脓毒症TCP患者(P=0.034,图2)。

图1 两组患者外周血单个核细胞中IL⁃18 mRNA的表达情况Fig.1 Expression levels of IL⁃18 mRNA in PBMCs of sepsis patients and severe sepsis patients with thrombocytopenia

图2 两组患者血清中IL⁃18的表达情况Fig.2 Plasma concentrations of IL⁃18 in sepsis patients and severe sepsis patients with thrombocytopenia
3 讨论
脓毒症是严重创伤、烧伤、休克、感染、大手术等临床急、危重患者的严重并发症之一,亦是诱发脓毒性休克、多器官功能障碍综合征的重要因素,严重威胁人类健康[8]。脓毒症患者的TCP发生率较高,其血小板减少程度和持续时间在预测脓毒症患者死亡率方面具有重要作用[9-10]。因此,明确脓毒症TCP发病机制,针对性地纠正脓毒症患者血小板的减少状态是解决脓毒症高死亡率的难点之一。然而目前有关脓毒症相关TCP的发病机制尚未明确。本研究检测了IL⁃18在脓毒症及其相关TCP患者中的表达情况,为探讨脓毒症相关TCP的发病机制提供临床检测数据。
IL⁃18是一种在体内分布较为广泛的促炎症细胞因子,可促进INF⁃γ的产生,在感染及炎症的起始免疫反应中具有重要调控作用[11]。研究显示IL⁃18直接与脓毒症患者的死亡率相关,血浆中IL⁃18的水平可作为脓毒症患者不良预后的指标,且独立于其他免疫因子尤其是 IL⁃1β[5];与此相符,ENDO等[12]检测13例脓毒症患者的血清IL⁃18水平,发现其与脓毒症APACHEⅡ评分类似,能够准确反映疾病的严重程度;OBERHOLZER等[13]则进一步发现IL⁃18在脓毒症患者中明显升高,死亡的脓毒症患者和脓毒症休克患者的IL⁃18水平比存活者和无休克的脓毒症患者的水平高;孙荣青等[14]检测ICU脓毒症患者的前3天IL⁃18水平结果同样显示:升高的IL⁃18水平与脓毒症患者疾病严重程度及预后密切相关。由此可见,IL⁃18与脓毒症患者疾病严重程度及预后密切相关。然而关于IL⁃18与血小板减少的相关性鲜见报道,在本研究中,笔者收集并检测了60例脓毒症患者及脓毒症TCP患者外周血单个核细胞中IL⁃18 mRNA的表达以及血清中IL⁃18的表达情况,结果显示IL⁃18在脓毒症TCP患者中的表达水平高于脓毒症患者(P=0.015,P=0.034)。结合两组患者临床特征及基线情况,可见IL⁃18与脓毒症患者血小板减少程度呈负相关,与脓毒症患者疾病程度呈正相关。该结果不仅验证了前人所报道的IL⁃18与脓毒症患者的病情严重程度及预后密切相关,还证实了IL⁃18与脓毒症患者中血小板减少程度相关,揭示了IL⁃18与脓毒症TCP患者的病情严重程度的相关性,具有一定的临床意义,然而本研究仅处于初步探索阶段,对于IL⁃18是否参与脓毒症TCP的发病过程及其可能的机制仍需进一步深入的研究。
IL⁃1β是IL⁃1家族的主要成员并且以往研究显示,IL⁃1β 在脓毒症中扮演着重要的角色:IL⁃1β在血小板内存在自分泌环路,在LPS刺激下该分泌方式是血小板级联活化的必须因素并被视为一种可促进血栓形成的血小板兴奋剂[15];并且研究还指出IL⁃1α和IL⁃1β能够作为TLR4的内生性配体通过侵入并激活LPS结扎的TLR4信号通路而产生无菌炎症[15]。最新研究报道显示与IL⁃1β同属于IL⁃1家族并且活化都依赖于Caspase⁃1炎性小体的IL⁃18在肾功能障碍患者中的产生与激活均依赖于TLR4信号通路,并且IL⁃18能够促进TLR4的表达及活性氧(ROS)的产生,而ROS能够刺激NLRP3进而促进炎性小体的形成,由NLRP3、ASC和Caspase⁃1形成的炎性小体又可以激活IL⁃18前体[16-21]。此外研究还报道血小板也能够独自合成剪切和释放IL⁃18,并且报道揭示在人体血液中的IL⁃18大都来源于血小板[22]。因此,笔者推测IL⁃18很有可能在血小板内也存在自分泌环路,并且参与脓毒症相关TCP的发病过程。然而其具体的分子机制仍有待进一步研究验证。
参考文献
[1]VANDIJCK D M,BLOT S I,DE WAELE J J,et al.Thrombo⁃cytopenia and outcome in critically ill patients with bloodstream infection[J].Heart Lung,2010,39(1):21⁃26.
[2]XU R,LIN F,BAO C,et al.Complement 5a receptor⁃mediat⁃ed neutrophil dysfunction is associated with a poor outcome in sepsis[J].Cell Mol Immunol,2016,13(1):103⁃109.
[3]LI M F,LI X L,FAN K L,et al.Platelet desialylation is a novel mechanism and a therapeutic target in thrombocytopenia during sepsis:an open ⁃label,multicenter,randomized con⁃trolled trial[J].J Hematol Oncol,2017,10(1):104.
[4]VASSILIOU A G,MASTORA Z,ORFANOS S E,et al.Elevat⁃ed biomarkers of endothelial dysfunction/activation at ICU ad⁃mission are associated with sepsis development[J].Cytokine,2014,69(2):240⁃247.
[5]EIDT M V,NUNES F B,PEDRAZZA L,et al.Biochemical and inflammatory aspects in patients with severe sepsis and sep⁃tic shock:The predictive role of IL⁃18 in mortality[J].Clin Chim Acta,2016,453:100⁃106.
[6]OKUHARA Y,YOKOE S,IWASAKU T,et al.Interleukin⁃18 gene deletion protects against sepsis⁃induced cardiac dysfunc⁃tion by inhibiting PP2A activity[J].Int J Cardiol,2017,243:396⁃403.
[7]2001年国际脓毒症定义会议关于脓毒症诊断的新标准[J].中国危重病急救医学,2006,18(11):645.
[8]王勇强,王兵.脓毒症的诊治[J].中华急诊医学杂志,2013,22(2):222⁃224.
[9]VENKATA C,KASHYAP R,FARMER J C,et al.Thrombocy⁃topenia in adult patients with sepsis:incidence,risk factors,and its association with clinical outcome[J].J Intensive Care,2013,1(1):9.
[10] 彭锦,方伟强,蔡举瑜,等.静脉注射免疫球蛋白辅助治疗脓毒症相关性血小板减少症的疗效[J].实用医学杂志,2015,31(18):3072⁃3074.
[11] KWAK A,LEE Y,KIM H,et al.Intracellular interleukin(IL)⁃1 family cytokine processing enzyme[J].Arch Pharm Res,2016,39(11):1556⁃1564.
[12] ENDO S,INADA K,YAMADA Y,et al.Interleukin 18(IL⁃18)levels in patients with sepsis[J].J Med,2000,31(1⁃2):15⁃20.
[13] OBERHOLZER A,STECKHOLZER U,KURIMOTO M,et al.IL⁃18 plasma levels are increased in patients with sepsis com⁃paredtosevereinjuredpatients[J].Shock,2001,16(6):411⁃414.
[14] 孙荣青,张少雷.脓毒症早期血清白细胞介素⁃18和10在疾病严重程度及预后评估中的价值研究[J].中国危重病急救医学,2011,5:299⁃301.
[15] BROWN G T,NARAYANAN P,LI W,et al.Lipopolysaccha⁃ride stimulates platelets through an IL⁃1β autocrine loop[J].J Immunol,2013,191(10):5196⁃203
[16] KWAK A,LEE Y,KIM H,et al.Intracellular interleukin(IL)⁃1 family cytokine processing enzyme[J].Arch Pharm Res,2016,39(11):1556⁃1564.
[17] RHEE A C,CAIN A L,HILE K L,et al.IL⁃18 activation is dependent on Toll⁃like receptor4 during renal obstruction[J].J Surg Res,2013,183(1):278⁃284.
[18] MELDRUM K K,ZHANG H,HILE K L,et al.Profibrotic effect of Interleukin⁃18 in HK⁃2 cells is dependent on stimula⁃tion of the Toll⁃like receptor 4(TLR4)promoter and increased TLR4 expression[J].J Biol Chem,2012,287(48):40391⁃40399.
[19] DIAS⁃MELICIO L A,FERNANDES R K,RODRIGUES D R,et al.Interleukin⁃18 increases TLR4 and mannose receptor ex⁃pression and modulates cytokine production in human monocytes[J].Mediators Inflamm,2015,2015:236839.
[20] WYNN J L,WILSON C S,HAWIGER J,et al.Targeting IL⁃17A attenuates neonatal sepsis mortality induced by IL⁃18[J].Proc Natl Acad Sci U S A,2016,113(19):E2627⁃2635.
[21] WANG W,WU Q H,SUI Y,et al.Rutin protects endothelial dysfunction by disturbing Nox4 and ROS⁃sensitive NLRP3 in⁃flammasome[J].Biomed Pharmacother,2017,86:32⁃40.
[22] ALLAM O,SAMARANI S,JENABIAN M A.et al.Differential synthesis and release of IL⁃18 and IL⁃18 Binding Protein from human platelets and theirimplications for HIV infection[J].Cy⁃tokine,2017,90:144⁃154.

