艾司洛尔对脓毒症休克患者代谢的影响
王静蓉 杨 斌
(1 云南省第一人民医院重症医学科,云南 昆明 650032;2 大理州医院普外二科,云南 大理 671000)
脓毒血症和脓毒症休克的发病率逐年增加,二者均是导致重症监护病房(ICU)患者死亡的重要原因[1]。感染性休克患者通常存在顽固性低血压及持续性心动过速。同时,严重感染引发交感风暴,激发了炎性反应,导致肾上腺素能受体过度激活,造成多系统损害[2]。β-受体阻滞剂能控制过快HR,抑制交感风暴,但β-受体阻滞剂的负性肌力作用及降压作用,可能会加重心肌抑制,导致心肌失代偿。近年来较多研究表明,静脉使用肾上腺素能受体阻滞剂控制感染性休克患者HR,能有效增强心肌功能,改善预后[3]。本文旨在探讨短效β-受体阻滞剂对脓毒症休克患者代谢的影响。
表1 入组患者不同时间点各指标监测情况(±s)
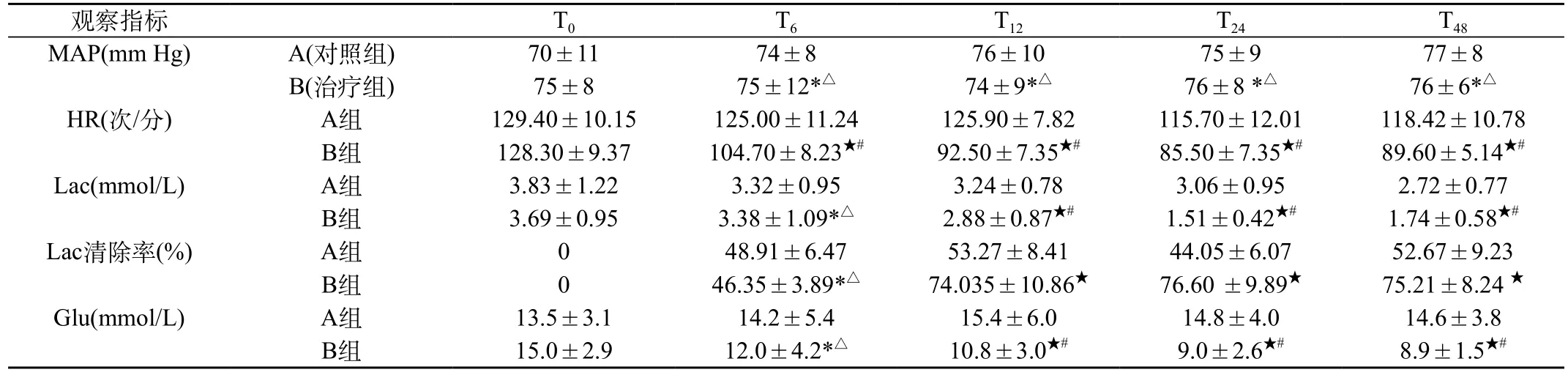
表1 入组患者不同时间点各指标监测情况(±s)
注:*与同组T0比较,P>0.05,△与对照组同期相比,P>0.05。#与同组T0比较,P<0.05,★与对照组同期比较,P<0.05
观察指标 T0 T6 T12 T24 T48 MAP(mm Hg) A(对照组) 70±11 74±8 76±10 75±9 77±8 B(治疗组) 75±8 75±12*△ 74±9*△ 76±8 *△ 76±6*△HR(次/分) A组 129.40±10.15 125.00±11.24 125.90±7.82 115.70±12.01 118.42±10.78 B组 128.30±9.37 104.70±8.23★# 92.50±7.35★# 85.50±7.35★# 89.60±5.14★#Lac(mmol/L) A组 3.83±1.22 3.32±0.95 3.24±0.78 3.06±0.95 2.72±0.77 B组 3.69±0.95 3.38±1.09*△ 2.88±0.87★# 1.51±0.42★# 1.74±0.58★#Lac清除率(%) A组 0 48.91±6.47 53.27±8.41 44.05±6.07 52.67±9.23 B组 0 46.35±3.89*△ 74.035±10.86★ 76.60 ±9.89★ 75.21±8.24 ★Glu(mmol/L) A组 13.5±3.1 14.2±5.4 15.4±6.0 14.8±4.0 14.6±3.8 B组 15.0±2.9 12.0±4.2*△ 10.8±3.0★# 9.0±2.6★# 8.9±1.5★#
1 资料与方法:
1.1 临床资料:入组患者包括2014年1月至2016年11月收住我院ICU的患者60例,入选标准:年龄≥18岁,依据2014年脓毒症指南确定脓毒症休克存在,患者均术后带气管插管送入ICU监护。入选患者感染性休克病因:肺部感染39例,腹部感染16例,泌尿系感染3例,软组织感染2例。
1.2 方法
1.2.1 入组患者均给予充分液体复苏、使用血管活性药物去甲肾上腺素维持血压、敏感抗生素控制感染、充足的营养支持、使用胰岛素积极的血糖控制,行有创机械通气保证氧供,充分镇静。NE使用微量泵经深静脉持续泵入,从0.1 μg/(kg•min)起始,复苏目标按EGDT目标确定,MAP≥68 mm Hg,CVP 8~12 mm Hg。在EGDT达标6 h后,充分镇静镇痛基础上心率仍≥100次/分者入选。入选患者随机分为两组,不联用β-受体阻滞剂的对照组(A组)和联用β-受体阻滞剂的治疗组(B组),β-受体阻滞剂选用齐鲁制药生产的艾司洛尔。艾司洛尔按0.2~0.5 mg/(kg•min)持续静脉泵入,目标心率控制到80~95次/分,持续泵入48 h。
1.2.2 观察指标:两组分别于治疗前0 h及治疗后(24、48、72 h)采用多功能监测仪记录MAP,HR,血气分析仪测定血乳酸(Lac)、血糖(Glu),同时计算乳酸清除率。乳酸清除率[=(治疗前动脉血乳酸值—观察窗各点动脉血乳酸值)/治疗前动脉血乳酸值×100%]。见表1。
1.3 统计学方法:应用SPSS16.0统计软件,计量资料以(±s)表示,比较采用t检验。计数资料采用χ2检验。P<0.05具有统计 学意义。
2 结 果
治疗组在用药6 h后,心率逐渐下降并达标。艾司洛尔对乳酸、乳酸清除率及血糖的影响更多的体现在用药12 h后。而在整个用药过程中,未见MAP水平有较大波动。结果提示使用艾司洛尔治疗脓毒症休克时,可以有效控制患者心率,但不影响血流动力学稳定,可以改善患者组织器官灌注,促进乳酸代谢,提高乳酸清除率,促进血糖水平尽快达标。对代谢的改善主要在用药12 h后体现。
3 讨 论
在脓毒症/脓毒性休克时常伴交感神经系统的过度激活,儿茶酚胺大量释放,加上外源性儿茶酚胺的大量应用,短期β肾上腺素的增加,可增加心率和心肌收缩力,但同时也增加了心肌耗氧量,持续刺激最终导致心肌能量供需失衡,心肌抑制及血管低反应性等,对心脏起到负面作用[4],而且过量的肾上腺素也可刺激多种炎性介质释放,加重心肌损伤。高血浆儿茶酚胺水平、持续大量的儿茶酚胺类药物治疗都是感染性体克患者死亡的独立危险因素[5]。在持续高儿茶酚的刺激下,可导致机体代谢的异常改变,包括乳酸和血糖水平的变化。血乳酸水平和高血糖已经证实为评估脓毒症休克患者疾病严重程度及预后的重要指标。而β受体阻滞剂可减少严重感染和感染性体克患者的促炎性细胞因子的产生,稳定循环,调控免疫功能及抑制高分解代谢,减轻多脏器功能衰竭,从而降低住院期间病死率[5]。
目前国内外均有使用短效β受体阻滞剂治疗脓毒症休克的报道。在这些文献中短效β受体阻滞剂艾司洛尔被认为能够在不影响血流动力学的状态下有效控制心率,缩短ICU留滞时间并且提高28 d住院生存率[6-7]。因此认为,在脓毒症休克患者中使用短效β受体阻滞剂是可以受益的。在2014年的中国严重脓毒症/脓毒症休克治疗指南中也指出,在充足的液体复苏后CO(心排血量)不低,心率较快可考虑使用短效β受体阻滞剂。但在指南推荐中,本条推荐属于未分级(UG)[8]。我们希望看到大量的临床研究,能告诉我们是不是所有的脓毒症休克患者都能从β受体阻滞剂的使用中受益?β受体阻滞剂介入这类患者的时机该如何把握?
参考文献
[1] Kampmeier TG,Rehberg S,Westphal M,et al. Vasopressin in sepsis and septic shock[J]. Minerva Anestesiol,2010,76(10):844-850.
[2] Schmittinger CA,Torgersen C,Luckner G,et al.Adverse cardiacevents during catecholamine vasopressor therapy: a prospective observational study[J].lntensive Care Med,2012,38(6):950-958
[3] 陆非平,陈炜,赵磊,等.艾司洛尔联用米力农治疗合并快速心律失常和低心排血量感染性休克患者的效果[J].实用医学杂志,2013,29(21):3581-3583.)
[4] Annane D,Bellissant E,Cavaillon JM.Septic shock[J].Lancet,200 5,365(9-453):63-78.
[5] Schmittinger CA,Torgersen C,Luckner G,et al.Adverse cardiacevents during catecholamine vasopressor therapy: a prospective observational study[J].lntensive Care Med,2012,38(6):950-958
[6] Xinqiang L,Weiping H,Miaoyun W,et al..Esmolol improves clinical outcome and tissue oxygen metabolism in patients with septic shock through controlling heart rate.[J]. Zhonghua Wei Zhong Bing Ji Jiu Yi Xue,2015,27(9):759-763.
[7] Alena Lira,Michael R Pinsky. Should β-blockers be used in septic shock?[J].Crit Care,2014,18(3):304.
[8] 严静.中国严重脓毒症/脓毒症休克治疗指南(2014)[J].中华内科杂志,2015,54(6):557-581.

