奥氮平联用氟西汀治疗精神分裂症阴性症状的疗效及安全性meta分析☆
王少华 周惠至 杨晨 杨润许 孙宁 韩冬 张琨 陈诗 孙黎 康传媛
阴性症状是精神分裂症的核心症状之一,相较于阳性症状,其对患者生活技能、生活质量的影响更加严重[1]。尽管第二代抗精神病药物能部分缓解精神分裂症的阴性症状,如何有效控制精神分裂症的阴性症状,提高患者回归社会的能力仍然是一个重大挑战[2]。奥氮平对精神分裂症的阳性症状、阴性症状及情感症状均具有较好疗效[3],但其体重增加、嗜睡等副作用对患者的生活质量有较大影响。氟西汀属于选择性5-羟色胺再摄取抑制剂,由于具有间接提高中枢前额叶多巴胺及去甲肾上腺素作用的药理机制,对精神分裂症患者的阴性症状亦有一定效果[4]。国内外有多项研究对奥氮平联用氟西汀在阴性症状及相关不良反应改善方面进行探索,本文采用meta分析方法,全面检索国内外文献,对奥氮平联用氟西汀对精神分裂症阴性症状的治疗效果及安全性进行系统评价。
1 资料与方法
1.1 检索策略检索1990年1月至2017年5月Pubmed、Medline、Web ofscience、EMBASE、Cochrane Library、CNKI、万方数据库中公开发表的关于奥氮平联用氟西汀治疗精神分裂症的中英文献。以氟西汀、抗抑郁药、奥氮平、非典型抗精神病药物、第二代抗精神病药物、精神分裂症为中文关键 词 , 以 Fluoxetine、Antidepressants、Olanzapine、Atypical antipsychotics、Second generation antipsychotics、Schizophrenia为英文关键词,不同组合作为检索词。检索后分别由2名精神科医生单独阅读文献,并通过文献摘要进行初步筛选,存在异议时经讨论达成一致意见;再阅读全文,对初步检索所得文献的相关参考文献进行2次检索,获得符合纳入标准的文献。
1.2 文献纳入标准及排除标准纳入标准:①受试者年龄18~65岁,诊断为精神分裂症,诊断系统包括国际疾病分类 (International Classification of Diseases,ICD)、美国精神障碍诊断与统计手册(Diagnostic and Statistical Manual of Mental Disorders,DSM)、中国精神障碍分类及诊断标准(Chinese classification of mental disorders,CCMD);②设计为随机对照研究;③研究组为奥氮平联用氟西汀,对照组为单用奥氮平或奥氮平联用安慰剂;④提供了基线期、终末期临床症状指标、副作用指标;⑤中文或英文文献。排除标准:①动物实验、综述、病例报告、重复发表的研究;②有明显错误的研究,如量表评分错误、随机方法错误等;③研究中没有抗精神病药物清洗期,未提供详细症状指标。
1.3 数据提取将检索到的文献导入Endnote X7。由2名研究者单独从文献中提取数据,内容包括作者、发表时间、研究设计、样本量、研究观察周数、基线期及终末期临床症状指标、副作用描述。
1.4 文献质量评估按照Cochrane风险偏倚评估工具[5]中所列内容对文献进行质量评估,包括随机方法、分组方案隐藏、双盲设定、研究结果完整性及选择性报告结果等方面。由2名研究者单独评估,出现不同意见时由所有研究者讨论达成一致。
1.5 统计学方法提取的数据录入Review Manager 5.3软件中进行统计学分析。严格按照Cochrane手册进行meta分析,各研究评估临床症状采用的评估量表不同,各症状量表分数合并效应量为标准化均数差 (standradized mean difference,SMD);各研究评估副作用症状的量表一致,副作用发生情况的合并效应量为风险比(risk ratio,RR)。采用I2和χ2检验对纳入研究进行异质性检验,当研究同质(I2<50%且P>0.1)时,采用固定效应模型;研究异质(I2≥50%或 P≤0.1)时,采用随机效应模型;如果研究数<3或I2>75%时,则不进行分析和率的合并。根据研究对象或研究方法的不同进行亚组分析探讨异质性的来源。检验水准α=0.05,双侧检验。
2 结果
2.1 纳入研究情况检索得到24篇中文文献,2374篇英文文献。根据纳入和排除标准最后纳入5篇文献,其中英文2篇[6-7],中文3篇[8-10],纳入流程见图1。纳入5项研究的基本特征见表1。
2.2 文献质量评估及发表偏倚评估5项研究均为随机对照研究;其中有3项为双盲研究[6-7,9],但未对盲法详细说明;所纳入研究的指标包括临床症状量表评分、TESS副作用量表评分、体重等,其中2项研究对结局指标评估的一致性作出说明[9-10]。纳入研究总体质量较好,见图2。
2.3 奥氮平联用氟西汀治疗精神分裂症的疗效及安全性纳入的5项研究中,奥氮平联用氟西汀组共111例患者,奥氮平组111例患者。其中4项研究采用PANSS量表评估患者阴性症状,1项研究采用SANS量表评估患者阴性症状。

图1 文献入选流程图
2.3.1 奥氮平联用氟西汀治疗精神分裂症阴性症状 对于阴性症状,5项研究异质性有统计学意义(I2=83%,P<0.01),meta分析示奥氮平联用氟西汀组患者阴性症状疗效与奥氮平组的差异无统计学意义(SMD=-0.61,Z=1.73,P=0.08),见图3。 鉴于所纳入研究异质性较大,进一步进行敏感性分析,3项国内研究同质性较好(I2=0%,P=0.91),奥氮平联用氟西汀组阴性症状疗效优于奥氮平组(SMD=-1.19,Z=7.08,P<0.01),见图 4;2 项国外研究同质性也较好(I2=0%,P=0.74),奥氮平联用氟西汀组与奥氮平组阴性症状疗效差并不具有统计学意义(SMD=0.36,Z=1.31,P=0.19),见图 5。
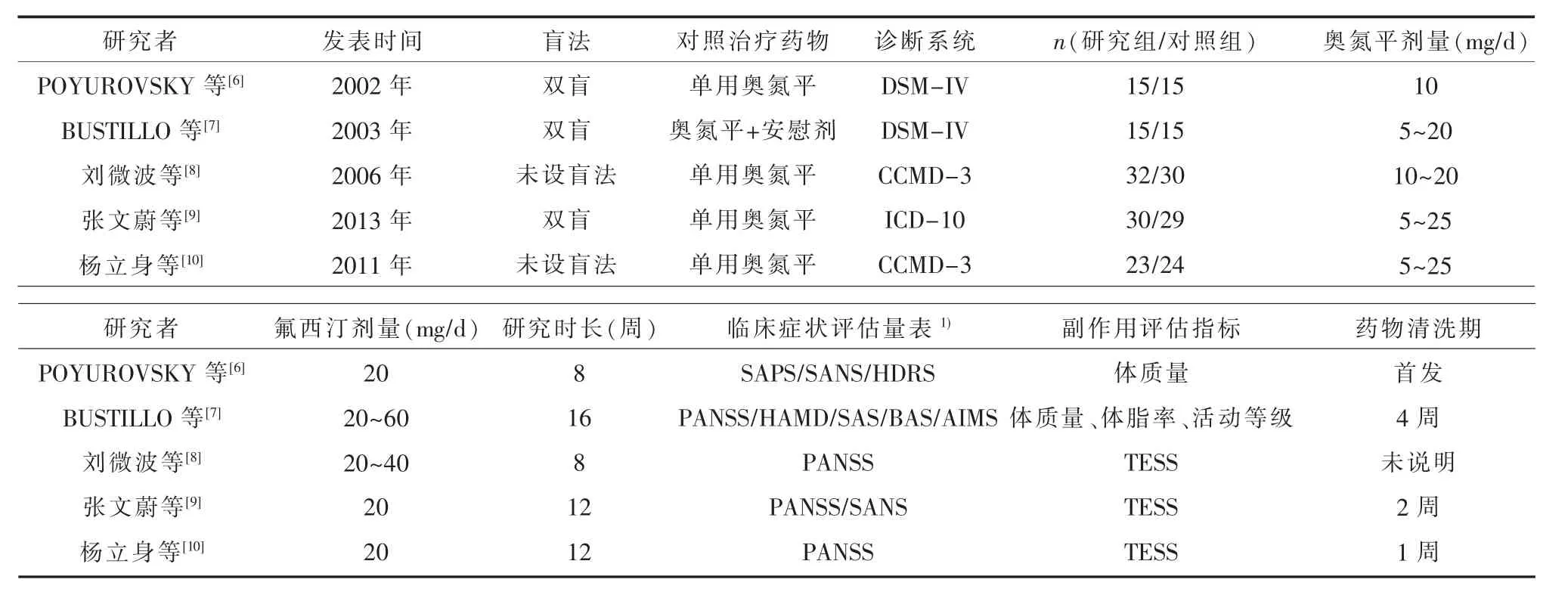
表1 纳入分析5项研究的基本特征

图2 5项研究的风险偏倚评估
2.3.2 奥氮平联用氟西汀治疗精神分裂症阳性症状 对于阳性症状,5项研究的异质性有统计学意义(I2=53%,P=0.08),故采用随机效应模型,奥氮平联用氟西汀组阳性症状疗效与奥氮平组差异无统计学意义(SMD=-0.15,Z=0.73,P=0.46),见图6。
2.3.3 奥氮平联用氟西汀组与奥氮平组副作用 5项研究中仅3项国内研究采用TESS量表评估两组患者出现的副作用,包括失眠、嗜睡、体质量增加(定义为1月内体质量增加2.26 kg以上)、心动过速、静坐不能、肝功能异常、肌张力障碍、便秘、血脂升高、激越、粒细胞减少。其中,对于体质量增加者,3 项研究具有同质性(I2=0%,P=0.87),奥氮平联用氟西汀组与奥氮平组体质量增加者差异具有统计学意义 (RR=0.28,Z=3.46,P<0.01), 见图7。TESS量表中其他副作用两组之间的差异并无统计学意义(均P>0.05)。
3 讨论
精神分裂症的阴性症状主要表现为情感淡漠,对社会生活及社交活动低动力,对抗精神病药物的反应较差,是使得精神分裂症患者总体预后差及阻碍患者回归社会的重要因素[11]。既往研究提示氟西汀可能在阴性症状改善方面有作用,然而本文仅检索到5项质量较高的随机对照研究,提示非常有必要在此领域进一步进行相关研究。
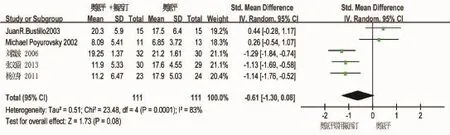
图3 治疗精神分裂症5项研究中奥氮平联用氟西汀组与奥氮平组阴性症状疗效的meta分析森林图

图4 治疗精神分裂症3项国内研究中奥氮平联用氟西汀组与奥氮平组阴性症状疗效的meta分析森林图

图5 治疗精神分裂症2项国外研究中奥氮平联用氟西汀组与奥氮平组阴性症状疗效的meta分析森林图
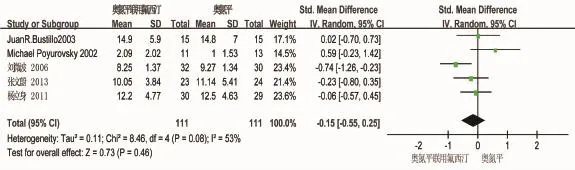
图6 治疗精神分裂症5项研究中奥氮平联用氟西汀组和奥氮平组对精神分裂症患者阳性症状疗效的meta分析森林图

图7 治疗精神分裂症3项国内研究中奥氮平联用氟西汀组与奥氮平组体质量增加者meta分析森林图
3项国内研究汇总的结果发现奥氮平联用氟西汀相比于单用奥氮平治疗精神分裂症的阴性症状更有优势,而两组对于阳性症状的疗效并无差异。众多学者认为精神分裂症的阴性症状与前额叶多巴胺功能降低及5-羟色胺 (5-hydroxytryptamine,5-HT)系统的功能紊乱相关[12],奥氮平作为噻吩苯二氮艹卓类衍生物,对5-HT1A受体的亲和力大于多巴胺D2受体,可选择性作用于大脑边缘系统和中脑皮质的多巴胺受体,对精神分裂症的阳性和阴性症状均有疗效[13]。关于氟西汀改善阴性症状的机制,有学者推测可能与氟西汀选择性阻滞 γ-氨基丁酸 (γ-aminobutyric acid,GABA)神经元突触的上的5-HT2C受体,继而解除/抑制GABA神经元对前额叶多巴胺及去甲肾上腺素的抑制作用,使得患者前额叶的多巴胺及去甲肾上腺素浓度升高有关[14];此外,也有学者认为氟西汀抑制肝药酶P450 CYP2D6同工酶代谢,导致经该酶代谢的奥氮平代谢受阻,增加其血药浓度从而提高对阴性症状的疗效。
然而有趣的是,5项研究对奥氮平联用氟西汀治疗阴性症状效果的异质性较大 (I2>75%),其中2项国外研究的结果均不支持奥氮平联用氟西汀组治疗阴性症状方面优于单用奥氮平组,而国内3项研究一致性高,均提示奥氮平在联用氟西汀治疗阴性症状较单用奥氮平更有优势。国内外研究结果的不同可能与纳入精神分裂症患者的亚型不同有关,2项国外研究纳入的是符合DSM-IV诊断标准的精神分裂症患者,并未规定以阴性症状为主,而3项国内研究的研究对象均是以阴性症状为主的精神分裂症患者(PANSS阴性因子>30分)。
本研究提示:和单用奥氮平的患者相比,奥氮平联用氟西汀使患者体重增加的风险明显下降。目前认为奥氮平所致的体质量增加与其阻断中枢神经系统的5-HT2C受体导致患者对饱胀感的体验减弱相关[15],而厌食及体重下降是氟西汀的不良反应之一(特别在早期)。研究表明氟西汀能提高中枢神经系统5-HT2A受体的功能,从而减少患者的贪食行为,并通过中枢效应抑制神经肽Y导致的进食行为,继而改善体重增加的副作用[16];也有学者认为氟西汀能非竞争性抑制Na+-K+-ATP酶活性,抑制糖和氨基酸吸收来控制体质量的增加[17]。抗精神药物所引起的体重增加不仅和代谢综合征紧密相关,也是影响患者服药依从性的主要原因,因此控制患者体重增长有重要临床意义。此外,有研究提示在抗精神病药的基础上加用氟西汀治疗,还可降低或改善精神分裂症后抑郁症状及药物所致的强迫症状[18]。
综上,仅有来源于国内研究的初步证据表明奥氮平联用氟西汀可能改善以阴性症状为主的精神分裂症的阴性症状,并不增加药物副作用,且能减轻奥氮平所致的体质量增加,因而有可能提高患者的服药依从性,可在临床工作中尝试使用。然而,由于纳入研究的数量、样本量、研究随访时间、国内外研究的一致性等问题所限,并不能全面地反映奥氮平联用氟西汀治疗精神分裂症阴性症状的效果及安全性。未来还需更多大样本、长时间随访的研究进一步回答该问题。
[1] VILLALTA-GILV,VILAPLANA M,OCHOAS,etal.Neurocognitive performance and negative symptoms:are they equal in explaining disability in schizophrenia outpatients?[J].Schizophr Res,2006,87(1-3):246-253.
[2] VEERMAN SRT,SCHULTE PFJ,DE HAAN L.Treatment for negative symptoms in Schizophrenia:A comprehensive review[J].Drugs,2017,77(13):1423-1459.
[3] UNDURRAGA J,VIETA E,TOHEN M,et al.Olanzapine in schizophrenia and affeetive disorders[J].Drug Safety,2012,35(12):1185-1186.
[4] SLIVER H,CHERTKOW Y,WEINREB O,et al.Muhifunctional pharmacotherapy:what can we learn from study of selective serotonin reuptake inhibitor augmentation of antipsychotics in negative-symptom schizophrenia[J].Neurotherapeutics,2009,6(1):86-93.
[5] HIGGINS JP,GREEN S.Cochrane handbook for systematic reviews of interventions version5.1.0[EB/OL].[2016-06-16].http:www.cochrane.org/training/cochrane-handbook.
[6] POYUROVSKY M,PASHINIAN A,GIL-AD I,et al.Olanzapine-induced weightgain in patients with first-episode schizophrenia:A double-blind,placebo-controlled study of fluoxetine addition[J].Am J Psychiatry,2002,159(6):1058-1560.[7]BUSTILLO JR,LAURIELLO J,PARKER K,et al.Treatment of weight gain with fluoxetine in olanzapine-treated schizophrenic outpatients[J].Neuropsychopharmacology,2003,28(3):527-529.
[8] 刘微波,禹华良,李惠春,等奥氮平联合氟西汀治疗精神分裂症阴性症状的对照研究[J].浙江医学,2006,28(4):258-263.
[9] 张文蔚,蒋廷云.奥氮平联用氟西汀治疗精神分裂症阴性症状的对照研究[J].精神医学杂志,2013,26(3):204-206.
[10] 杨立身,周晓燕,夏永兵,等.氟西汀合并奥氮平治疗精神分裂症对照研究[J].现代医药卫生,2011,27(22):3368-3370.
[11] DESERNO L,HEINZ A,SCHLAGENHAUF F.Computational approaches to schizophrenia:A perspective on negative symptoms[J].Schizophr Res,2017,186:46-54.
[12] SUMIYOSHI T,BUBENIKOVA-VALESOVA V,HORACEK J,etal.Serotonin 1A receptorsin the pathophysiology of schizophrenia:development of novel cognition-enhancing therapeutics[J].Adv Ther,2008,25(10):1037-1056.
[13] WOOD AJ,BEASLEY CM,TOLLEFSON GD,et al.Efficacy of olanzapine in the positive and negative symptoms of schizophrenia[J].European Neuropsychopharmacology,1994,4(3):224-225.
[14] STAHL SM.Novel mechanism of antidepressant action:norepinephrine and dopamine disinhibition (NDDI)plus melatonergic agonism[J].Int J Neuropsychopharmacol,2007,10(5):575-578.
[15] KIRK SL,GLAZEBROOK J,GRAYSON B,et al.Olanzapineinduced weight gain in the rat:role of 5-HT2C and histamine H1 receptors[J].Psychopharmacology (Berl),2009,207(1):119-125.
[16] RAJEWSKI A,RYBAKOWSKI F.Efficacy of buspirone and fluoxetine in short-term treatment of bulimia nervosa[J].Psychiatr Pol,2006,40(1):75-82.
[17] URDANETA E,IDOATE I,LARRALDE J.Drug-nutrient interactions:inhibition of amino acid intestinal absorption by fluoxetine[J].Br J Nutr,1998,79(5):439-446.
[18] LEVY E,MARGOLESE HC,SULTAN S,et al.Obsessive-compulsive symptoms in schizophrenia induced by risperidone and responding to fluoxetine[J].Can J Psychiatry,2003,48(10):709-710.

