肥厚型葡萄酒色斑的影像学和病理学特点分析
朱佳芳 张紫旻 马刚 于文心 王天佑 蔡韧 林晓曦
葡萄酒色斑(Port wine stains,PWS)表现为真皮乳头层和网状层的血管畸形,发病率为0.3%~0.5%[1]。70%的PWS都发生于头面部,随着年龄增长而颜色逐渐变深,并出现增厚和结节[2-4],给患者带来巨大心理负担[5]。这些患者中的一部分,其增厚表现为成年后病灶逐渐呈现铺路石样结节增生 (平坦型)[6];另一部分则出生后或幼年时就表现出面部软组织的广泛增厚(肥厚型),并可能合并较多的其他并发症[7],且对于脉冲染料激光(Pulsed dye laser,PDL)治疗不敏感[8]。我们也观察到其激光疗效较差,需手术干预。本文回顾性分析了肥厚型PWS的影像学和病理学特点,以期为改善该病的治疗效果提供依据。
1 资料和方法
1.1 一般资料
回顾2014年至2017年间在我院血管瘤门诊就诊并接受治疗的32例肥厚型PWS患者的资料。其中,女性 19例,男性 13例,平均年龄(27.16±11.95)岁;皮肤Fitzpatrick分型为Ⅲ~Ⅳ型,颜色呈粉色至紫红色。
1.2 临床资料
所有患者的临床资料均包含照片资料、病历资料和电话随访获得的信息,包括患者性别、年龄、病灶位置、并发症情况、病灶开始增厚的年龄,以及患者激光治疗的次数和疗效。激光治疗的疗效分为4个等级:差(1%~25%),中(26%~50%),良(51%~75%),好(76%~100%)。
1.3 MRI资料评估
将患者面部软组织增厚区域分为两部分:①增厚区域在表浅肌肉腱膜系统(SMAS)内侧;②增厚区域在SMAS外侧。每个区域的增厚程度又细分为3个等级:0分,该区域相较面部无病灶侧不增厚;1分,该区域较面部无病灶侧增厚程度小于50%;2分,该区域较面部无病灶侧增厚大于50%。
畸形血管分布的区域分为4个:病灶侧咬肌前软组织区、咬肌层面的软组织区、腮腺层面的软组织区和腮腺内侧软组织区域。
相应异构血管增生程度分为4级:1分,累及一个区域;2分,累及两个区域;3分,累及三个区域;4分,四个区域均累及。
所有患者的MRI资料均由2名医师分别评估。
1.4 病理资料分析
回顾32例肥厚型中的18例患者的病理资料,用显微镜 (Olympus DP21)自带相机对HE切片行4×、10×及20×拍照。对保存的蜡块切片,行免疫组化α 平滑肌肌动蛋白 (Alpha smooth muscle actin,α-SMA)、S-100、弹力纤维(Weigert elastin)染色。 同时,回顾我院于2016年至2017年间接受过活检的平坦型PWS患者共15例,在其HE染色切片中筛选出深达表情肌的切片,并拍照。
1.5 病理图像软件分析
图像分析采用IPP (Image-Pro-Plus,Media Cybernetics Inc.,Rockville,MD,USA)医学图像分析软件,将组织标本在20×下的5个随机视野进行分析测量,测其平均血管直径和平均血管管壁厚度。
1.6 数据分析
以SPSS 23.0进行统计学处理,Pearson相关系数分析检验患者病灶增厚程度与血管畸形分布程度之间的关系;以Wilcoxon配对样本非参数秩和检验,比较肥厚型与平坦型PWS患者之间血管口径和管壁厚度的差异。P<0.05表示差异有统计学意义。
2 结果
2.1 疗效回顾
32名患者中,11名患者出生时就出现面部软组织增厚,出现增厚的平均年龄是3.47岁。所有患者均曾接受过1~10次不等的激光治疗,平均激光治疗次数为3.28次,患者自我评估疗效不佳 (1%~25%)。有4例PWS患者还曾进行过光动力学治疗1次,自述无明显疗效。
2.2 影像学改变
32名患者均有面部的增强MRI资料,为1.5-T或3-T系统,均可发现其面部有不同程度的软组织增厚表现,且畸形血管出现在面部软组织区域内,包括皮下脂肪层、肌肉层、腮腺内等。在增强抑脂的T1-加权的MRI上,可见面部软组织内有细丝状不规则增强的血管信号影(图1、2)。
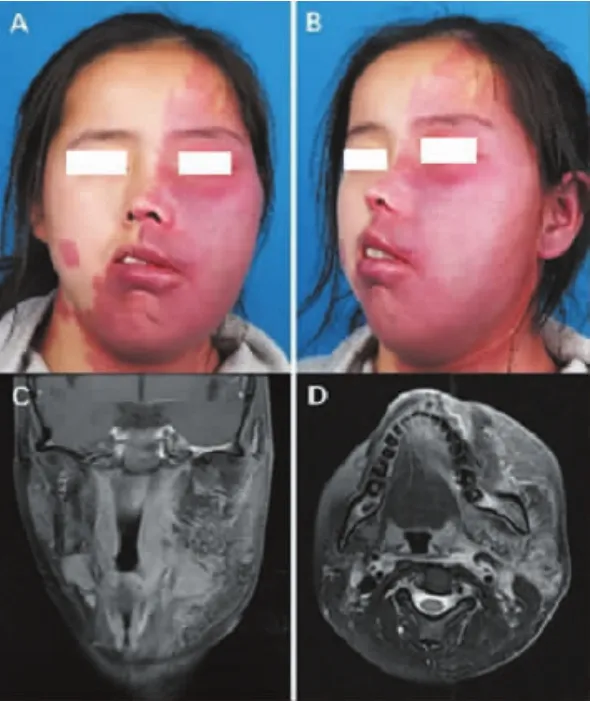
图1 典型病例1:肥厚型PWS患者及其MRI资料Fig.1 Typical case 1:PWS patient with soft tissue hypertrophy and her MRI images
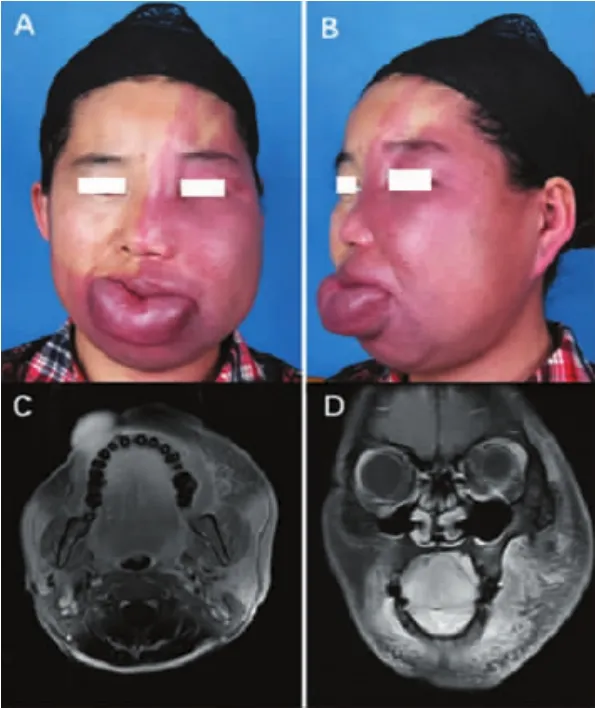
图2 典型病例2:肥厚型PWS患者及其MRI资料Fig.2 Typical case 2:PWS patient with soft tissue hypertrophy and her MRI images
对患者的面部软组织增厚进行评价,其软组织增厚的评分为(2.47±0.69),血管畸形分布的程度为(3.02±0.92),根据 Pearson 相关系数分析,增厚程度与血管畸形分布程度具有显著相关性(P<0.001)。
另有14例患者曾行CT检查,提示伴有颅骨、蝶骨、上颌骨和下颌骨不同程度的增生,1例患者伴有骨纤维异常增殖症,表现明显的骨质膨胀性改变。
2.3 病灶内血管畸形分布性比较
比较18名肥厚型及15名平坦型PWS患者的病理资料,发现肥厚型PWS患者的畸形血管不仅存在于真皮内,还存在于病变的皮下脂肪和面部肌肉组织内,深部软组织的病变血管极度迂曲扩张,血管形态类似微静脉样改变(图3~6)。
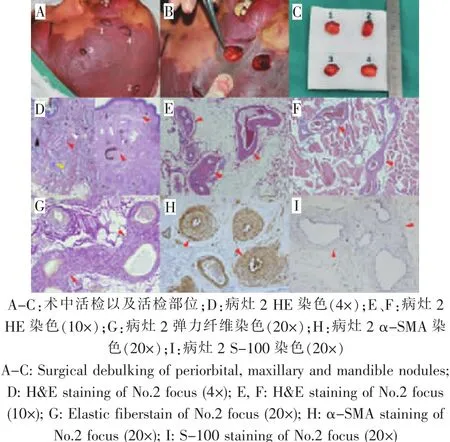
图3 典型病例3:术中活检及其病理资料Fig.3 Typical case 3:Debulking of nodules and pathological features
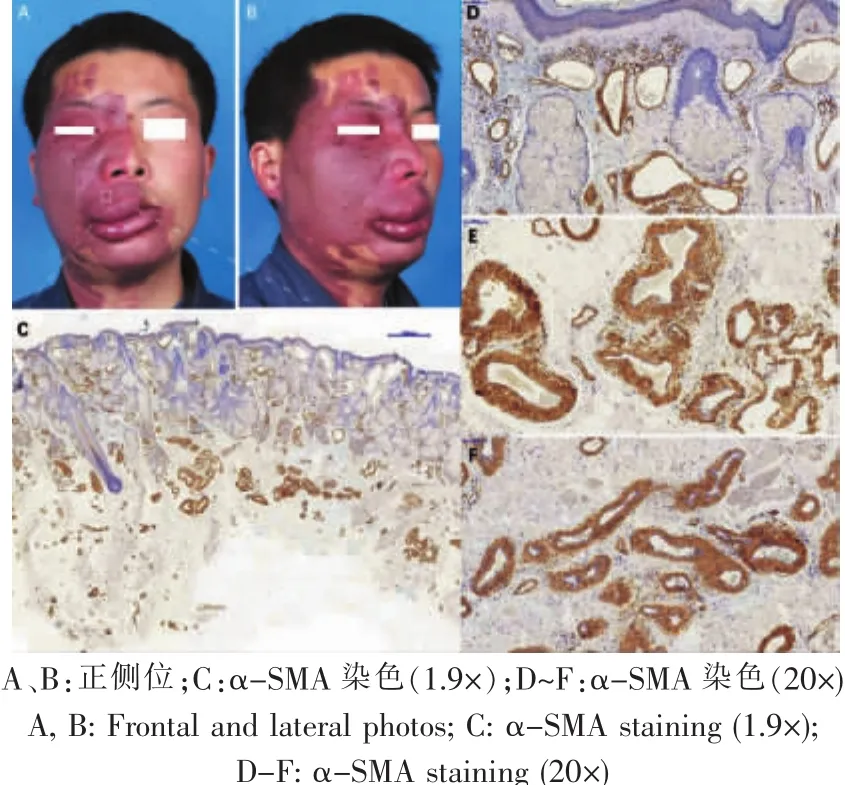
图4 典型病例4:肥厚型PWS病理特征Fig.4 Typical case 4:pathological features of PWS with tissue hypertrophy
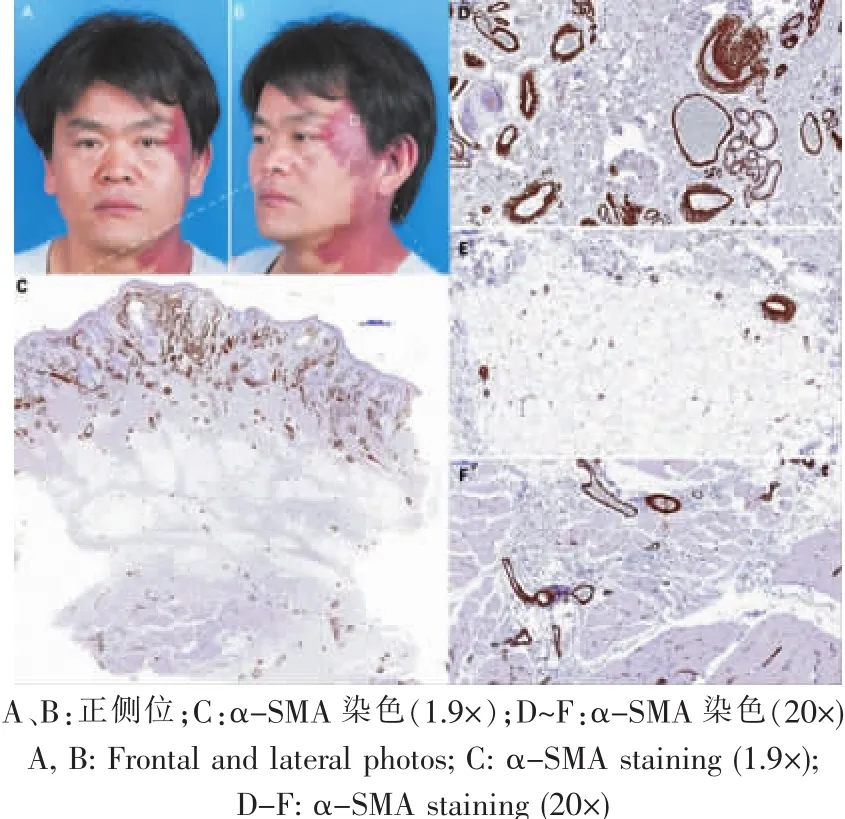
图5 典型病例5:平坦型PWS病理特征Fig.5 Typical case 5:pathological features of Flat PWS
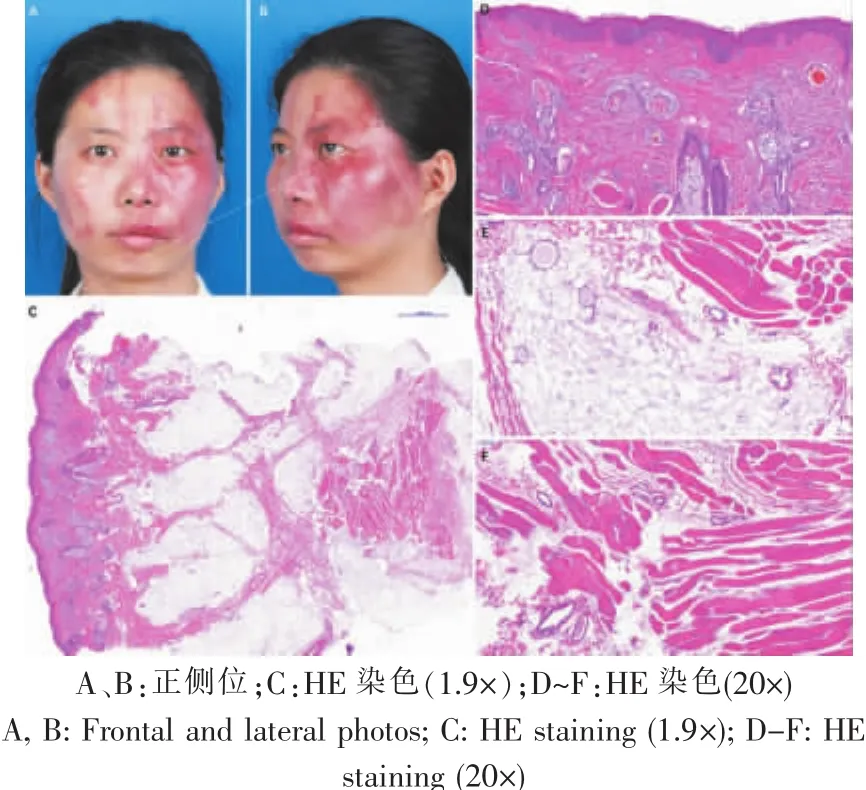
图6 典型病例6:平坦型PWS病理特征Fig.6 Typical case 6:pathological features of Flat PWS
测量发现,肥厚型PWS脂肪层的血管口径是(0.048±0.019) mm,平坦型是(0.020±0.017) mm,差异显著(P=0.004);肥厚型PWS肌肉层的血管口径是(0.035±0.013) mm,平坦型为(0.017±0.011) mm,差异显著(P=0.008),提示肥厚型PWS软组织内的血管显著扩张畸形。肥厚型PWS软组织内的畸形血管壁比平坦型显著增厚(脂肪层0.014 mm vs 0.006 mm,P=0.003;肌肉层 0.010 mm vs 0.006 mm,P=0.020)。
3 讨论
临床发现肥厚型PWS的激光疗效较差,且常伴发其他的合并症[9],包括眼部、脑部、口腔黏膜的血管畸形[10],需要早期进行激光治疗干预[11],成年后再以整复手术改善外观[12-14]。Passeron等[8]对98例肥厚型PWS患者进行分析,显示这类患者软组织增厚的年龄一般较早,平均5.6岁即出现病灶增厚;其中67例患者接受过激光治疗,仅有3%患者疗效较好,而平坦型PWS患者一般有20%患者疗效较好。但目前尚未有文献对其中的原因进行分析。
本研究中,我们回顾分析了32例肥厚型PWS患者的疗效,患者主观评价认为激光疗效较差,并且其中有4名患者曾同时行PDT治疗,疗效也较差。我们进一步分析了患者的影像学改变,观察到面部各层软组织的增厚,并且发现在增强MRI上可以观察到分布在脂肪和肌肉层的不规则血管增强影,提示这类患者的畸形血管不仅局限于真皮组织,还分布在病灶深部的软组织内,患者面部软组织增厚的程度和血管畸形分布的程度显著相关。
18例肥厚型与15名平坦型PWS患者的病理资料比较发现,肥厚型PWS患者深于真皮的软组织内存在管壁显著增厚的畸形血管,血管深度明显超出现有激光的热凝固深度[15],其畸形血管形态和口径均类似于微静脉。
Gao等[16]报道了PWS血管ephrin-B1以及B2的表达改变,这两种表面蛋白是静脉以及动脉特有的表面蛋白,而PWS血管同时表达这两种蛋白,使得PWS血管既有动脉又有静脉的特征,从而表现为管壁增厚的微静脉样血管。同时,这类血管的内皮连接不紧密,通透性较高,因此营养物质更易透过血管达到病灶软组织内,造成病灶软组织增厚。近年来,PWS组织内鸟嘌呤核苷酸结合蛋白q多肽(GNAQ)基因突变成为PWS的主要病因学说之一[17-18]。Tan等[19]发现突变的基因主要存在血管内皮上,且陆续发现了其他突变[20-21]。我们猜测,肥厚型PWS体细胞突变不仅局限于病灶真皮层的血管内皮,还存在于病灶深部软组织的所有血管,从而因某种体细胞基因突变下游通路的改变导致血管不断扩张畸形,管壁增厚。扩张的血管通透性增加,使得病灶内营养物质更多,造成病灶软组织增厚。
综上所述,我们发现肥厚型PWS患者软组织深部存在畸形血管,而深部的畸形血管明显超出了激光对畸形血管所能达到的热凝固破坏范围,因此激光治疗对这类患者效果较差,需要探索新的治疗方式以破坏深部软组织畸形血管,进而提高疗效。

