中药渣抗药性转化菌的筛选及酶活性测定
张义刚 聂铭 胡留杰 孙志洪 陈霞 谢永红
摘 要 以药渣和纤维素为唯一碳源,通过平板初筛及多种酶活综合测定复筛,从药渣高温腐熟阶段筛选出的复合菌系Y-5,从Y-5供试样品中分离到能以CMC-Na作为唯一碳源生长的高温微生物菌株72株,其中细菌54株,真菌18株,通过菌群耦合培养,获得了结构稳定的YEM耦合菌群,对中药渣的降解能力提高64.6%。
关键词 中药渣;抗药性转化菌;筛选
中图分类号:S182 文献标志码:A DOI:10.19415/j.cnki.1673-890x.2018.34.008
西南地区是中药材生产和加工的核心区,如重庆太极、云南白药和贵州百灵等几十家全国大型中成药制药企业均在此设立工厂。据估计,我国中药企业每年要消耗植物类药材数百万吨,随之产生的植物类药渣多达几千万吨(含水分)[1]。这些药渣造成大量环境污染,如何有效处理是一个令人深感棘手的大问题。中药渣中含有纤维素、半纤维素、木质素和生物碱等主要组分,其中包括难以降解的生物碱、纤维素和木质素。传统的堆肥处理存在周期长、发酵不充分等问题,其主要原因在于药渣具有较强的抑菌性,一般的堆肥菌剂微生物在药渣中成活率低,生长速度慢,形成不了稳定的高活性菌群[2-3]。目前,关于纤维素降解菌和纤维素酶的研究报道较多[4-8],主要集中于对秸秆、粪便的降解,而关于对中药渣降解的报道则较少[9-12]。本试验以中药渣为降解源,拟从腐熟药渣中初步筛选出高效无毒的抗药性药渣降解菌,再进行复筛,同时对其酶活性进行测定,以便开发出用于药渣好氧堆肥处理的高效微生物菌剂。
1 材料与方法
1.1 试验材料
1.1.1 含菌样品
2014年5月,在太极集团涪陵制药厂药渣堆放区和重庆土原生物科技有限公司药渣堆肥区,采集腐熟药渣样品4份及长期堆放药渣的表层土壤4份。采集样品后立即带回实验室接种,进行富集培养。
1.1.2 培养基
本试验中使用富集培养基、CMC-Na固体培养基、纤维素-刚果红固体培养基及液体产酶培养基等,其具体配置方法参照郭建军等[13]。
1.2 方法
1.2.1 菌种富集
称取菌种来源样品5 g,加入以药渣为唯一碳源的100 mL富集培养基中,28 ℃恒温振荡培养7 d,吸取5 mL培养液转入新的富集培养基,富集3代。
1.2.2 菌种初筛和复筛
取富集3代的培养液适当稀释,在纤维素-刚果红固体培养基上分离纯化菌种,观察平皿上是否出现水解环及水解环的大小;初步比较不同菌株的纤维素酶酶活,并确定用于酶活测定的菌株。将分离得到的优势菌株分别接入液体产酶培养基,在37 ℃振荡培养4 d,将发酵液用2层纱布过滤,滤液于4 ℃、5 000 r·min-1离心20 min,上清液即为粗酶液。
1.2.3 菌群耦合培养
用产酶液体培养基将复选所得的菌株与TEM菌株等比例混合培养,形成TSM、YEM菌群,耦合菌群在2%菌种接种量、32 ℃培养温度、每2 h通气10 min、通气量300 ml·min-1条件下培养5 d,测定各组合菌群的酶活性。
1.2.4 酶活性测定
采用DNS 还原糖法测定各纤维素酶酶活性,包括全酶活性(FPA)、内切酶酶活性(Cx)和外切酶酶活性(CI)[14]。
2 结果与分析
2.1 菌种初筛结果
将腐熟药渣及堆放土壤样品,在以药渣为唯一碳源的培养基中进行3代富集。从药渣高温腐熟阶段筛选出的复合菌系Y-5,在50 ℃静止培养条件下,在第7天可使滤纸的分解率达到83%,其中对纤维素、半纤维素的分解率分别为75%、78%。复合菌系Y-5经过3次富集培养,菌系种类组成和分解能力都具有较好的稳定性,生长速度快。利用CMC分离培养基50 ℃培养分离复合菌系Y-5中的菌株,分离到能以CMC-Na作为唯一碳源生长的高温微生物菌株72株,其中细菌54株、真菌18株,主要由芽孢杆菌属、梭菌属和瘤胃杆菌属组成。分离得到的纤维素降解菌能快速地在纤维素-刚果红固体培养基上产生清亮的水解环,其中L1和L2菌株在平板上较快地产生了较大的水解环。
2.2 菌种复筛结果
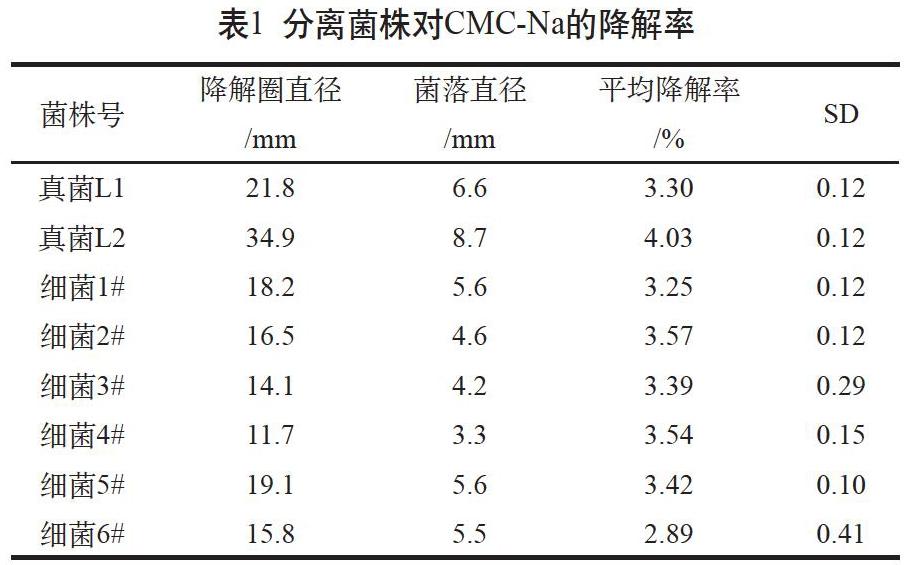
纤维素的降解是多酶体系作用的结果,选择测定降解圈、Cx、CI、FPA 3 种酶活性大小作为菌种的复筛依据。将菌种分别接入以药渣和CMC-Na为碳源的固体培养基和液体产酶培养基。通过CMC-Na固体培养基培养,有8个菌株快速形成菌落和CMC降解圈。菌斑测定结果(见表1)表明,L2菌落直径最大,对CMC-Na的降解率最高,平均降解率达到4.03%;其余菌株的平均降解率均大于2%,表明8个复选菌株都具有较强的纤维素分解能力。
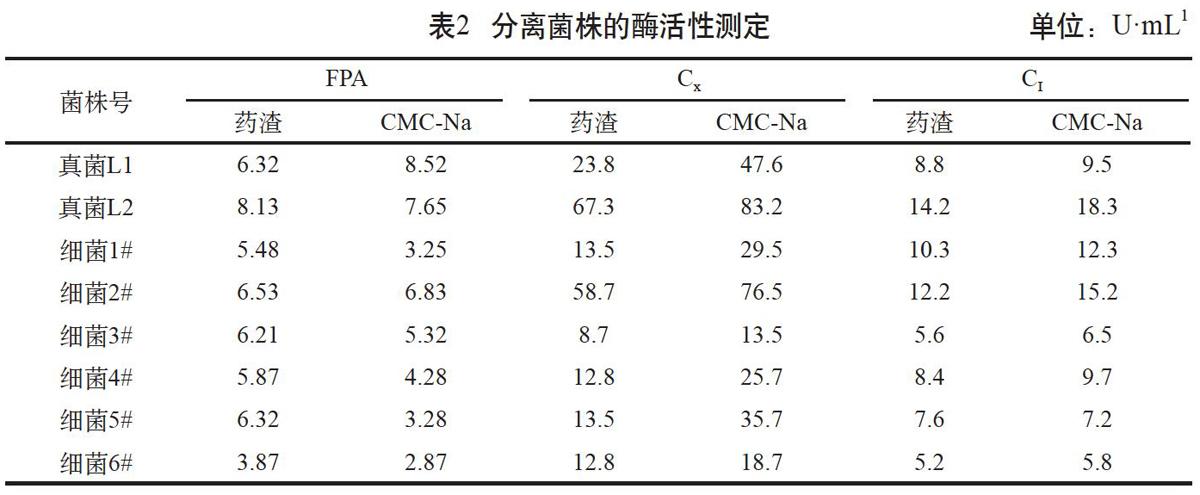
通过药渣和CMC-Na 为碳源的液体产酶培养基培养5 d后的酶活测定结果见表2。对于FPA活性,以药渣为碳源的真菌L2菌株最高,达到8.13 U·mL-1,其次较高的菌株为细菌2#、细菌5#、真菌L1和细菌3#,FPA活性均大于6 U·mL-1。以CMC-Na 为碳源的真菌L1 FPA活性最高,达到8.52 U·mL-1,其次真菌L2和细菌2#相对较高。对于Cx活性,真菌L2和細菌2#在药渣和CMC-Na中碳源均较高,但真菌L1对药渣的外切分解能力较弱,且它们的Cx与其他菌相比差异较大。对于CI活性,在药渣和CMC-Na碳源中,真菌L2、细菌1#、细菌2#的活性较高,但真菌L1在外切酶和总酶活性上较差。这些表明真菌L2和细菌2#菌株降解药渣和纤维素的能力比其他菌株要强,酶活测定结果与水解环测定结果基本吻合。
2.3 菌群耦合结果
YEM菌种培养周期为5 d,培养72 h各组合菌群的菌液OD600均达到1.25以上,活菌数量大于15亿/mL,YEM耦合菌群结构稳定。
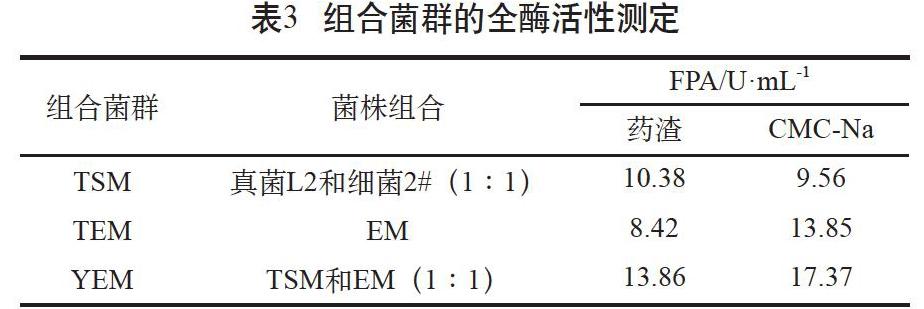
通过酶活性测定结果(见表3)表明,YEM组合菌群无论是在药渣或CMC-Na基质中的纤维素酶全酶活性FPA显著高于单一菌株的酶活性。常规堆肥TEM菌群在CMC-Na基质中表现出较高的FPA活性,但在以中药渣为单一基质中的FPA活性较低。YEM组合菌群因添加了对药渣降解能力较强的菌株,其纤维素全酶活性在药渣和CMC-Na基质中都表现出明显增加趋势,其中在药渣基质中FPA活性提高64.6%,在CMC-Na基质中也提高25.4%。筛选的抗药性药渣降解菌株真菌L2、细菌2#具有良好的共生增效特性,与EM耦合菌群结构稳定,增效明显,YEM菌群在中药渣处理中具有广泛的应用前景。
3 结论
针对中药渣的抑菌特性,从药渣高温腐熟阶段筛选出的复合菌系Y-5,在50 ℃静止培养条件下,在第7天可使滤纸的分解率达到83%,其中对纤维素、半纤维素的分解率分别为75%、78%。利用CMC-Na分离培养基50 ℃培养分离,从Y-5供试样品中分离到能以CMC-Na作为唯一碳源生长的高温微生物菌株72株,其中细菌54株、真菌18株;利用刚果红纤维素筛选培养基进行进一步筛选,得到具有较强纤维素降解能力的菌株8株,其中细菌6株、真菌2株,复选菌株对纤维素的降解率均大于3.0%。通过药渣基质和CMC-Na基质产酶活性测定,筛选出真菌L2和细菌2#菌株对药渣和纤维素降解能力都强的抗药性菌株。通过菌群耦合培养,获得了结构稳定的YEM耦合菌群,菌种培养5 d活菌数量大于15亿/ml,YEM菌剂的纤维素酶活性较Em菌剂提高25.4%~64.6%,尤其是对中药渣的降解能力提高64.6%,在中药渣处理中具有广泛的应用前景。
参考文献:
[1] Guo FQ, Dong YP, Zhang TH, et al. Experimental study on herb residue gasification in an air-blown circulating fluidized bed gasifier[J]. Ind Eng Chem Res, 2014, 53(34): 13264-13273.
[2] 何京钟.中草药渣堆肥中试及微生物群落研究[D].北京:中国科学院大学,2015.
[3] 焦巧芳.中药渣微生物转化利用菌种筛选研究[D].杭州:浙江师范大学,2010.
[4] 郭夏丽,杨小丽,李顺义,等.秸秆降解菌的筛选及菌种组合[J].郑州大学学报(工学版),2010,31(1):74-77.
[5] 李瑜,王琦,陈五岭.牛粪堆肥高效降解菌的筛选及复合微生物菌剂的制备[J].安徽农业科学,2008,36(35):15653-15655.
[6] 胡华.高效纤维素降解菌株的筛选及其复合系菌剂在秸秆堆肥中的应用[D].四川农业大学,2008.
[7] 王元明.高温纤维素降解菌的筛选及其复合菌剂对秸秆降解效果的研究[D].南京农业大学,2013.
[8] 史龙翔.纤维素降解菌的筛选及其在果树枝条腐解中的应用[D].西北农林科技大学,2015.
[9] 曾飞,张森,钱大玮,等.甘草药渣降解菌的筛选及其产酶工艺研究[J].生物技术通报,2017,33(12):125-131.
[10] 封晔.高产纤维素酶菌株的筛选及药渣发酵工艺研究[J].食品安全导刊,2015(33):140-141.
[11] 张英,郑清炼,周裕权,等.融合菌株转化黄芪药渣生产乙醇的工艺[J].中成药,2016,38(6):1421-1424.
[12] 龙良鲲,寒子纯,林群英,等.黄芪药渣中多糖的酶法制备及其抗氧化活性[J].江苏农业科学,2018,46(1):137-140.
[13] 郭建軍,范汉东,黄晓萍,等.药渣纤维素降解菌的筛选及酶活测定[J].湖北农业科学,2012,51(4):689-692.
[14] 张楠,杨兴明,徐阳春,等.高温纤维素降解菌的筛选和酶活性测定及鉴定[J].南京农业大学学报,2010,33(3):82-87.

