悬钩子属野生种和栽培种资源SSR引物筛选与评价
耿佳麒,王宇航,雷蕾,孙海悦,周强,唐雪东,梁英海

摘要 [目的]分析悬钩子属植物的遗传多样性,研究现存悬钩子SSR引物的通用性。[方法]通过简单重复序列标记(SSR)用12份悬钩子属野生和栽培种类资源对40对引物进行筛选。[结果]共筛选出8对引物对全部12个样品扩增良好,多态性比率为100%,可用于遗传多样性的分析。[结论]该试验筛选的8对引物可为下一步研究提供依据。
关键词 悬钩子;SSR引物;筛选;评价
中图分类号 S663.2 文献标识码 A 文章编号 0517-6611(2018)06-0083-04
Screening and Evaluation of SSR Primers in Wild and Cultivated Species of Rubus L.
GENG Jiaqi,WANG Yuhang,LEI Lei et al (Jilin Agricultural University, Changchun, Jilin 130118)
Abstract [Objective]To analyze the genetic diversity of Rubus L. and study the universality of the existing SSR primers of Rubus L.. [Method]Forty pairs of primers were screened from 12 wild and cultivated species of Rubus L.by simple repeated sequence marker (SSR). [Result]8 pairs of primers were screened and amplified all 12 samples with a polymorphism ratio of 100%, which could be used for genetic diversity analysis. [Conclusion]The 8 pairs of primers in this experiment can provide the basis for further study.
Key words Rubus L.;SSR primers;Screening;Evaluation
悬钩子(Rubus L.)是多年生落叶灌木植物[1],种类丰富,杂合度高,在寒带及温带地区均有分布。在我国,悬钩子属植物有150个种以上[2]。悬钩子属栽培品种具有较高的经济价值和药用价值,其果实可用于鲜食、加工和医用[3-4]。
随着果树分子生物技术快速发展,国内外学者在形态学、孢粉学、细胞学以及同工酶鉴定研究基础上,加大了对悬钩子属植物资源分子水平的研究[4],应用分子标记分析了悬钩子属植物的遗传多样性[5]。目前,已有利用SSR和RAPD分子标记分析悬钩子栽培种资源遗传多样性的报道[6],但对悬钩子野生种资源的研究较少。
悬钩子属树莓属于第三代新兴小浆果[7]。在农业供给侧结构性改革和生态建设背景下,有必要对我国蕴藏的大量悬钩子野生资源进行有效收集评价和开发利用,其遗传多样性研究是重要的基础工作。由于悬钩子属植物类型多样,杂合度高,可应用SSR分子标记开展相关研究。目前,悬钩子属植物SSR引物主要为苏格兰詹姆斯·赫顿研究所(http://www.hutton.ac.uk/)以及Graham等[8]所开发引物,这些引物是否适用于我国野生悬钩子资源鲜见报道。该研究旨在筛选评价Graham等所开发引物,以供国内相关研究参考,并考察相同SSR引物在不同地缘分布资源间的通用性问题,以提出悬钩子属植物分子水平资源研究建议。
1 材料与方法
1.1 材料
1.1.1 植物材料。植物材料有茅莓悬钩子、库页悬钩子、牛迭肚、绿叶悬钩子、黄树莓、黑树莓、欧洲莓、奥瑞斯8份资源,以及于2016年于蛟河采集的野生资源牛迭肚(J-1-3)、牛迭肚(J-1-4)、牛迭肚(J-2-1)、牛迭肚(J-2-2)4份,共12份材料(表1)。取上述材料嫩叶,供提取基因组DNA。
1.1.2 药品。CTAB、Tris碱、氯化钠、氢氧化钠、β-巯基乙醇、无水乙醇、三氯甲烷、异戊醇、琼脂糖、甲叉丙烯酰胺、过硫酸铵、TEMED、rTaq预混酶、超纯水。试验药品购于TaKaRa公司。
1.1.3 引物。SSR引物为Graham等[8]开发的30对引物和詹姆斯·赫顿研究所开发的10对引物,SSR引物由金唯智公司合成。
1.2 方法
1.2.1 DNA提取与检测。供试材料在液氮中研磨至粉末状,加入离心管中,采用CTAB法[9]提取12份样品的DNA,并用1%琼脂糖凝胶电泳检测其DNA质量,用超微量分光光度計检测DNA浓度与纯度,将条带清晰、质量良好的DNA稀释至20 ng/μL,-20 ℃冰箱中保存备用。
1.2.2 SSR-PCR扩增。PCR所采用的体系是经过优化的最适体系,退火温度为55 ℃。采用20 μL反应体系:ddH2O 11.2 μL,上游引物0.8 μL,下游引物0.8 μL,模板DNA(DNA浓度为20 ng/μL)3 μL,TaqDNA聚合酶(5 U/L)0.2 μL,dNTP(10 mmol/L)1.2 μL,10×Buffer(含Mg2+)2 μL。95 ℃预变性5 min;95 ℃变性1 min,55 ℃退火1 min,72 ℃延伸1 min,共30个循环;72 ℃延伸5 min;4 ℃保存。
1.2.3 PCR产物检测。
1.2.3.1 琼脂糖凝胶电泳。PCR产物用1.5%琼脂糖凝胶电泳检测其扩增结果,将扩增出的条带清晰且多态性好的引物进行下一步聚丙烯酰氨凝胶电泳检测。
1.2.3.2 6%聚丙烯酰胺凝胶电泳。①清洗,用洗涤剂清洗玻璃板后蒸馏水冲洗干净,用无水乙醇清洁后晾干备用;②注胶,安装好玻璃板后,将1%琼脂糖凝胶注入玻璃板底部,密封玻璃板,注意不要有气泡;待胶凝固后,将配制好的聚丙烯酰胺凝胶定点缓慢注入玻璃板空隙(注入过程应尽量避免气泡的产生),插入齿梳,避免齿梳周围产生气泡,静置50~60 min待凝胶凝固;③预电泳,凝胶凝固后,小心拔出齿梳,用电泳液冲洗胶孔;玻璃板内槽加满1×TBE缓冲液,外槽缓冲液加至1/3体积即可,设置电压350 V,电流500 mA,预电泳60 min;④上样,按照样品∶上样缓冲液=10∶3比例混合,待预电泳结束后进行上样,电压240 V,电流500 mA,电泳90 min。
1.2.3.3 银染。电泳结束后,取下凹型玻璃板,将凝胶留在平板玻璃上。①清洗,清水冲洗胶面30 s,蒸馏水冲洗胶面30 s;②固定,固定液没过胶面,摇10~20 min;③洗胶,蒸馏水冲洗胶面2 min,冲洗2次,倾斜玻璃板沥水;④染色,硝酸银染色液没过胶面,摇6 min;⑤洗胶,蒸馏水冲洗凝胶10 s左右,冲洗2次,取出胶板,沥干;⑥显色,将胶板浸于提前预冷的500 mL显色液中,摇床摇至所有条带出现,即停止显色;⑦洗胶,蒸馏水冲洗胶板2 min;⑧固定,胶板完全浸于固定液,固定10 min,清洗干净后,沥干水再进行拍照和后续数据分析。
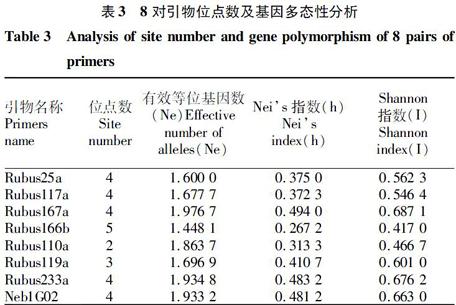
1.3 统计分析 根据聚丙烯酰氨凝胶电泳条带片段大小和SSR特异性条带特点,使用GEL-PRO软件,将同一引物相同片段大小SSR特异条带计为1,无条带记为0,扩增不良或非特异性条带不计入其中,形成0-1矩阵,并用Popgene 32软件,分析多态性位点百分比(PPB)、有效等位基因数(Ne)、Neis指数(h)、Shannon指数(I)。
2 结果与分析
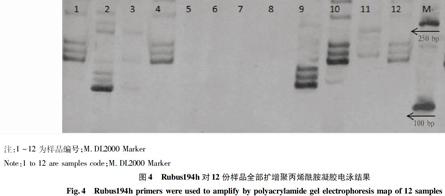
2.1 SSR引物筛选结果 利用40对(表2)SSR引物对12份供试材料进行SSR-PCR扩增,经电泳检测,共有8对SSR引物在12份资源中扩增出差异性强和多态性良好的产物(表2、图1、图2),分别为Rubus25a、Rubus110a、Rubus117a、Rubus119a、Rubus166b、Rubus167a、Rubus233a、Neb1G02,占总引物数的20%,多态性百分率为100%,这些引物可以在野生种和栽培种中扩增出条带。Rubus123a、Rubus194h、Neb1A10、Neb1J15、Neb1k24引物,仅在茅莓悬钩子、库页悬钩子、绿叶悬钩子中成功扩增出条带,但是对于牛迭肚悬钩子扩增效果较差(图3、4)。
2.2 引物多态性分析 所筛选出的8对引物共扩增出142条带,平均每个引物扩增出17.75条带。根据目的条带大小统计,每个引物最多扩增出2个位点,引物Rubus110a检测出的条带最多为18条,Rubus25a检测出的条带最少为12条。全部引物的目的片段均为100~250 bp,所统计的条带数目均在目的条带上下,片段大小差异不大。
2.3 SSR位点分析 应用Popgene32软件分析8对SSR引物扩增获得的0-1矩阵数据,表明每个位点的有效等位基因数(Ne)在1.600 0~1.976 7,平均等位基因数为1.766 6。Neis基因多样性指数(h)分布在0.267 2~0.494 0,平均每个位点的Neis指数为0.399 8。所得到的Shannon指数(I)为0.417 0~0.687 1,平均值为0.579 1(表3)。
3 讨论与结论
3.1 悬钩子属植物资源有待评价开发利用 我国大小兴安岭、长白山等地区蕴藏丰富的悬钩子属资源,但由于全球气候变化和人为活动频繁,树莓资源正在严重流失,需要有针对性开展资源收集评价与开发利用工作,而利用分子标记技术开展分子水平资源研究具有重要意义。Graham 所開发的SSR引物在国内外相关研究中应用广泛,用于遗传多样性[10]、亲缘关系[11]、遗传图谱构建[8,12],但国外多数研究集中于栽培品种(品系),甚至只给出引物出处,未明确指明引物名称或序列,给相关研究带来被动局面;国内学者也应用这些引物开展相关分子标记研究[13],亦主要研究树莓栽培资源。该研究针对上述情况,评价筛选出8对SSR引物用于茅莓悬钩子、库页悬钩子、绿叶悬钩子、牛迭肚等资源SSR-PCR扩增,可为相关资源分子水平评价提供重要数据参考。
3.2 悬钩子属植物SSR引物通用性及开发利用 该研究考察了Graham等利用国外资源开发的引物在我国野生和栽培种中的通用性问题,在选用的40对SSR引物中仅筛选出8对引物用于全部供试材料,表明了不同地理分布栽培资源间,尤其栽培与野生资源间存在引物通用性,也表明了悬钩子属植物SSR序列进化保守性。
目前,SSR分子标记技术已广泛用于果树遗传多样性、亲缘关系和遗传图谱构建研究[14-17],应用价值较高。由于该研究仅在7个栽培和野生种共计12份资源上评价了供试引物,且仅获得8对可在全部材料成功扩增的引物,在引物数量和资源针对性上,不能满足未来对丰富悬钩子属资源收集保存评价利用工作的需要。在组学和大数据时代[2,18-20],可利用新方法新技术,针对我国悬钩子属植物资源,开发利用分子标记,尤其是功能分子标记[20],支撑和促进树莓等小浆果产业发展。
参考文献
[1] 中国科学院中国植物志编辑委员会.中国植物志[M].北京:科学出版社,1998.
[2] 宋洪伟,张冰冰,梁英海,等.我国穗醋栗、树莓等小浆果资源研究与利用现状[J].吉林农业科学,2011,36(5):56-58.
[3] 李正涛.树莓果酒发酵工艺研究[J].安徽农业科学,2010,38(36):20729-20731,20758.
[4] 陈亮,刘冉,辛秀兰,等.果胶酶澄清红树莓果酒的研究[J].食品研究与开发,2014(7):58-61.
[5] SCHNELL R J,KNIGHT R J Jr,SCHAFFER B.Genetic relationships among Mangifera spp.based on RAPD makers[J].Acta horticulturae,1993,341:86-92.
[6] 卞贵建.树莓品质评价及其RAPD反应体系的建立与优化[D].雅安:四川农业大学,2005.
[7] 周繇.长白山野生果树资源的调查[J].东北林业大学学报,2004,32(1):86-88.
[8] TAI T H,TANKSLEY D D.A rapid and inexpensive method for isolation of total DNA from dehydrated plant tissue[J].Plant molecular biology reporter,1990,8(4):227-303.
[9] TENG H,CHEN L,HUANG Q,et al.Ultrasonicassisted extraction of raspberry seed oil and evaluation of its physicochemical properties,fatty acid compositions and antioxidant activities[J].PLoS One,2016,11(4):1-17.
[10] GRAHAM J,SMITH K,WOODHEAD M,et al.Development and use of simple sequence repeat SSR markers in Rubus species[J].Molecular ecology notes,2002,2(3):250-252.
[11] GRAHAM J,SMITH K,MACKENZIE K,et al.The construction of a genetic linkage map of red raspberry(Rubus idaeus subsp.idaeus)based on AFLPs,genomicSSR and ESTSSR markers[J].Theoretical & applied genetics,2004,109(4):740-749.
[12] SARGENT D J,FERNNDEZFERNNDEZ F,RYS A,et al.Mapping of A1 conferring resistance to the aphid Amphorophora idaei and dw(dwarfing habit)in red raspberry(Rubus idaeus L.)using AFLP and microsatellite markers[J].BMC Plant Biology,2007,7(1):1-9.
[13] 李媛媛.树莓种质资源遗传多样性及创新研究[D].沈阳:沈阳农业大学,2009.
[14] KOSTAMO K,TOLJAMO A,ANTONIUS K,et al.Morphological and molecular identification to secure cultivar maintenance and management of selfsterile Rubus arcticus[J].Annals of botany,2013,111(4):713-721.
[15] 李玲,湯浩茹,段娟,等.中国悬钩子属植物的分类鉴定与开发利用[J].安徽农业科学,2006,34(8):1513-1516.
[16] 段娟,汤浩茹,王小蓉,等.遗传标记在树莓种类鉴定中的应用研究进展[J].中国农学通报,2006,22(6):57-61.
[17] 王学勇,张均营.树莓和黑莓的研究进展[J].安徽农业科学,2010,38(10):5070-5073.
[18] 杨燕林,唐开学,和加卫,等.悬钩子属植物分子标记技术和基因组研究进展[J].中国农学通报,2008,24(8):93-98.
[19] 杨婷婷.树莓的研究现状及开发利用[J].四川林业科技,2013,34(3):29-33.
[20] BUSHAKRA J M,LEWERS K S,STATON M E,et al.Developing expressed sequence tag libraries and the discovery of simple sequence repeat markers for two species of raspberry(Rubus L.)[J].BMC Plant Biology,2015,15(1):258.

