昆明高校园林植被光合及光谱特性研究
陈云,王金亮,*,杨艳林,段平,李佳
1.云南师范大学旅游与地理科学学院,昆明 650500 2.云南省高校资源与环境遥感重点实验室,昆明 650500 3.云南省地理空间信息工程技术研究中心,昆明 650500
1 前言
光合作用是植物最重要的生理机能,也是生物赖以生存的基础,植物通过光合作用固碳释氧,维持大气碳-氧平衡;实现光能到化学能的转换,为人类提供能源;将无机物转变为有机物,作为食物来源。目前,国内外学者对此进行了大量研究,环境条件不同[1–3]和环境胁迫[4–7]会使植物生理特性产生差异。地物光谱特征是现代遥感技术研究的重要内容之一,它是选择传感器波段的依据,也是分析各种遥感数据的基础。地物高光谱遥感技术广泛应用于环境监测、植被监测、矿物识别、土地覆盖分类等领域[8],植物光谱反射信息可以反映出植物的营养状况[9]和植物所处环境的变化[10],研究表明植物光谱特征与植物生理有着密切的关系,可用于估测植物叶绿素含量和水分含量,推断植物光合能力,监测植物生长状况等[11]。园林植被在城市生态系统中具有重要的生态效益,如美化环境、调节小气候、净化空气、吸尘降噪、提供休憩场所等,高校园林植物还承担着科研教学、美观欣赏、娱乐等功能。已有研究表明,城市园林植物具有较强的固碳释氧能力[12–13],植物单位叶面积日固碳释氧能力大小依次为:乔木>藤本>灌木[14]。虽然前人对植物光合和光谱进行了大量研究,但对园林植物光合和光谱特性的综合研究较少。云南师范大学呈贡校区的植物类型丰富,基本涵盖了昆明地区高校园林植物主要类型,以呈贡校区作为研究区,对常见的10种高校园林植物的光合及光谱特性进行研究,可为该地区高校园林植被的合理配置与园林生态动态监测提供参考。
2 材料与方法
2.1 研究区概况
研究区为云南师范大学呈贡校区,位于昆明市呈贡区,地处滇中高原东部,滇池东岸,东经102°50¢52 ¢, 北纬 24 °51 ¢44 ¢, 平均海拔 1899 m。研究区属于北亚热带低纬高原半湿润季风气候,日照长,气候温和,四季如春,年均日照数2200小时,年平均温度约15℃,年平均降水量约790 mm,干湿两季分明,雨季5月至10月,降水量约占全年降水量的80%,气温日较差大,年较差小,全年无霜期长,约为280天,土壤类型为熟化旱作土壤[15]。滇中高原地带性植被类型为北亚热带半湿润常绿阔叶林[16],研究区内植物种类丰富,有木本植物上百种,但多为外来树种。
2.2 研究材料选取
测量实验于2017年1月进行,选取了云南师范大学呈贡校区校园内部分常见常绿阔叶植物,共10种。其中,乔木7种,分别为滇润楠(Machilus yunnanensis)、广玉兰(Magnolia grandiflora)、红花木莲(Manglietia insignis)、乐昌含笑(Michelia chapensis)、球花石楠(Photinia glomerata)、香樟(Cinnamomum camphoral)、枇杷(Eriobotrya japonica);灌木2种,分别为八角金盘(Fatsia japonica)、洒金叶珊瑚(Aucuba japonica),1种藤本植物为常春藤(Hedera jelix)。选取的每种植物样本均为校园内生长良好的健康植株,每种3株。
2.3 研究方法
2.3.1 光合作用参数测定
植物光合作用参数的测定包括三部分:光合作用速率日变化、光合-光强响应曲线和叶绿素荧光参数,利用GFS-3000便携式光合-荧光测量系统(德国WALZ公司生产)对其进行测量。
(1)选择光照条件较好的晴朗白天(8:00—17:00),对随机选取的受光照较充分的健康成熟叶片进行3次重复连体测量,以得到其光合作用日变化曲线。
(2)使用红蓝光源设定梯度光照强度进行连体测量,测定植物净光合作用速率,拟合光合-光响应曲线。梯度光强依次设置为0、30、50、100、200、300、400、600、800、1000、1200、1400、1600、1800 和 2000 μmol·m-2·s-1, 在测定时, 使植物适应每一梯度光强3—5 min。
(3)使用GFS-3000荧光模块对荧光参数进行测量,时间均在21:00—22:00进行,以便使植物充分进行暗适应,数据记录每次均间隔3—5 min,饱和脉冲光强为 2000 μmol·m-2·s-1。
2.3.2 光谱测定
利用美国SVC HR-1024i地物光谱仪,获取植被反射光谱信息。测量均在晴朗少云天气进行,时间为11:00—15:00之间,每种植物选取3株,测量10—15条光谱。鉴于实验需求,仅选取350—1000 nm波段的光谱信息用于分析,在此波段内,光谱分辨率≤3.5 nm,最小采样带宽≤1.5 nm。
2.3.3 数据处理
使用Excel、SPSS和SVC HR-1024i配套软件对采集的光合和光谱数据进行处理与分析,包括光谱数据预处理、数据统计、回归模型分析、相关性分析等,其中光谱数据预处理包括白板反射率校正、平滑去噪、融合等过程,并通过计算得到各植被光谱反射指数,其计算方法见表1:
3 结果与分析
3.1 植物光合作用日变化分析
10种植物气孔导度(Gs)、蒸腾速率(Tr)、胞间CO2浓度(Ci)、气孔限制值(Ls)和净光合速率(Pn)的日变化趋势既有相关性,但又存在差异(图1)。Gs日变化趋势表现为先增加后降低,再增加或者降低。其中,广玉兰、滇润楠、枇杷、八角金盘、洒金叶珊瑚和常春藤在上午9:00时达到最大值,红花木莲、乐昌含笑和香樟在上午11:00达到最大值,球花石楠在下午13:00达到最大。乔木在下午13:00时Gs普遍有较大幅度降低或开始下降,两种灌木在9:00开始下降;常春藤在11:00达到一个低值,并在之后变化缓慢。滇润楠、乐昌含笑、八角金盘出现明显的“双峰”变化趋势,广玉兰、红花木莲、香樟、洒金叶珊瑚和常春藤有微弱的“双峰”现象,球花石楠和枇杷则呈“单峰”变化趋势。Gs值的变化主要可能是因为外部环境的改变,正午前后温度升高,且昆明此时为干季,相对湿度较低,植物通过控制气孔开闭以减少水分的耗散。Gs平均值以红花木莲最高,最低的为枇杷,除枇杷Gs值较低外,乔木Gs日均值均大于灌木和藤本。
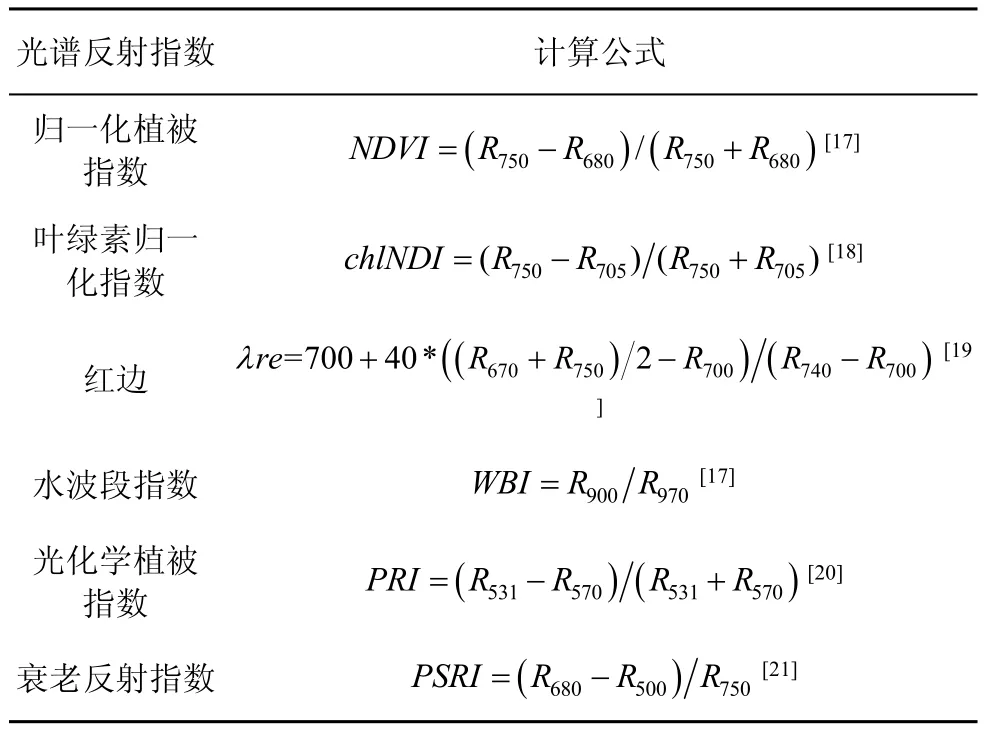
表1 植物光谱反射指数及计算方法Tab.1 Spectralreflectance vegetation index and calculation method
Tr日变化趋势与Gs大体一致,除枇杷外,乔木Tr值整体上大于灌木和藤本。大多在11:00—13:00时形成峰值,此后Gs减小,Tr也随之减小。Gs变化会直接影响Tr值的变化,但存在Tr的降低与Gs的降低的时间与程度不一致,滇润楠和红花木莲没有出现“双峰”现象,并且乔木峰值主要出现在11:00—15:00之间,与Gs相比延后,可能是在正午前后,虽然气孔开始关闭,但气温升高使得Tr仍然较大;灌木、藤本植物以及枇杷可能由于处于光强相对较弱的环境,Tr与Gs变化趋势基本一致。10种植物Tr平均速率由高到低依次为乐昌含笑、红花木莲、滇润楠、球花石楠、广玉兰、香樟、八角金盘、洒金叶珊瑚、常春藤和枇杷。
Ci值除常春藤在8:00—9:00有微弱增加外,8:00—11:00总体变化趋势为下降,大多在11:00—13:00达到最低值。乔木中球花石楠则一直呈下降趋势,最后在10种植物中最低,这可能与球花石楠Gs值在15:00后持续下降并处于较低值,但净光合速率又维持在较高水平有关;其他乔木下降之后则有小幅上升或呈小幅波动变化。相比乔木,11:00前两种灌木和藤本植物Ci值下降幅度小,这可能与此时乔木的光合速率大有关;11:00后,灌木呈现小幅波动状态,藤本植物常春藤则增加幅度较大。
由于大气CO2浓度(Ca)基本上维持在一个较稳定的水平,根据Ls的计算方法可得出,Ls的变化趋势应随Ci的变化而成相反方向的变化。但是在实际测量过程测量时间的不同、外部环境(如风速、风向、温度等)不同以及仪器自身的误差等客观原因,Ca值会发生变化。因此Ls值呈现出波动的状态,如除枇杷外,另外六种乔木在8:00—17:00的时间段整体上呈增加趋势,但在9:00—15:00则有小幅波动;枇杷、常春藤和两种灌木则在一天中出现较为明显的波动。
10种植被Pn整体上乔木高于藤本植物,藤本植物略高于灌木。测量时段内,乔木除枇杷外,其他乔木Pn有明显的增加,在11:00左右达到较高水平;在13:00时除球花石楠Pn达到最大外,其他乔木此时Pn出现明显减低,出现明显的“午休”特征。乔木Pn日最大值从大到小依次为:红花木莲>滇润楠>香樟>乐昌含笑>球花石楠>广玉兰>枇杷,平均净光合速率由大到小依次为:滇润楠>红花木莲>乐昌含笑>香樟>球花石楠>广玉兰>枇杷。灌木和藤本植物属于阴生植物,Pn较低,常春藤优于其余两种灌木,常春藤、八角金盘和洒金叶珊瑚在9:00—11:00由于光照增强温度升高,光合速率下降。枇杷Tr、Gs和Pn日变化值显著小于其他乔木,甚至低于灌木和藤本植物,并在9:00开始持续下降到较低水平,这可能与枇杷基本种植于建筑物墙下,且位于建筑物北面,光照不充分,生长情况较差有关,经过试验,在对枇杷给定一个红蓝光源后,光合作用速率有明显上升, 可以达到 8 μmol·m-2·s-1甚至更高, 因此枇杷种植的不合理布局而受光照不充分是导致其光合作用较低的主要原因。
植物光合速率下降原因有气孔限制和非气孔限制[22],可依据Ci和Ls的变化方向进行判断[23–24]。因此,在正午前后,乔木Pn值下降(枇杷在9:00开始出现下降),植物出现午休现象,此时都呈现Ci值下降而Ls增加,表明此时主要是受气孔限制影响;而测量时段内,在傍晚时分,红花木莲Pn值出现第二次下降,但此时Ci浓度上升,Ls下降,表明此时主要受非气孔因素限制,此时外部环境如光照强度、温度等下降,使得净光合作用速率下降。两种灌木和藤本植物都在九点开始Pn值开始下降,但不同的是八角金盘属于气孔限制,而洒金叶珊瑚和常春藤则是受非气孔因素影响。
3.2 植物光合-光响应曲线分析
非直角双曲线模型是目前拟合光合-光响应曲线较普遍使用的模型[25],将相关数据导入SPSS 22分析软件中,进行非线性分析,根据非直角双曲线模型公式:

其中,Pn为净光合速率,AQE为表观量子效率,PAR为有效光合辐射,Amax为最大净光合速率,Rday为暗呼吸速率,K为曲率。在设置AQE、Amax、Rday、K初始值后,运行SPSS软件进行迭代运算,即可得到模型模拟值[26]。得到的光合-光响应曲线如图2。
10种植Pn对光强的响应趋势基本一致,在有效光合辐射(PAR)处于较低水平(<200 μmol·m-2·s-1)时,植物Pn增长较快,说明在低PAR下植物利用光能的效率较高。随着有效光合辐射的增加,净光合速率增长幅度变缓。由于模型本身的特点,光合光响应曲线是一条趋近于极值的渐近线[27]。枇杷虽然生长在无阳光直射的环境下,但本次实验发现其对光强的响应是最显著的,最大净光合速率在所有植物中最大;藤本和灌木虽然为阴生植物,但仍然有较高的光合作用潜力。从光合-光响应曲线可知,合理配置植物将可以获得更高的环境效益。
结合在低光强(<200 μmol·m-2·s-1)部分的线性回归分析,可得到相应光合参数值(表2)。Rday最大的是的是红花木莲,最小的枇杷;光补偿点(LCP)最大的是红花木莲,最小的是常春藤;光饱和点(LSP)最大的是广玉兰,最小的是常春藤;Amax最大的是广玉兰,最小值为洒金叶珊瑚;AQE表示植物利用弱光的能力,其值较大植物有常春藤、广玉兰、八角金盘和洒金叶珊瑚,高于另外六种乔木,表明它们对弱光环境有更强的适应能力,AQE值最小为枇杷。Rday、LCP、LSP的值充分反映了阳生植物与阴生植物的生长特点。
3.3 植物叶绿素荧光
叶绿素荧光被称为是植物光合作用的探针,它能反映植物进行光合作用的能力与效率,对植物光合作用研究具有重要作用[28]。初始荧光(F0)是PSⅡ反应中心处于开放时的荧光值,可反映叶绿素的浓度;最大荧光(Fm)是PSⅡ反应中心处于关闭时的荧光水平,反映了PSⅡ中电子传递状况;最大光化学效率(Fv/Fm)表示对光能的转化效率,可以反映植物受胁迫条件的状况[29];光化学淬灭系数(qP)指植物获得的光量子通过光能耗散掉的能量,非光化学淬灭(NPQ)则表示以热能耗散掉的能量[30]。几种植物的荧光参数差异较大(表3),F0值较大的植物有洒金叶珊瑚、常春藤、球花石楠、枇杷,较小的有红花木莲、乐昌含笑;Fm值较大的为枇杷、洒金叶珊瑚、常春藤、八角金盘;对光能的转换效率由高到低依次为:八角金盘、枇杷、乐昌含笑、洒金叶珊瑚、红花木莲、常春藤、香樟、球花石楠、滇润楠和广玉兰,qP和NPQ值最低的均为枇杷,由于其所处环境能量获取并不充足,因此以光和热能耗散的能量相对较少。
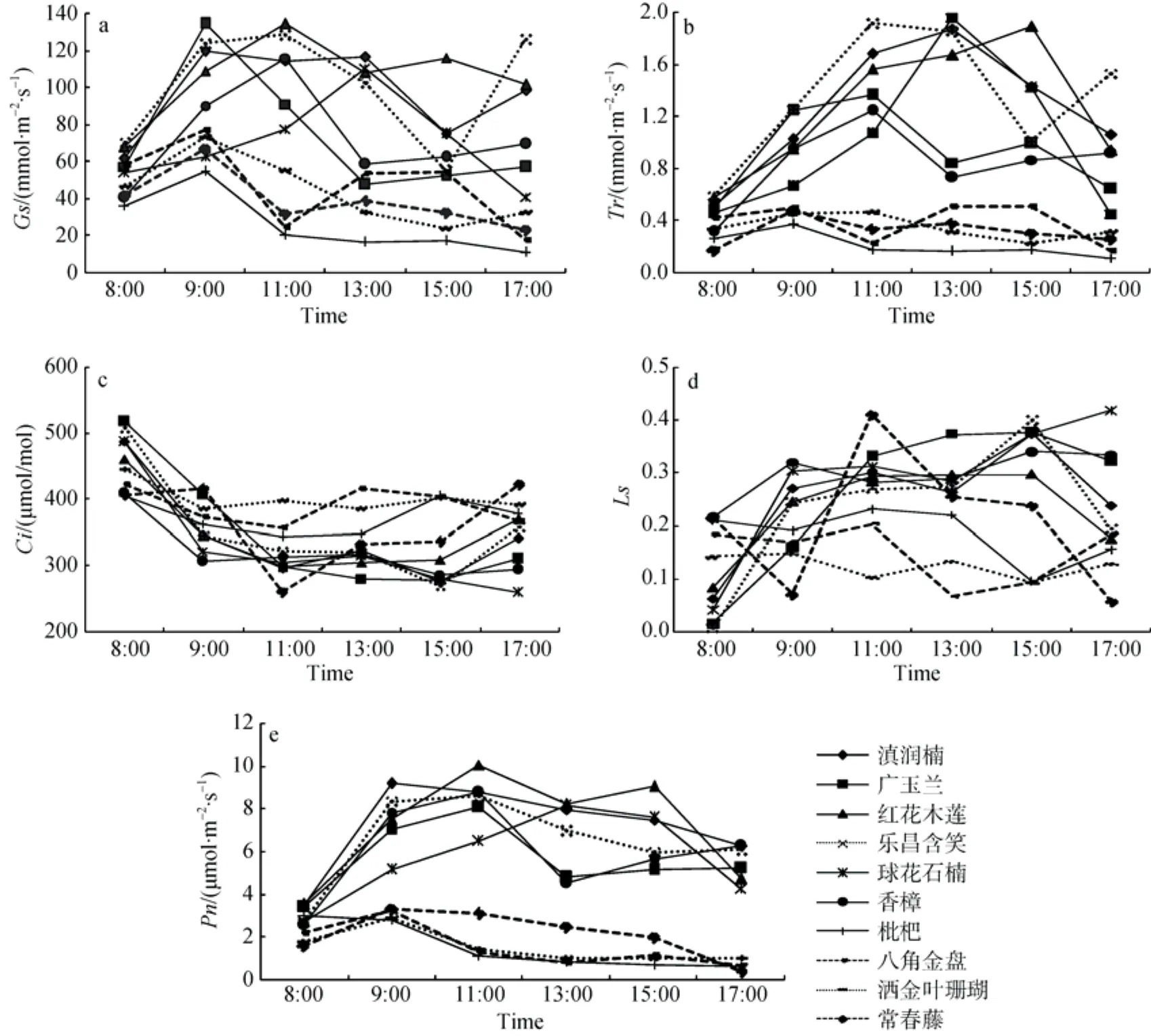
图1 Gs(a)、Tr(b)、Ci(c)、Ls(d)、Pn(e)日变化Fig.1 Diurnal changes in Gs(a),Tr(b),Ci(c),Ls(d)and Pn(e)
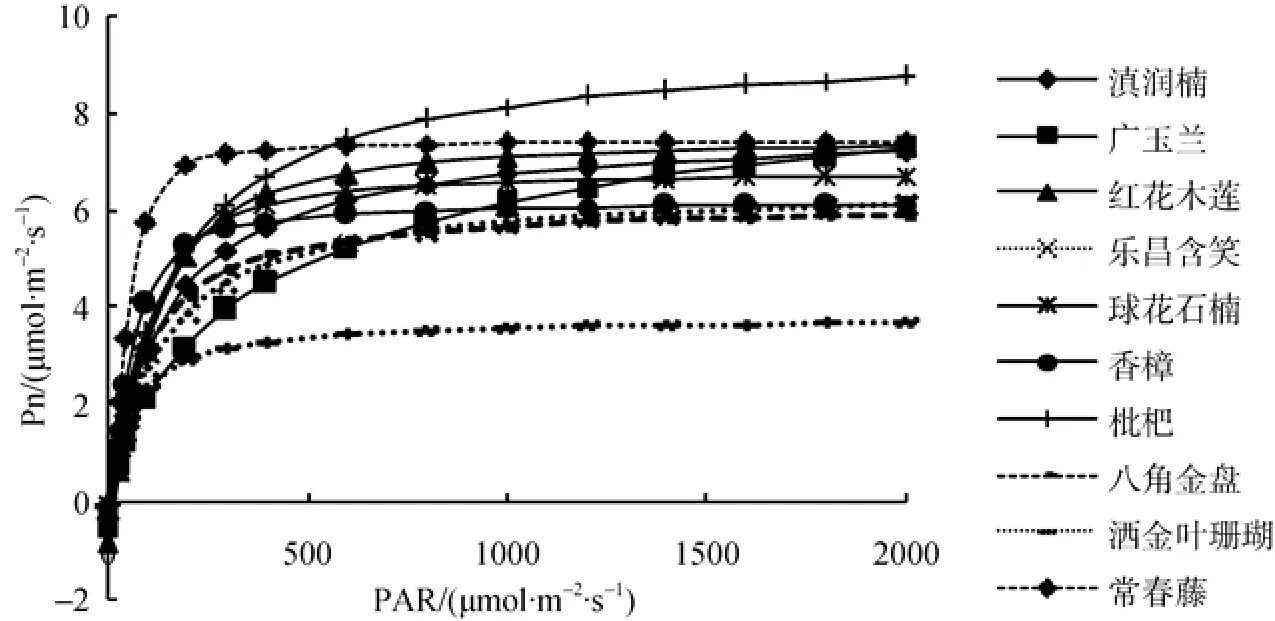
图2 光合-光响应曲线Fig.2 Photosynthesis-light response curve
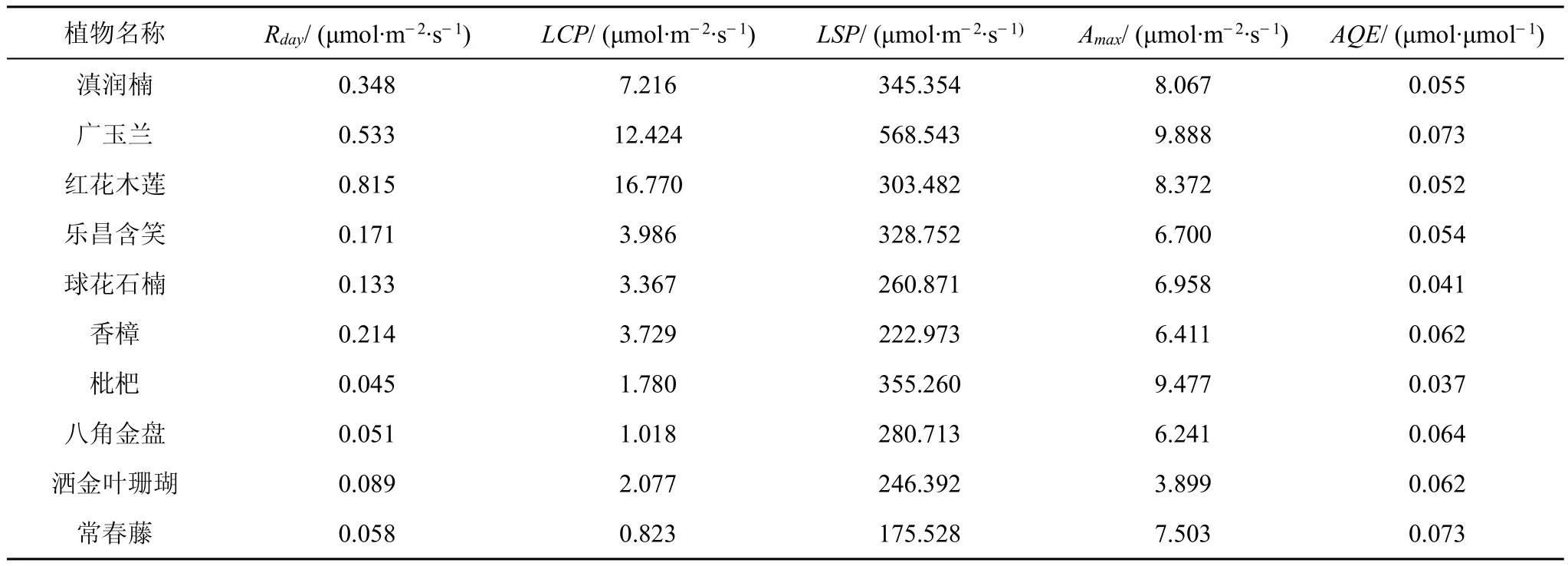
表2 植物叶片光合参数Tab.2 Photosynthetic parameters of plant leaves
3.4 植物光谱与植被指数分析
10种植物的反射光谱曲线变化趋势基本相同,但由于植物自身生理状态如叶绿素含量、水分含量等不同,不同植物反射光谱存在差异(图3)。10种植物在350 nm—700 nm波长范围内光谱反射率较低,但在550 nm—560 nm波长处出现反射率峰值,其值从大到小依次为:滇润楠、洒金叶珊瑚、乐昌含笑、常春藤、广玉兰、球花石楠、八角金盘、香樟、红花木莲、枇杷;在波长670 nm—690 nm处出现明显的光谱吸收谷,此时光谱反射率最小的是红花木莲,为0.0269,最大值枇杷为0.0568;在690 nm—750 nm波长,植物反射率增长较快,形成陡坡,在760 nm附近出现反射率峰值,760 nm—1000 nm波长间光谱反射率处于较高水平。
NDVI值由大到小依次为:红花木莲、香樟、广玉兰、乐昌含笑、滇润楠、球花石楠、常春藤、八角金盘、枇杷、洒金叶珊瑚;叶绿素归一化指数(chlNDI)和红边位置(λre)与植物叶绿素含量具有正相关关系,chlNDI值由大到小依次为:枇杷、红花木莲、球花石楠、洒金叶珊瑚、香樟、常春藤、八角金盘、广玉兰、乐昌含笑、滇润楠;红边位置相差不大,总体在715 nm—724 nm之间;PSRI、WBI、PRI值整体上相差不大(表4)。

表3 叶绿素荧光参数Tab.3 Chlorophyll fluorescence parameters

图3 植物光谱反射曲线Fig.3 Spectral reflectance curve of plants
3.5 光谱特性与光合特性的关系分析
对植被指数和光合参数进行相关性分析,得到Pearson 相关系数(表 5)。其中,NDVI、λre、PRI与Pn、Gs、Tr存在较显著的相关关系,并且NDVI与Pn的相关性最高,达到了0.941,λre与Gs的相关性最低,相关性为0.666;chlNDI与Pn、Gs、Tr之间存在较低的相关关系;PSRI与Gs、Ci间存在较低的相关性,分别为0.592和0.514;WBI与光合参数之间表现出极低的相关性,最低的仅为0.295;植被指数与Ci之间均表现出较低或极低的相关性。由于不同植被间光合生理状况存在差异,以及植被指数与光合参数较显著的相关性,可以通过光谱特征实现对植物生长状况的远距离监测。
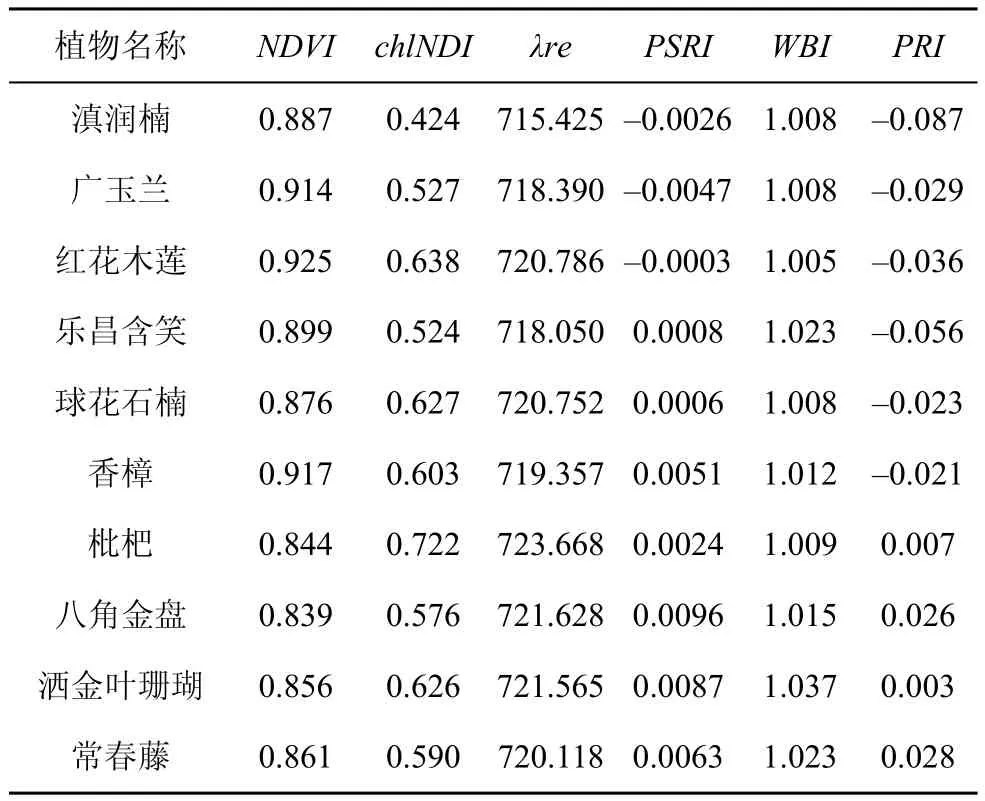
表4 植物光谱指数Tab.4 Spectral index of plants
4 结论与讨论
利用GFS-3000便携式光合-荧光测量系统和SVC便携式地物光谱仪对10种园林植物的光合及光谱特性进行了测量,通过分析可以得出:
(1)影响植物光合作用能力的因素较为复杂,植物种类、生长阶段、叶片年龄、健康状况等内部因素与光、CO2、水、温度等环境条件都会对植物光合产生影响[3–4,8,28]。10种植物Pn值整体上乔木高于藤本植物,藤本植物略高于灌木,史红文等[12]指出植物固碳释氧能力与光合速率之间为正相关关系,因此本文所得结果与刘雪莲等[14]对冬季昆明园林植物固碳释氧能力乔木>藤本植物>灌木的研究结果一致,但Pn日变化趋势存在差异,两者在地域背景与时间上相似,结果出现不同可能是因为本研究的洒金叶珊瑚和八角金盘生存环境不同,均生长在受光照不充足的建筑物下。该结果与陈月华等[13]人对长沙园林植物固碳释氧能力研究认为灌木>乔木的结论不同,可能是由于植物生长环境、研究对象种类与数量选取以及测量时间不同;但乔木冠幅及叶面积指数均较大,在固碳释氧能力方面应更占优势[12]。Pn、GS和Tr呈现单峰或双峰的变化,而Ci值则呈现早晚较高,中午较低的变化趋势,Pn、GS、Tr和Ci值日变化趋势与尤扬等[31]、邵玺文等[32]对含笑、黄芪光合特性的研究结果相似;Pn、GS、Tr和Ci之间变化的密切联系与安锋等[33]学者对8种木本植物生理生态研究结果一致。

表5 植物光谱指数与光合特性的关系Tab.5 Relationship between spectralindex and photosynthetic characteristics of plants
(2)植物光补偿点与光饱和点都是反映植物耐阴性与适应不同光环境的指标[34],在10种植物中,两种灌木和常春藤均为阴生植物,其LCP较乔木低,说明其耐阴性较强,与黄成林等[35]对五种攀援植物对光强响应特点的研究结果相似;LSP的高低可说明植物利用高光强的能力强弱,10种植物中广玉兰LSP值最大,利用强光能力最强,最弱的是常春藤。LCP较低与LSP较高认为是对弱光环境的响应与适应,枇杷相比其他乔木利用弱光的能力更强。AQE反映植物在弱光下的光合效率[26],对弱光的利用效率整体上灌木和藤本植物>乔木。
(3)叶绿素荧光是表征植物生理生态状态的重要指标,叶绿素荧光参数能反映植物生理的内在特点,Fv/Fm又称内禀光化学效率,植物光合速率大并不意味着光合效率高[34]。不同植物荧光参数存在较明显差异。枇杷、八角金盘、洒金叶珊瑚、常春藤Fv/Fm值相比其他乔木大,光能转化效率稍高,与其处于弱光的环境是相符的。qP和NPQ是能量耗散的两种不同形式,也是自身的一种保护机制,其值越大,植物抗逆性越强[30]。Choi等[4]、He 等[5]、Jamil[6]等和卢广超等[7]对不同胁迫条件下植物叶绿素荧光的变化进行了研究,实现对植物生长的监测。
(4)10种植物的光谱反射率曲线特征和规律明显,在550 nm—560 nm波段有明显的小反射峰,在670 nm—690 nm波长之间则出现明显的吸收谷,690 nm—750 nm植物光谱反射率曲线形成“陡坡”,760 nm处出现峰值,760 nm—1000 nm波长间光谱反射率处于较高水平,与Peñuelas[36]等研究的结果一致。反射率变化主要是由植物叶片在可见光波段对绿光的反射和对红蓝光的吸收作用明显以及叶片海绵组织在近红外波段的强烈反射造成的;不同植物光谱曲线存在差异,是叶片表面特性和内部结构以及生化成分浓度和分布差异的体现[36]。植物光谱指数与光合特性的相关性分析结果表明,NDVI、λre与Pn、Gs、Tr呈较显著相关,PSRI与Pn之间相关性较高,与Gs和Ci的相关性较低,与王娣等[37]对农作物和园林植物的研究和王明奎[38]对油松的研究结果相一致。chlNDI、WBI与Pn、Gs、Tr、Ci之间表现出较低相关性,与王明奎的研究结果不同[38];PRI与Pn、Gs、Tr呈较显著负相关关系,与Ci相关性较低,与方晓雨等[39]对3种乔木研究得出蒙古栎、紫椴PRI与Pn呈正相关关系,红松PRI与Pn无明显相关性的结论不同,表明不同植物生理特征存在差异,植物类型不同和植物叶片生理结构差异都会影响植物对光谱反射的敏感程度。
目前已有相关研究利用光谱特征监测植物生长状态,王迅等[9]通过提取特征波段建立光谱数据与钙、磷、钾、纤维和粗蛋白等营养成分的关系模型来分析高寒草地的营养状况;方晓雨等[39]通过分析不同树高光谱与光合特征的变化,建立光谱光谱指数PRI与光合作用之间的联系,探讨树高对乔木生理状态的影响;王娣等[37]通过选取最佳模型,建立基于光谱指数的Pn反演机制,并认为红边指数与光合速率的关系更加紧密。植物光合作用能力是反映植物生长状况和适应逆境胁迫的重要指标,而植物在生长过程中的微小变化可以通过植物光谱特征表现出来[36]。研究结果表明NDVI、λre、PSRI和PRI与Pn、Gs、Tr都有较显著的相关性,正相关表示光谱指数值越大,光合作用速率越大,生理活动活跃;负相关则表明该光谱指数值越大,光合速率越小,生理活动缓慢。通过构建光谱指数与光合参数之间的最优模型,可以估测植物光合作用的能力,监测植物生长、生理和健康状况。植物光谱指数与光合特性的密切联系,以及现代精密仪器设备技术的快速发展,使得人们能够进行越来越精细的研究,也使得在植物生理研究中采用光谱分析技术成为可能。因此利用植物反射光谱特征监测园林植物的生理特征是园林管理的一个可靠方法。
参考文献
[1]ARAGÓN-GASTÉLUM JL,FLORESJ,YÁÑEZESPINOSA L,et al.Induced climate change impairs photosynthetic performance inEchinocactus platyacanthus,an especially protected Mexican cactus species[J].Flora,2014,209:499–503.
[2]KOBAYAKAWA H,IMAI K.Relation between O3-inhibition of photosynthesis and salicylic acid in paddy rice grown with different CO2concentrations[J].Environmental Control in Biology,2013,51(3):139–147.
[3]UKABI S,DUBINSKY Z,STEINBERGER Y,et al.Temperature and irradiance effects on growth and photosynthesis ofCaulerpa(Chlorophyta)species from the eastern Mediterranean[J].Aquatic Botany,2013,104:106–110.
[4]CHOI D G,HWANG J S,CHOI S C,et al.The effect on photosynthesis and osmotic regulation inBeta vulgarisL.var.FlavescensDC.by salt stress[J].Journal of Ecology&Environment,2016,39(1):81–90.
[5]HE Y,CHEN Y,YU C L,et al.Photosynthesis and yield traits in different soybean lines in response to salt stress[J].Photosynthetica,2016,54(4):1–6.
[6]JAMIL M,RHA E S.NaCl stress-induced reduction in grwoth,photosynthesis and protein in Mustard[J].Journal of Agricultural Science,2013,5(9):114–127.
[7]卢广超,许建新,薛立,等.干旱胁迫下4种常用植物幼苗的光合和荧光特性综合评价[J].生态学报,2013,33(24):7872–7881.
[8]童庆禧,张兵,郑兰芬.高光谱遥感:原理、技术与应用[M].北京:高等教育出版社,2006,363–407.
[9]王迅,刘书杰,贾海峰,等.基于高光谱数据的高寒草地营养状况的研究[J].光谱学与光谱分析,2012,32(10):2780–2784.
[10]HORLER D N H,DOCKRAY M,Barber J.The red edge of plant leaf reflectance[J].International Journal of Remote Sensing,1983,4(2):273–288.
[11]NAUMANN J C,YOUNG D R,ANDERSON J E.Leaf chlorophyll fluorescence,reflectance,and physiological response to freshwater and saltwater flooding in the evergreen shrub,Myrica cerifera[J].Environmental&Experimental Botany,2008,63:402–409.
[12]史红文,秦泉,廖建雄,等.武汉市10种优势园林植物固碳释氧能力研究[J].中南林业科技大学学报,2011,31(9):87–90.
[13]陈月华,廖建华,覃事妮.长沙地区19种园林植物光合特性及固碳释氧测定[J].中南林业科技大学学报,2012,32(10):116–120..
[14]刘雪莲,何云玲,张淑洁,等.昆明市常见绿化植物冬季固碳释氧能力研究[J].生态环境学报,2016,25(8):1327–1335.
[15]金远亮,王平,王晶,等.新建高校校园绿地植物资源调查与评价—以云南师范大学启园为例[J].安徽农业科学,2011,39(11):6741–6744.
[16]姜汉侨.云南植被分布的特点及其地带规律性[J].植物分类与资源学报,1980,2(1):24–34.
[17]PENUELAS J,GAMON J A,GRIFFINK L,et al.Assessing community type,plantbiomass,pigment composition,and photosynthetic efficiency of aquatic vegetation from spectral reflectance[J].Remote Sensing of Environment,1993,46(4):110–118.
[18]GITELSON A,MERZLYAK M N.Spectral reflectance changes associated with autumn senescence ofAesculus hippocastanumL.andAcer platanoidesL.leaves spectral features and relation to chlorophyll estimation[J].Journal of Plant Physiology,1994,143:286–292.
[19]POULOS H M,GOODALE U M,Berlyn G P.Drought response of two Mexican oak species,Quercus laceyiandQ.sideroxyla(Fagaceae),in relation to elevational position.[J].American Journal of Botany,2007,94(5):809–818.
[20]GAMONJA,SERRANOL,SURFUSJS.The photochemical reflectance index:an optical indicator of photosynthetic radiation use efficiency across species,functional types,and nutrient levels[J].Oecologia,1997,112:492–501.
[21]MERZLYAK M N,GITELSONAA,CHIVKUNOVA O B,et al.Non-destructive optical detection of pigment changes during leaf senescence and fruit ripening[J].Physiologia Plantarum,1999,106:135–141.
[22]裴斌,张光灿,张淑勇,等.土壤干旱胁迫对沙棘叶片光合作用和抗氧化酶活性的影响[J].生态学报,2013,33(5):1386–1396.
[23]FARQUHAR G D,SHARKEY T D.Stomatal conductance and photosynthesis[J].Ann Rev Plant Physical,1982,33:317–345.
[24]许大全.光合作用气孔限制分析中的一些问题[J].植物生理学通讯,1997,33(4):241–244.
[25]CANNELL M G R,THORNLEY J H M.Temperature and CO2responses of leaf and canopy photosynthesis:a clarification using the non-rectangular hyperbola model ofphotosynthesis[J].AnnalsofBotany,1998,82:883–892.
[26]刘宇锋,萧浪涛,童建华,等.非直线双曲线模型在光合光响应曲线数据分析中的应用[J].中国农学通报,2005,21(8):76–79.
[27]叶子飘,于强.光合作用光响应模型的比较[J].植物生态学报,2008,32(6):1356–1361.
[28]李合生,孟庆伟,夏凯,等.现代植物生理学[M].北京:高等教育出版社,2002:85–181.
[29]张守仁.叶绿素荧光动力学参数的意义及讨论[J].植物学报,1999,16(4):444-448.
[30]高天鹏,郭睿,王东,等.保水剂与钾肥对旱地马铃薯产量和叶绿素荧光动力学参数的影响[J].生态学杂志,2013,32(5):1221–1226.
[31]尤扬,刘香坤,董文龙,等.含笑叶片春季光合日变化初步研究[J].西南农业学报,2011,24(3):915–918.
[32]邵玺文,韩梅,韩忠明,等.不同生境条件下黄芩光合日变化与环境因子的关系[J].生态学报,2009,29(3):1470–1477.
[33]安锋,蔡靖,姜在民,等.8种木本植物木质部栓塞变化与生理生态指标间关系的研究(Ⅱ)—与光合生理生态指标的关系[J].西北林学院学报,2006,21(1):37–42.
[34]王建华,任士福,史宝胜,等.遮荫对连翘光合特性和叶绿素荧光参数的影响[J].生态学报,2011,31(7):1811–1817.
[35]黄成林,傅松玲,梁淑云,等.五种攀缘植物光合作用与光因子关系的初步研究[J].应用生态学报,2004,15(7):1131–1134.
[36]PEÑUELAS J,FILELLA I.Visible and near-infrared reflectance techniques for diagnosing plant physiological status[J].Trends in Plant Science,1998,3(4):151–156.
[37]王娣,佃袁勇,乐源,等.基于高光谱植被指数的叶片净光合速率Pn反演[J].地理与地理信息科学,2016,32(4):42–48.
[38]王明奎.油松针叶光谱特征及光合生理间关系研究[J].山东林业科技,2015,45(5):28–32.
[39]方晓雨,张宏琴,姜超,等.3种乔木叶片反射光谱与光合特性随树高的变化[J].应用与环境生物学报,2013,19(2):383–388.

