青蒿有效成分的提取方法筛选
崔宇超, 朱庆贺, 王丽坤, 张莹, 骆宏伟, 高俊峰
(黑龙江省兽医科学研究所, 齐齐哈尔 161006)
青蒿素为青蒿的主要有效成分,具有抗疟、抗菌、解热、镇痛、免疫调节等多种功效[1],不仅能有效治疗疾病,还能够增强动物机体的抵抗力,增加其生产能力,从而达到标本兼治的效果。
传统的青蒿粗提取方法主要有浸渍法、渗漉法、煎煮法、回流法等。其中浸渍法和渗漉法溶剂需要量较大,提取时间较长,有效成分提取率不高。热回流法和煎煮法用时较长,且青蒿素具有特殊的过氧基团,热稳定性差,60 ℃以上即分解,甚至完全失去药效[2],故而青蒿素的提取不适合常规的热回流法和煎煮法。较为先进的青蒿素提取技术有超临界流体萃取法、酶解法和发酵法,但由于超临界流体萃取法的设备成本较高,酶解法提取产物与酶较难分离,而发酵法的微生物较难分离,容易造成二次污染等原因,这三种方法不适于临床上应用。
与上述提取方法相比,超声波法、微波辅助法和恒温加热搅拌法是较为快捷高效、简单易行的青蒿有效成分提取方法。三种方法对仪器设备的要求都不高、提取成本低、提取物无生物污染的危险,比较适合于临床上生产使用。因而,研究分别利用超声波法,微波辅助法和恒温加热搅拌法提取青蒿有效成分,应用高效液相色谱法检测三种提取方法对青蒿素的提取效果,评价出最为安全、方便、高效、省时的青蒿素提取方法。
1 材料与方法
1.1 药品与试剂 青蒿购自黑龙江省康复药材有限责任公司。其它试剂为分析纯,甲醇为色谱纯。青蒿素标准品(纯度≥99%),上海源叶生物科技有限公司。
1.2 仪器设备 分析天平,上海梅特勒-托利多有限公司;低速离心机,上海安亭科学仪器厂;恒温超声提取机,北京弘祥隆生物技术开发有限公司;微波炉,广东格兰仕集团有限公司;恒温磁力搅拌器,上海一恒科学仪器有限公司;旋转蒸发仪,上海亚荣生化仪器厂;液相色谱仪,岛津企业管理(中国)有限公司;纯水仪,北京湘顺源科技有限公司。
1.3 青蒿有效成分提取方法
1.3.1 超声波法 参照文献[3]的提取方法,称取3 g青蒿粉末,按照料液比1∶50加入无水乙醇,将料液放入恒温超声提取机中。设置温度为50 ℃,超声波强度为120 W,超声5 s,间歇5 s,超声时间30 min。以5000 r/min,离心10 min,离心后用0.45 μm滤膜过滤。
1.3.2 加热搅拌法 参照文献[4]的提取方法,称取3 g青蒿粉末,按照料液比1∶50加入无水乙醇,将料液利用恒温磁力搅拌器提取有效成分。设置温度50 ℃,搅拌速度800 r/min,提取时间3 h。以5000 r/min,离心10 min,离心后用0.45 μm滤膜过滤。
1.3.3 微波辅助法 参照文献[5]的提取方法,称取3 g青蒿粉末,按照料液比1∶50加入无水乙醇,置于微波炉中,容器口用保鲜膜盖住,在保鲜膜上扎出若干孔,设置高火档,单次微波作用时间为1 min,每次微波作用后,于冰水浴中边振荡边冷却,使药液温度低于20 ℃时,置于微波炉中再次作用,如此反复,直至微波总时间达到15 min。以5000 r/min,离心10 min,离心后用0.45 μm滤膜过滤。
1.4 HPLC测定青蒿素方法的建立
1.4.1 绘制标准曲线 参照文献[6]的操作,精密称取青蒿素标准品10.6 mg置于10 mL容量瓶中,并用无水乙醇溶解和定容,摇匀。分别精密吸取0.6、0.4、0.2、0.1和0.025 mL上述液体于10 mL容量瓶中,分别加入0.2%的氢氧化钠溶液4 mL,于50 ℃水浴中反应30 min,冷却至室温后,加入0.08 moL/L醋酸定容,所得液用0.22 μm滤膜过滤,超声15 min后用液相色谱仪测定青蒿素含量。色谱柱为ODS C18(4.6 mm×150 mm,5.0 μm),设置检测波长为260 nm,流速为1.0 mL/min,柱温为30 ℃,进样量为20 μL,以甲醇:磷酸盐缓冲液(50∶50)为流动相,对青蒿素进行测定,记录峰面积。以进样浓度为横坐标,峰面积为纵坐标,绘制标准曲线。
1.4.2 重复性试验 取同一浓度的青蒿素标准品溶液,分别进样5次,记录峰面积。
1.4.3 样品中青蒿素含量的测定 将青蒿提取物用旋转蒸发仪浓缩后,转移至10 mL容量瓶中,用无水乙醇定容,取1 mL上述液体置于另一个10 mL容量瓶中。加入0.2%的氢氧化钠溶液4 mL,于50 ℃水浴中反应30 min,冷却至室温后,加入0.08 moL/L醋酸定容,所得液用0.22 μm滤膜过滤,超声15 min,按照上述的测定方法记录峰面积。
1.4.4 稳定性试验 取同一批样品提取物溶液,分别在室温放置0、1、2、3、4 h后进样,记录峰面积。
1.4.5 回收率试验 精密称取已知青蒿素含量的提取液样品5份,加入一定量的青蒿素标准品溶液,进样,记录峰面积,计算样品中的青蒿素含量,并计算回收率。
2 结 果
2.1 青蒿素标准曲线 以260 nm为检测波长,测定浓度为2.65、10.6、21.2、42.4、63.6 μg/mL溶液的峰面积值,分别为38498、152580、312266、641495、928883。以峰面积为纵坐标,以进样浓度为横坐标得到标准曲线方程为y=14745x+565.55(R2=0.9993)。试验表明,在2.65-63.6 μg/mL浓度范围内,吸光度值与浓度呈良好的线性关系,见图1。浓度为12.72 μg/mL青蒿素标准品色谱图见图2。
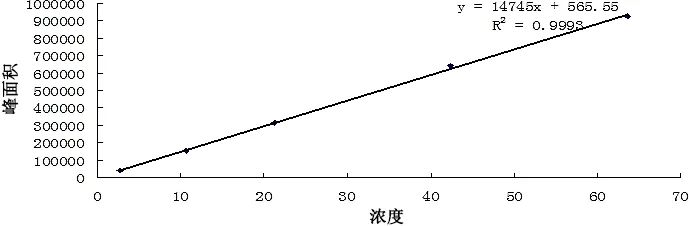
图1 青蒿素标准曲线Fig 1 Standard curve of artemisinin

图2 浓度为12.72 μg/mL青蒿素标准品色谱图Fig 2 Determination of standard artemisinin with the content of 12.72 μg/mL
2.2 重复性试验结果 由表1可知,同一浓度的青蒿素标准品平均峰面积为184348.4,RSD为0.0624%,该方法重复性良好。
2.3 稳定性试验结果 由表2结果显示RSD%为0.2831%,样品在4 h内具有良好的稳定性。
2.4 回收率试验结果 由表3可知,其平均回收率为99.968%,RSD为0.2320%,结果显示本方法具有较好的回收率。

表1 重复性试验结果Tab 1 Repeatability test results

表2 稳定性试验结果Tab 2 Stability test results

表3 回收率试验结果Tab 3 Recovery test results
2.5 不同方法提取样品中青蒿素的测定结果 由表4可知,超声波法提取青蒿素的含量最多,恒温加热搅拌法提取青蒿素的含量最少,经过SPSS的多组样本间差异显著性分析,结果表明,超声波法提取量与微波辅助法提取量差异显著(P<0.05),微波辅助法提取量与恒温加热搅拌法提取量差异显著(P<0.05)。样品中青蒿素含量为13.466 μg/mL的液相色谱图见图3。

表4 样品青蒿素含量测定Tab 4 Test of the content of artemisinin in samples (

图3 浓度为13.466 μg/mL青蒿素样品色谱图Fig 3 Determination of sample artemisinin with the content of 13.466 μg/mL
3 讨 论
适用于植物提取液中青蒿素定量分析的方法主要包括薄层扫描定量法、气相色谱法、红外光谱测定法、紫外分光光度法、高效液相色谱法。其中,薄层扫描定量法、紫外分光光度法和高效液相色谱法为较常用的青蒿素定量方法。薄层扫描法具有快速、方便、灵敏度高、准确度好、成本低等优点,但由于手动操作较多,人为影响因素较大,重现性不好。紫外分光光度法操作简单、快速、对仪器的要求不高,但不能排除青蒿素类似物的干扰,准确度不高。高效液相色谱法分离效率高,可排除青蒿素类似物的干扰、准确度高、检测灵敏度高、操作自动化、应用范围广[6]。鉴于此,试验采用高效液相色谱法测定提取物中青蒿素的含量以评价三种提取方法的提取效果。本研究对青蒿有效成分提取方法的筛选除了要考虑提取效率高及提取用时少等因素外,还需考虑到对操作人员和动物机体均安全、便于操作以及方便提取后直接应用于临床疾病的防治等因素。青蒿素易溶于氯仿、丙酮、乙酸乙酯和苯,可溶于乙醇、乙醚和石油醚,几乎不溶于水。其中,氯仿、丙酮、乙酸乙酯和苯,为危险品,对操作人员和动物机体危害较大。石油醚为提取青蒿素的常用试剂,提取率也较高,但是粗提物中残留的石油醚溶剂对动物皮肤黏膜具有强刺激性,因此不适合提取后直接给药。乙醇为提取中药有效成分的一种常用试剂,我国素有用酒浸泡中药以获取其有效成分的传统,用乙醇提取比用水提取用量少,且乙醇价格便宜,来源广泛,方便回收,可反复利用,提取液不易发霉变质,便于提取后直接给药,方便、快捷、安全。目前也有许多用乙醇提取青蒿有效成分的报道[7-8]。因此,试验将选用无水乙醇作为提取溶剂。
研究采用的三种方法为在前人的基础上,根据实际需求而稍加改善的青蒿素提取方法,三种方法均适合于临床应用。通过研究的测定,超声波法提取青蒿素的提取量显著优于微波辅助法和恒温加热搅拌法。超声波法用时30 min,微波辅助法总共用时45 min,恒温加热搅拌法用时3 h,在提取时间上超声波法也显示出优势。超声波法和恒温加热搅拌法均可控制温度,即可设定为50 ℃,不会超过青蒿素的热稳定临界,减少青蒿素的分解,微波辅助法在微波处理过程中温度极高,可能导致已提取的青蒿素分解。在实际操作中,微波辅助法提取溶剂挥发严重,操作间歇挥发的溶剂会对操作人员造成一定危害,超声波法也会发生提取溶剂的挥发,但挥发量不大,恒温加热搅拌法提取溶剂几乎不挥发,因而最为安全。在提取过程中,超声波法需要经常用玻璃棒搅动料液以保证料液的均匀,需要操作人员定时操作,微波辅助法在料液经微波处理后需要将其慢慢置于冰水浴中使其降温,也需要操作人员按时操作,而恒温加热搅拌法在整个提取过程中,不需要操作人员操作,最为简便。综合提取效率和实际操作,最终确定超声波法为青蒿素最佳提取方法。研究为青蒿素的提取研究提供科学的参考依据,也为青蒿提取物的现地、即时应用研究奠定基础。
参考文献:
[1] Woerdenbag H J, Pras N, Chan N G,etal. Artemisinin, related sesquiterpenes and essential oil in Artemisia annua during a vegetation period in Vietnam [J]. Planta Medica, 1994, 60(3): 272-275.
[2] 王新爱. 中草药对鸡柔嫩艾美尔球虫病防治效果的研究 [D]. 北京: 中国农业科学院, 2014.
Wang X A. Study of Chinese hebal medicine onEimeriacoccidiosis prevention effect [D]. Beijing: Chinese Academy of Agricultural Sciences, 2014.
[3] 何玉娟. 黄花篙植物中青篙素的提取分离过程研究 [D]. 天津: 天津大学, 2004.
He Y J. Extraction and separation of artemisinin from Artemisia annua L. [D]. Tianjin: Tianjin University, 2004.
[4] 张海惠. 黄花蒿中青蒿素的提取工艺优化、含量测定及细胞培养研究 [D]. 雅安: 四川农业大学, 2012.
Zhang H H. Artemisinin of extraction process optimization、content determination and cell culture from Artemisia annua L. [D]. Ya'an: Sichuan Agricultural University, 2012.
[5] 马雪松. 黄芪甲苷提取工艺的研究 [D]. 天津: 天津大学, 2006.
Ma X S. A study on extraction procession of astragalosid Ⅳ [D]. Tianjin: Tianjin University, 2006.
[6] 张馨莹. 黄花蒿中青蒿素的提取工艺及测定方法研究 [D]. 重庆: 西南大学, 2013.
Zhang X Y. Study on the extraction technology and determination methods of artemisinin from Artemisia annua L. [D]. Chongqing: Southwest University, 2013.
[7] 丁国和. 蒿属植物粗提物的提取工艺及其对奶山羊瘤胃发酵的影响 [D]. 呼和浩特: 内蒙古农业大学, 2009.
Ding G H. Studies on extracted technology of bioactive components from Artemisia annua L and effects of the components on nutrient fermentation [D]. Hohhot: Inner Mongolia Agricultural University, 2009.
[8] 郑志福 , 高平章, 林如鹏 , 等. 固相萃取-紫外分光光度法快速测定黄花蒿中青蒿素含量 [J]. 药物分析杂志, 2015, 35(2): 255-260.
Zheng Z F, GAO P Z, LIN R P, et al. Rapid determination of artemisinin content in Artemisia annua L. by SPE-UV [J]. Chin J Pharm Anal, 2015, 35(2): 255-260.
——青蒿素

