氮源、碳源影响红色糖多胞菌发酵的研究
张 萍,师文飞,黄文福,牛 春
(宁夏泰瑞制药股份有限公司,银川 750100)
红霉素( Erythromycin, Er)是由红色糖多孢菌(Saccharopolysporaerythraea)合成的14元大环内酯类抗生素,又被称为robimycin 或e-mycin,包括ErA~ErF[1],其中ErA的抑菌活性最高。红霉素具有广谱抗菌作用,其抗菌谱与青霉素相似[2],对革兰阳性菌尤其敏感,对葡萄球菌、化脓性链球菌、绿色链球菌、肺炎链球菌、梭状芽孢杆菌、白喉杆菌等有较强的抑制作用,是治疗耐药性金黄色葡萄球菌和溶血性链球菌感染而引起疾病的首选药物,临床上可用于治疗对青霉素过敏的患者。近几年红霉素衍生物的兴起,大大刺激了母体红霉素的需求[3-4]。
我国红霉素发酵水平属低水平重复操作,与发达国家相比差距较大。目前国外发酵单位己达8000~12000 U/mL,而国内大多企业红霉素发酵水平却一直在4000~5000 U/mL[5]。红霉素发酵水平主要受工作菌种、培养基组成、发酵条件控制以及后期的分离提纯条件等多方面因素的影响,国内很多科技工作者从红霉素发酵相关参数和调控入手,希望提高红霉素发酵水平。对前期选育的一株高产红霉素红色糖多孢菌菌株培养基进行了响应面法优化,以使其更好的发挥菌株的生长特性,进一步提高发酵液中红霉素产量。
1 材料与方法
1.1 材料
1.1.1 供试菌株 红色糖多孢菌,由宁夏泰瑞制药股份有限公司技术研发中心菌种研究室选育、保藏的高产菌株EM15-15。
1.1.2 培养基及培养条件[6]种子培养基:含淀粉、糊精、蛋白胨、葡萄糖、黄豆饼粉、NaCl、(NH4)2SO4、MgSO4·7H2O、KH2PO4、CaCO3和油,pH7.00。250 mL摇瓶装种子培养基30 mL,28 ℃,200 r/min培养48~52 h。发酵培养基:含正丙醇、(NH4)2SO4、MgSO4·7H2O、CaCO3、淀粉、糊精、黄豆饼粉、棉籽饼粉、玉米浆、葡萄糖和油,pH7.00。250 mL摇瓶装发酵培养基30 mL,接种量10%,28 ℃,220 r/min培养7 d。
1.1.3 主要试剂及原料 玉米浆购自华北制药康欣股份有限公司;(NH4)2SO4、MgSO4·7H2O、KH2PO4、糊精、蛋白陈和葡萄糖等,均为分析纯;红霉素对照品,中国兽医药品监察所,批号:130307,含量:883 U/mg。
1.2 方法
1.2.1 发酵液化学效价检测方法 硫酸水解法[7],发酵液经离心后,根据确定好的倍数吸取一定量的滤液,用0.35%碳酸钾液稀释。然后,取稀释液20 mL于分液漏斗中,加入醋酸丁醋20 mL,振摇30 min,放置分层,弃去下层水液,于丁醋液中加入无水硫酸钠1g左右(可酌量多加使丁醋液澄清),振荡至透明。准确吸取其上层脱水液10 mL于另一干燥的分液漏斗中,精确加入盐酸(0.1 mol/L)10 mL,振荡30 min,放置分层,把下层盐酸水液放入试管中,从中吸取5 mL放入另一试管中,加入硫酸(8 mol/L) 5 mL,摇匀,放入50 ℃水浴中,保温30 min取出冷却,于483 nm测定吸光度值,以红霉素标准品绘制标准曲线,计算发酵液红霉素的化学效价。
1.2.2 Plackett-Burman实验设计 选取(NH4)2SO4、MgSO4·7H2O、KH2PO4、CaCO3、淀粉、糊精、黄豆饼粉、棉籽饼粉、玉米浆、葡萄糖和正丙醇11个因素,应用Minitab 15进行Plackett-Burman设计,从而筛选出影响红霉素效价的主要因素。
1.2.3 最陡爬坡实验(steepest ascent design) 根据Plackett-Burman实验结果中各显著影响因素效应的大小设定步长及变化方向,以快速逼近最佳响应区域。而其他因素的取值则根据各因素效应的正负和大小确定,正效应的因素均取较高值,负效应的因素均取较低值。
1.2.4 响应面法(response surface methodology) 依据Plackett-Burman实验和最陡爬坡实验确定的实验因素与水平,采用Box-Behnken实验设计发酵培养基进行4因素3水平的响应面分析实验。每个因素取三个水平,以(-1,0,1)编码,根据相应的实验表进行实验后,对实验数据进行方差分析及多元回归分析,方差分析及回归方程的显著性检验采用F检验,以P<0.05判定为显著。多元回归模型拟合度采用R-Sq表示,以R-Sq>0. 9判定为优;拟合度失拟(Lack of Fit)以P>0. 05判定为失拟不显著,说明回归模型与数据拟合较好。最后在一定的水平范围内求取各因素的最佳值。
2 结果与分析
2.1 红霉素发酵效价主要氮源、碳源影响因子的确定 在前期单因素试验的基础上选用N=20的Placket-Burman实验设计,对淀粉(A)、糊精(B)、玉米浆(C)、棉籽饼粉(D)、黄豆饼粉(E)、葡萄糖(F)、(NH4)2SO4(G)、MgSO4·7H2O(H)、CaCO3(J)、油(K)和正丙醇(L)11个因素进行了考察,每个因素取高(+)、低(-)两水平,高水平约为低水平的1.25倍,响应值为红霉素的效价(Y),试验设计及结果见表1,因素水平取值、效应及显著性分析见表2。

表1 N=20的Plackett-Burman试验设计及结果Tab 1 N = 20 Plackett-Burman experimental design and results
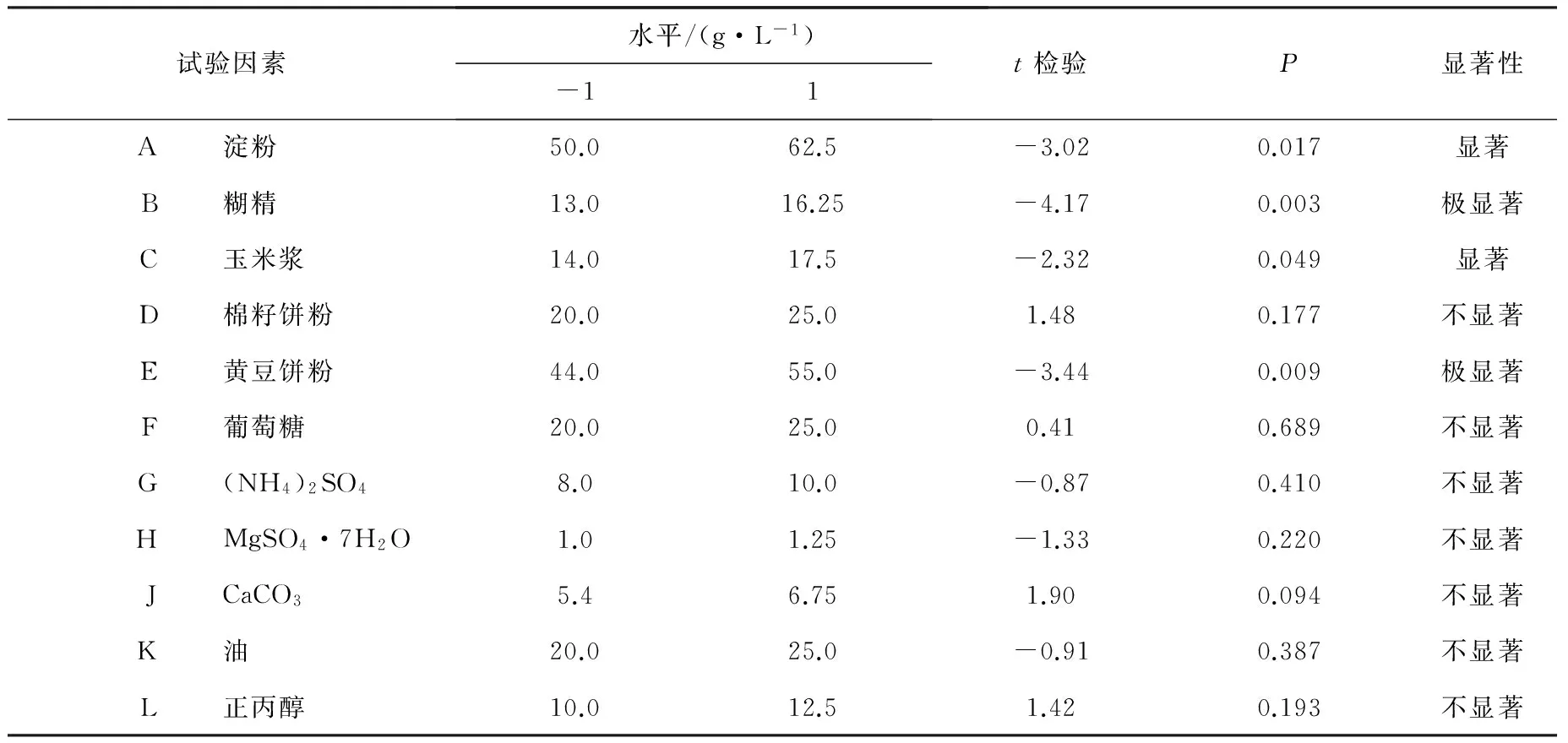
表2 Plackett-Burman试验因素水平及其主效应分析Tab 2 Plackett-Burman test factor level and its main effect analysis
由表2可知淀粉、糊精、黄豆饼粉、玉米浆发酵液中红霉素的效价有显著性影响,其中糊精和黄豆饼粉影响极显著。选出具有显著性影响的4个因素做最陡爬坡试验,这4个因素都有显著负效应,因此在以后的实验中应减少加量。
2.2 最陡爬坡实验 接近最大响应面区域,响应面拟合方程只在考察的紧接邻域里才充分近似真实情形,要先逼近最佳值区域后才能建立有效的响应面拟合方程。根据Plackett-Burman实验结果,确定不显著因素的水平,表现为正效应的因素取高水平,表现为负效应的因素取低水平。显著因素的变化步长及方向的实验设计及结果表明(表3),第3组效价最高,因此以第3组的水平作为响应面实验的中心点。

表3 最陡爬坡试验设计及结果Tab 3 The steepest slope test design and results
2.3 Box-Behnken设计及分析结果 根据Plackett-Burman实验和最陡爬坡实验得出淀粉52.0 g/L,糊精14.0 g/L,黄豆饼粉48.0 g/L,玉米浆15.0 g/L作为中心点,以红霉素效价为响应值(Y),利用Minitab 15响应面分析中的Box-Behnken设计,设计4因素3水平的实验,各因素水平见表4,Box-Behnken实验设计及结果见表5。通过对数据进行二次多元回归拟合,得到二次多项式方程:
Y=-306806+5167.81A+6777.17B-352.250E+19088.6C-44.3984A2-310.375B2-16.1719E2-495.250C2+52.6250AB+21.5000AE-152.625AC-23.6250BE+17.0000BC+69.9375CE
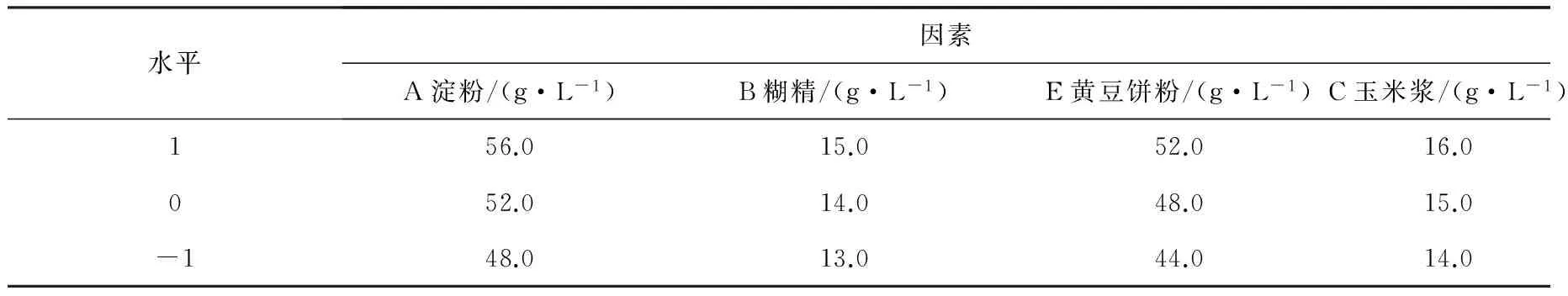
表4 因素水平编码表Tab 4 Factor level coding table
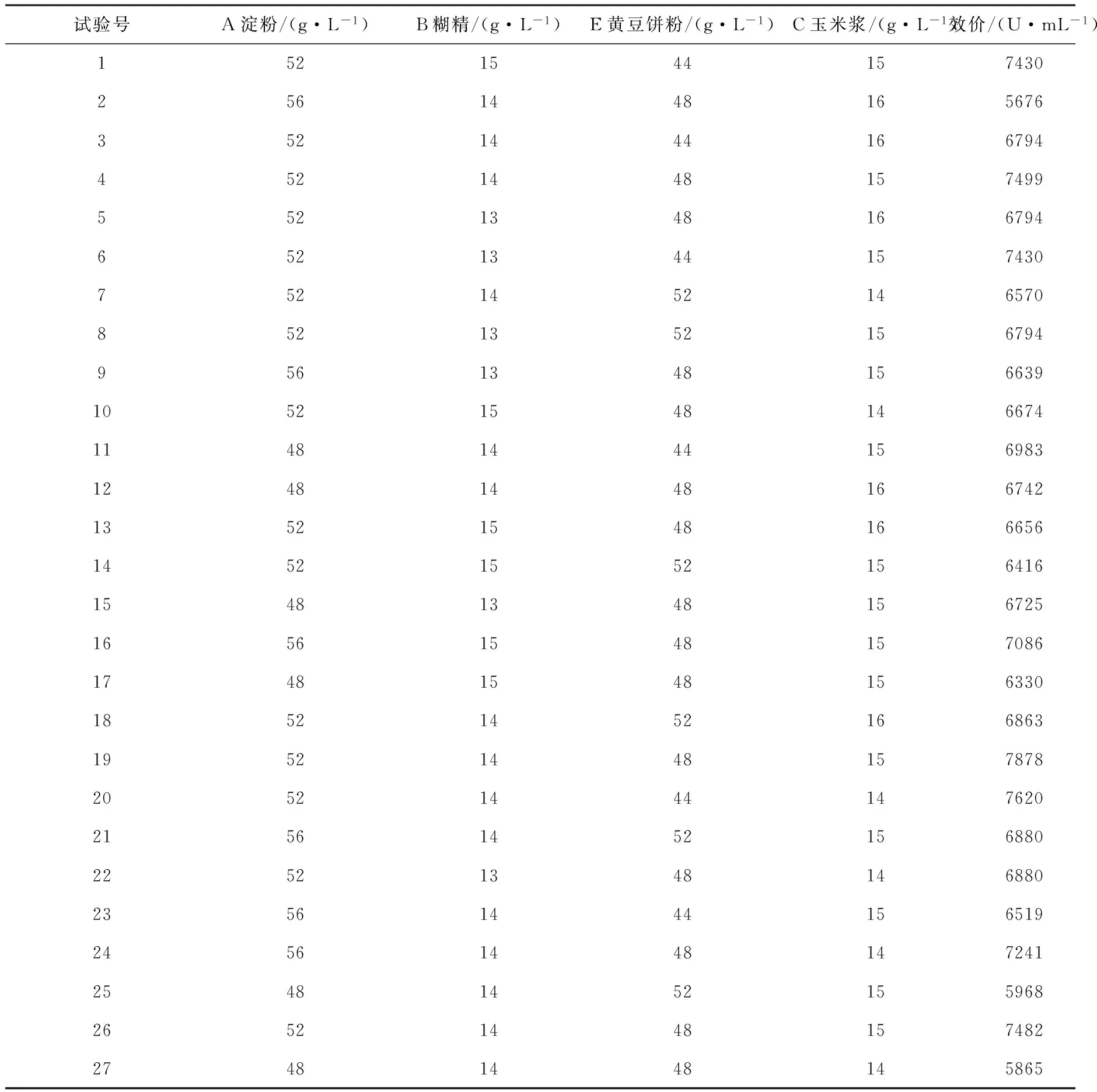
表5 Box-Behnken试验设计及结果Tab 5 Box-Behnken experimental design and results
通过Minitab 15软件对试验数据和模型进行分析,采用置信度为95% ,结果见表6。可以看出,该二次回归模型极为显著(P=0.000),失拟项不显著(P=0.1731),说明模型与试验拟合良好,可以用于红霉素效价的分析和预测。方程的决定系数R-Sq=94.04%,说明模型可以解释94.04%试验所得发酵效价的变化,进一步说明该模型拟合程度良好。
依据回归方程,利用Minitab 15软件绘出响应曲面图和等高线图,结果见图1和图2。
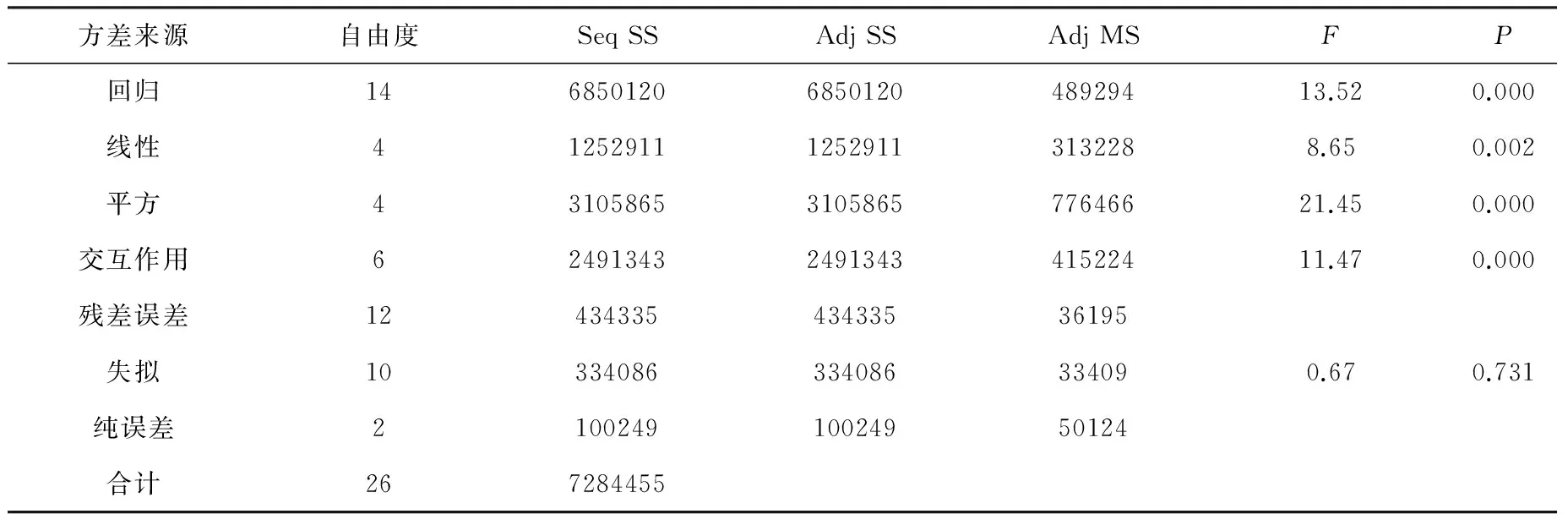
表6 二次多项式的方差分析Tab 6 Variance analysis of quadratic polynomials

图1 淀粉、糊精、黄豆饼粉和玉米浆对红霉素效价交互影响的曲面图Fig 1 Curve of interaction of starch, dextrin, soybean meal and corn steep liquor on erythromycin titers

图2 淀粉、糊精、黄豆饼粉和玉米浆对红霉素效价交互影响的等高线图Fig 2 Contours of starch, dextrin, soybean meal and corn steep liquor on erythromycin titer interaction
等高线的形状可以反映因素间交互作用的强弱大小,圆形表示交互作用不显著,椭圆形表示交互作用显著[8]。淀粉-糊精的交互作用、淀粉-黄豆饼粉的交互作用、淀粉-玉米浆的交互作用以及黄豆饼粉-玉米浆的交互作用的等高线均呈椭圆形,表明淀粉-糊精、淀粉-黄豆饼粉、淀粉-玉米浆以及黄豆饼粉-玉米浆的交互作用均对红霉素的效价有显著性影响。利用Minitab 15软件中的响应优化器对试验模型进行分析,得到淀粉含量为52.3 g/L、糊精含量为14.0 g/L、黄豆饼粉含量为45.3 g/L和玉米浆含量为14.6 g/L时,红霉素效价(Y)预测最大值为7734 U/mL。
2.4 响应面优化结果的验证 根据最优化结果配制发酵培养基,分批次(3次)发酵,红霉素发酵效价分别为7821、7709和7762 U/mL,均值7764 U/mL,与预测值7734 U/mL十分接近。同时,与原发酵培养基比较,红霉素效价提高了12%。
3 讨论与结论
在红霉素的发酵生产中常采用的菌种为红色糖多胞菌S.erythraea。1952年从具有不同抗生素活性的菌种中分离出S.erythraeaNRRL2338。起初该菌种的红霉素产最仅为0.25~1.0 g/L。但在2005年有报道其产量已经达到10~13 g/L[9]。在红霉素产量提升的过程中,菌种选育和发酵工艺优化起着重要角色。目前,传统的紫外诱变、氯化锂诱变、离子注入等方法仍被生产企业用来提高红霉素产量[10-11]。工业生产菌株多为经过多次诱变后的高产菌株,但“诱变疲劳”效应使传统诱变方法很难在提高产物产量方面再有较大突破。因此,代谢工程手段渐渐成为企业提高红霉素产量的突破口,红霉素发酵工艺优化已作为企业研究的重中之重。
红霉素发酵培养基的主要成份为淀粉和黄豆饼粉[12]。在红霉素工业生产中,降低原料成本是提高企业效益的有效手段,所以在国内出现了较多的采用廉价氮源替代昂贵氮源的报道。王晓磊等采用玉米粉水解物作为碳源在30吨发酵罐规模上使发酵单位提高了5.8%,综合成本降低了26.0%[13]。张金国等采用廉价A粉和B粉替代淀粉、葡萄糖和黄豆饼粉后在10吨罐规模下产量提高了6.11%[14]。Zou等在初始培养基中添加玉米浆促进了菌体的前期生长,最终红霉素效价提高了22.2%[15]。El-Enshasy等采用甘蔗糖蜜替代葡萄糖后结合补加正丙醇工艺使红霉素产量提高了33.0%[16]。
研究采用响应面法对红霉素发酵培养基中氮源和碳源进行了优化。首先,用Plackett-Burman试验设计法选出了对红霉素效价有显著性影响的4个因素,分别是淀粉、糊精、玉米浆和黄豆饼粉;然后用最陡爬坡试验逼近最佳响应面区域;最后通过Factors=4,Run=27的Box-Behnken设计进行优化,得出红霉素最佳发酵培养基配方:淀粉52.3 g/L、糊精14.0 g/L、黄豆饼粉45.3 g/L、玉米浆14.6 g/L、(NH4)2SO48.0 g/L、MgSO4·7H2O 1.0 g/L、CaCO35.4 g/L、棉籽饼粉 20.0 g/L、葡萄糖 20.0 g/L、正丙醇 10.0 mL/L、油 20 mL/L,与华承伟等[6]做的优化结果基本一致。优化后的配方经过发酵之后测得红霉素效价为7764 U/mL,比原配方提高了12%。
参考文献:
[1] Stassi D, Donadio S, Staver M J,etal. Identification of aSaccharopolysporaerythraeagene required for the final hydroxylation step in erythromycin biosynthesis [J]. Bacteriol, 1993, 175(1): 182-189.
[2] 陈 强, 朱才娟. 大环内酯类抗生素的临床评价[J]. 中国药房, 1995, 6(1): 32-34.
Chen Q, Zhu C J. The clinical evaluation of large cyclic lactone antibiotics[J]. Chinese Pharmacy, 1995, 6(1): 32-34.
[3] 施敏敏. 红霉素发酵过程的控制技术[J]. 工业控制与应用, 2009, 28(7): 18-22.
Shi M M. The control erythromycin Fed-Batch fermentation process[J]. Ndustrial Control and Applications, 2009, 28(7): 18-22.
[4] 李 啸, 陈长华, 李友元. 红霉素A发酵条件的优化[J]. 中国医药工业杂志, 2006, 37(6): 381-383.
Li X, Chen C H, Li Y Y. Erythromycin A optimization of fermentation conditions[J]. Chinese Journal of Pharmaceuticals, 2006, 37(6): 381-383.
[5] 刘 峰, 陈浦云, 陈祥明. 红霉素高产突变株F1-57的选育及发酵工艺研究[J]. 福建师范大学学报(自然科学版), 2003, 19(2): 61-64.
Liu F, Chen P Y, Chen X M. Screening and culturing of erythromycin productive strain F1-57 and its fermentation[J]. Journal of Fujian Normal University (Natural Science Edition), 2003, 19(2): 61-64.
[6] 华承伟,于江傲,谢凤珍. 红色链霉菌发酵产红霉素培养基的响应面优化[J]. 中国生物制品学杂志, 2011, 24(6): 728-736.
Hua C W, Yu J A, Xie F Z. Optimization of fermentation medium for erythromycin production of Streptomyces erythreus by response surface methodology[J]. Chinese Journal of Biologicals, 2011, 24(6): 728-736.
[7] 范代娣, 党 政, 孙晓红, 等. 红霉素摇瓶发酵实验工艺条件[J]. 西北大学学报(自然科学版), 2000, 30(1): 43-44.
Fan D D, Dang Z, Sun X H,etal. The experimental study on technical and engineering parameters during shake flask fermentation for erythromycin production[J]. Journal of Northwest A & F University (Natural Science Edition), 2000, 30(1): 43-44.
[8] Thompson D D. Response surface experimentation[J]. Food Processing Preservation, 1982, 6(3): 155-188.
[9] Minas W. Production of erythrornycin withSaccharopolysporaerythaea, in: Bartedo, J. L. (Eds.)[M]. Microbial Process and Products. Hnmana Process Inc., Totowa, NJ, 2005: 65-90.
[10] 孟祥学, 工凤山. 糖多孢红霉菌红霉素高产菌种的诱变选育[J]. 食品与药品, 2009, 11(4): 35-36.
Meng X X, Gong F S. Breeding of erythromycin high-yieldingSaccharopolysporaerythraeastrain[J]. Food and Drug, 2009, 11(4): 35-36.
[11] 虞 龙, 张 宇, 龚文静, 等. 氯化锂一紫外一离子束复合诱变红霉素高出菌株研究[J]. 原子能科学技术, 2011, 45(7): 780-784.
Yu L, Zhang Y, Gong W J,etal. Screening of erythromycin high-yielding strain by compound mutation of LiCl, UV and ion beam[J]. Atomic Energy Science and Technology,2011,45(7):780-784.
[12] 邹美云, 朱卫民, 于学琴. 红霉素链霉菌1-25菌株的特性研究[J]. 中国抗生素杂志, 1989, 14(3): 187-191.
Zou M Y, Zhu W M, Yu X Q. Cultural characteridtic studies and selection of high erythromycin producing mutant ofStreptomyceserythreus1-25[J]. Chinese Journal of Antibiotics, 1989, 14(3): 187-191.
[13] 王晓磊, 刘建周, 廖志忠, 等. 玉米粉水解物作为红霉素发酵培养基的研究[J]. 中国医药工业杂志, 2003, 34(4): 167-169.
Wang X L, Liu J Z, Liao Z Z,etal. Maize meal hydrolysate as culture medium for erythromycin fermentation[J]. Chinese Journal of Pharmaceuticals, 2003, 34(4): 167-169.
[14] 张金国, 刘 翔. 红霉素发酵培养基优化研究[J]. 中国抗生素杂志, 2006, 31(7): 406-416.
Zhang J G, Liu X. A Research on the improvement of medium composition for erythromycin fermentation[J]. Chinese Journal of Antibiotics, 2006, 31(7): 406-416.
[15] Zou X, Hang H F, Chu J,etal. Oxygen uptake rate optirnization with nitrogen regulation for erythromycin production and scale-up from 50 L to 372 m3scale[J]. Bioresource Technology, 2009, 100(13): 1406-1412.
[16] EI-Enshasy H A, Mohamed N A, Farid M A,etal. Improvement of erythromycin production bySaccharopolysporaerythraeain molasses based medium through cultivator medium optimization[J]. Bioresource Technology, 2008, 99(10): 4263-4268.

