显微观察结合目标识别技术观测马铃薯淀粉的糊化特性
原波,陶金轩,刘宏生
(1.广东工贸职业技术学院机械工程系,广东广州 510510)(2.华南理工大学食品科学与工程学院,广东广州 510640)
淀粉是葡萄糖分子的聚合物,以颗粒的形式存在于大多数高等植物的根、茎、叶、果实和花粉等器官中,是人体能量的主要来源,同时也广泛应用于食品,造纸、纺织和医药等工业[1]。当在过量水中加热时,淀粉颗粒吸水膨胀,晶体结构逐渐被破坏,这种行为称为糊化[2]。在大多数工业生产涉及增稠剂和胶黏剂的每一个环节中,淀粉的糊化特性严重影响着产品的品质。
利用淀粉糊化过程中理化特性的变化来研究糊化特性是国内外的研究重心。差示扫描量热法(DSC)是研究淀粉热特性的重要方法,可通过在线监控转变温度和能量变化等参数变化,演绎淀粉分子结构转变及行为变化[3~5]。但是该方法对体系中的水分和样品量有严格要求,同时样品的制备、盘的种类和实验参数等严重影响焓值及转变温度的测定[6,7]。偏光显微镜结合热台对淀粉的糊化特性进行在线研究是一种简便而又直观的方法。淀粉开始糊化后,双折射这一淀粉球晶结构的重要特征逐渐消失[8,9]。Spies等首次使用热台偏光显微镜观察淀粉的糊化行为,并定义50%淀粉颗粒失去双折射特征的温度为糊化温度[10]。Bryant等把第一个淀粉颗粒失去双折射特征的温度作为起始糊化温度,95%的颗粒失去双折射特征的温度作为终止糊化温度[11]。另有研究者把2%和98%的颗粒失去双折射特征的温度分别作为淀粉的起始糊化温度和终止糊化温度[12]。传统方法对淀粉糊化温度的确定没有统一标准,并且主要利用人工计数的方式来观测淀粉双折射特征变化,不仅耗费了大量的时间,也存在主观判定误差。
近年来,深度学习作为一种整个过程无需人工参与也能提取到好的特征的非监督学习方式,成为了计算机领域的研究热点,有广阔的研究空间,并且已经应用于生物科学[13]、医学[14,15]等领域,但其在食品领域,特别是对淀粉的研究鲜见报道。Liu等提出的深度学习算法模型SSD基于前馈卷积网络[16],它是一种使用单个深层神经网络检测图像中对象的方法,其核心是使用小卷积滤波器来预测特征图上固定的一组默认边界框的类别分数和位置偏移,准确度高。本实验将热台偏光显微镜与深度学习图像识别技术结合,提供了一种快速精确地捕捉马铃薯淀粉的双折射特征变化的检测方法Starch-SSD,进而研究其糊化特性,并与人工观测结果进行了比较,以期为淀粉的改性和深加工中在线控制提供理论参考。
1 材料与方法
1.1 原料与设备
原料:马铃薯淀粉,澳大利亚Penford公司。
设备:偏光显微镜,日本Olympus公司(配有Micro Publisher 3.3 RTV型数码相机);THMSE600型热台,美国Linkam公司。
1.2 热台偏光显微观察
将热台设备和温度操作系统(Linkam Scientific Instruments公司THMS600)进行连接,提供加热系统,采用日本Olympus公司的光学显微镜(BHS-2型)观察淀粉颗粒形态变化。
常温观察:制备质量分数约1%的马铃薯淀粉乳,滴加一滴于载玻片上,盖上盖玻片,将样品放置于显微镜的载物台上,固定,使用50×10的放大倍数,在普通光和偏振光下,对淀粉颗粒的形态结构和双折射特征进行观察和拍摄。
热台升温:制备质量分数在约为 1%的淀粉乳,滴加一滴在圆形载玻片上,盖上盖玻片并使用玻璃胶密封,样品片放在热台上,将热台放置在连接数码相机的偏光显微镜载物台下,使用50×10的放大倍数,选择适当的曝光时间,以30 ℃为升温起点,加热速率2 ℃/min,每隔30 s用相机记录拍摄淀粉于普通光和偏振光下的显微图片,在线记录并贮存热台升温过程中淀粉颗粒形态及双折射特征的变化情况,至视野中颗粒双折射特征完全消失停止加热。
1.3 Starch-SSD方法的构建与评估
相比自然图像,淀粉的形态结构更加单一,因此本实验提出了淀粉糊化特性的检测方法Starch-SSD,可以高效、快速地检测和研究糊化过程中双折射特征的变化并进行分析。该方法主要包括数据采集、目标识别和模型评估。
1.3.1 数据采集

图1 Starch-SSD方法结构示意图Fig.1 Structure of starch-SSD
淀粉糊化进程的偏振光下的显微图片进行前处理,设置所有图片的像素值为768*1024,偏光显微图像将通过多个卷积层(实线层)和池化层(虚线层)进而来获得特征映射。
将马铃薯淀粉偏振光显微图片分为训练样本和测试样本,使用Matlab软件对训练样本中偏光显微图片的双折射特征使用正方形的框进行标注,并将其设置为正样本,图片上其余部分设置为负样本。利用人工神经网络对训练样本进行深度学习并构建马铃薯淀粉双折射特征数据库,随后对测试样本马铃薯淀粉糊化进程的偏光显微图片进行目标识别并对检测结果进行分析。
Starch-SSD方法的结构示意图如图1所示,对于每一个特征映射,使用3×3×k卷积核进行卷积操作,产生类别的分数或相对于双折射特征默认框的位置偏移。由此,在非极大值抑制步骤后,每个应用卷积核运算的m×n大小位置处,将会产生一个输出结果。
1.3.2 目标识别
对马铃薯淀粉双折射特征的检测方法Starch-SSD的目标损失函数为:
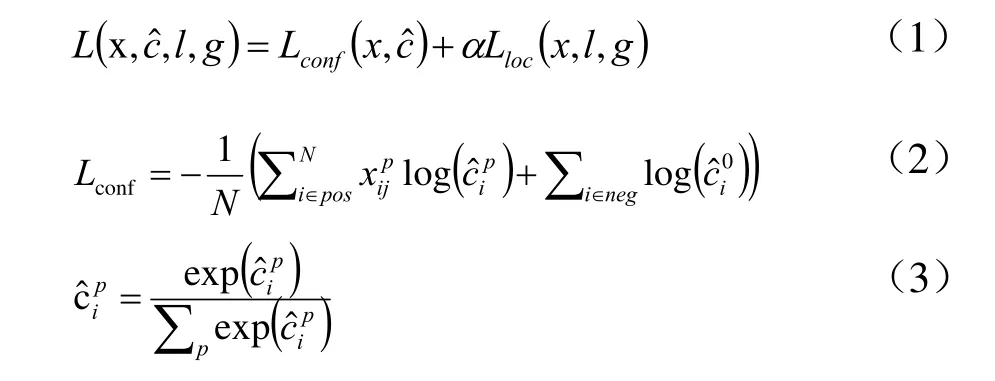
总体的目标损失函数为置信损失Lconf与位置损失Lloc的加权求和;
若第i个默认框不包含任何类别,即没有检测到淀粉双折射特征,则 i∈neg,表示为负样本;否则,i∈pos,表示为正样本;
Starch-SSD的定位:对标注的淀粉双折射特征框的中心c=(cx,cy)、宽度w以及高度h进行回归,权重α为1:

1.3.3 糊化特性评价
为了比较这种方法与人类视觉系统的速度和准确性,分别采用传统视觉观察法和Starch-SSD方法,根据升温过程中双折射特征数量变化,精确记录每张图像中呈现双折射特征淀粉的数量和对应的时间消耗,从而确定淀粉的糊化温度。要求5名实验人员对同一组马铃薯淀粉糊化进程的偏光显微图片进行检测。
糊化度的确定:

DG:马铃薯淀粉的糊化度;A0:淀粉原始未升温时偏光显微照片中呈现双折射现象的颗粒个数;Ai:热台的程序升温至特定温度i ℃时,淀粉偏光显微照片中呈现双折射现象的颗粒个数。
糊化温度的确定:马铃薯淀粉起始糊化温度T0、终止糊化温度Te通过如下关系式确定:
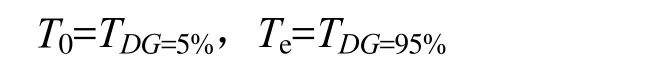
其中TDG=5%表示DG%=5%时的温度,TDG=95%表示DG%=95%时的温度。
1.3.4 数据统计分析
本文中所有实验均平行三次,所有数据都用平均值(mean)±标准差(SD)表示。数据图由Origin 8.0软件完成。
2 结果与讨论
2.1 光学显微观察结果
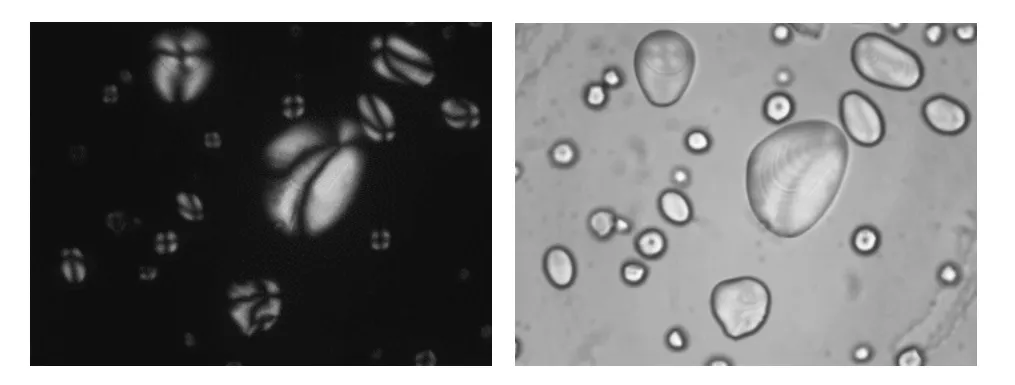
图2 马铃薯淀粉光学显微观察(室温)Fig.2 Micrographs of photo starches at room temperature under normal light (left)and polarizedlight(right)
图2为马铃薯淀粉分别在普通光和偏振光下的显微图像,淀粉以颗粒的状态存在,形状为椭圆形,颗粒尺寸差异较大,在显微镜的普通光下观察是透明的,可看到明显的生长环(轮纹),生长环的存在可能是由于淀粉在合成过程中所需的葡萄糖原料的昼夜不同导致各层密度不同。此外,偏振光下可以观察到淀粉颗粒明显的黑色亮斑,即脐点,且脐点偏向颗粒的一端。
图3为马铃薯淀粉在加热过程中,在普通光和偏振光下分别选取采集的显微图片,可以看出,在30 ℃下,马铃薯淀粉颗粒保留原有完整的形貌和双折射特征。随着温度的升高,淀粉颗粒膨胀,尺寸增大,温度不超过60 ℃时,视野中颗粒形态和双折射特征变化不大。当温度大于60 ℃时,颗粒结构逐渐被破坏,开始失去双折射特征。当温度到达70 ℃时,淀粉颗粒完全被破坏,双折射特征也完全消失,这标志着糊化过程的结束。

图3 显微镜下马铃薯淀粉糊化过程中不同温度的显微照片Fig.3 Micrographs of potato starch at different temperatures during the process of gelatinization
2.2 马铃薯淀粉糊化特性检测结果
表1为使用人工观察方法和Starch-SSD分别对马铃薯糊化特性的检测结果。结果表明,使用人工观测存在明显的主观误差,对于实验结果特别是糊化温度的判断有影响。
此外,利用人工视觉观察的方法对马铃薯淀粉糊化进程中,从第一张偏光显微图片到最后一张进行检测最少耗时约43 s,最长耗时约66 s。相比之下,使用Starch-SSD方法利用计算机对淀粉糊化进程中双折射特征数量变化进行检测不存在主观判断误差,整体检测时间控制在4 s以内,耗时显著短于人工观测。随着实验数据样本数量和种类不断扩充,利用人工智能检测可实现更高水平的精度和识别效率。
图4为使用Starch-SSD检测方法得到马铃薯淀粉双折射特征数目和对应温度点的糊化度随温度升高的变化情况,Starch-SSD提供了一种更加准确快速地对淀粉糊化特性进行研究的新方法。
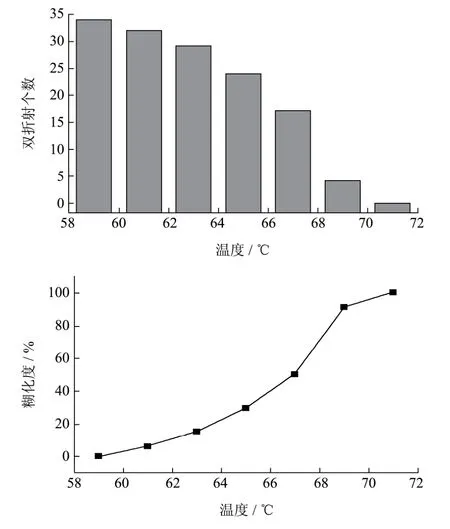
图4 马铃薯淀粉加热过程中特殊温度下呈现双折射特征的数目及对应糊化度Fig.4 The number of birefringence characteristics and the corresponding degree of gelatinization at a special temperature during the heating
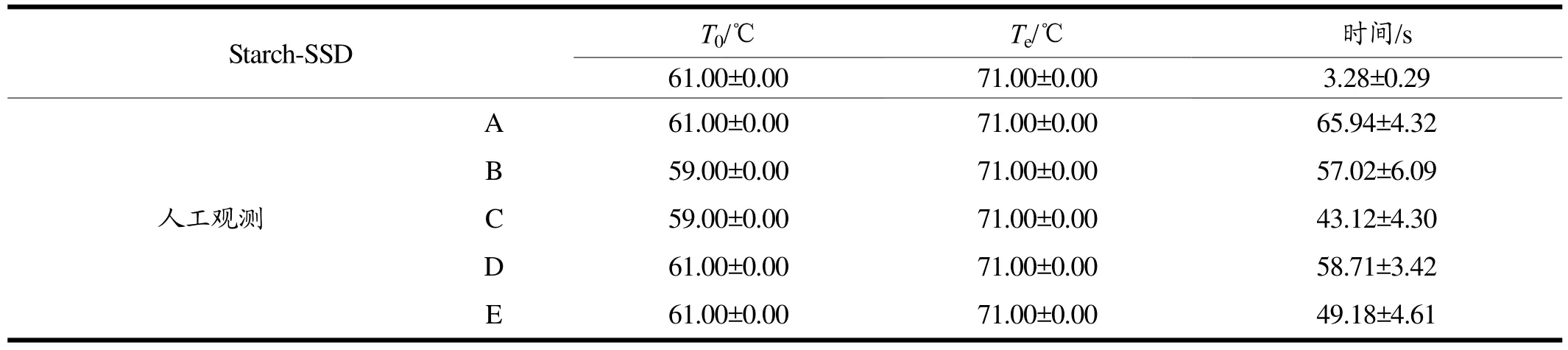
表1 Starch-SSD和人工方法分别检测马铃薯淀粉糊化温度的结果和对应的时间消耗Table 1 Result of gelatinization temperature and the corresponding time consumption starches by Starch-SSD and manual method
3 结论
3.1 显微观察表明,马铃薯淀粉以颗粒的形式存在,在偏振光下有独特的双折射特征,当使用热台对淀粉乳进行加热,颗粒吸水膨胀,温度达到 61 ℃时,双折射特征开始逐渐消失,在 71 ℃时,呈现双折射特征的淀粉完全消失,淀粉完成糊化,双折射可以作为研究淀粉糊化特性的重要指标。
3.2 Starch-SSD方法可对淀粉糊化进程中双折射特征的变化进行检测分析,相对于传统的人工视觉观察法,克服了主观判定误差,整体检测耗时间在4 s以内,为今后淀粉产品或者改性淀粉的生产提供了一种更加快速准确的在线监控体系。
[1]张燕萍.变性淀粉制造与应用[M].北京:北京化学工业出版社,2007
[2]Ai Yongfeng, Jay-lin Jane. Gelatinization and rheological properties of starch [J]. Starch-Stärke, 2015. 67(3-4): 213-224
[3]Shu-jun Wang, Xiu Zhang, Shuo Wang, et al. Changes of multi-scale structure during mimicked DSC heating reveal the nature of starch gelatinization [J]. Scientific Reports, 2016,6: 28271
[4]Stevens D J, Elton G A H, St Albans, et al. Thermal properties of the starch/water system part i. measurement of heat of gelatinisation by differential scanning calorimetry [J]. Starch-Stärke, 1971, 23(1): 8-11
[5]Hong-sheng Liu, Long Yu, Feng-wei Xie, et al. Gelatinization of cornstarch with different amylose/amylopectin content [J].Carbohydrate Polymers, 2006, 65(3): 357-363
[6]Long Yu, Christie G. Measurement of starch thermal transitions using differential scanning calorimetry [J].Carbohydrate Polymers, 2001, 46(2): 179-184
[7]Can-hui Cai, Jin-wen Cai, Ling-xiao Zhao, et al. In situ gelatinization of starch using hot stage microscopy [J]. Food Science and Biotechnology, 2014, 23(1): 15-22
[8]Molina M T, Leiva A, Bouchon P. Examining the effect of freezing on starch gelatinization during heating at high rates using online in situ hot-stage video-microscopy and differential scanning calorimetry [J]. Food and Bioproducts Processing, 2016, 100: 488-495
[9]Fa-deLi, Li-te Li, Zai-gui Li, et al. Determination of starch gelatinization temperature by ohmic heating [J]. Journal of Food Engineering, 2004, 62(62): 113-120
[10]Spies R D, Hoseney R C. Effect of sugars on starch gelatinization [J]. Cereal Chemistry, 1982, 59(2): 128-131
[11]Bryant C M, Hamaker B R. Effect of lime on gelatinization of corn flour and starch [J]. Cereal Chemistry, 1997, 74(2):171-175
[12]Chen Pei, Long Yu, Kealy T, et al. Phase transition of starch granules observed by microscope under shearless and shear conditions [J]. Carbohydrate Polymers, 2007, 68(3): 495-501
[13]Angermueller C, Parnamaa T, Parts L, et al. Deep learning for computational biology [J]. Molecular Systems Biology, 2016,12(7): 878
[14]Litjent, Geert, Kooi Thijs, Bejnordi Babak Ehteshami, et al. A survey on deep learning in medical image analysis [J].Medical Image Analysis, 2017, 42(Supplement C): 60-88
[15]Cruzroa A A, Arevalo Ovalle J E, Madabhushi A, et al. A deep learning architecture for image representation, visual interpretability and automated basal-cell carcinoma cancer detection [C]// Med Image Comput Comput Assist Interv.Springer-Verlag Berlin Heidelberg, 2013: 403-10
[16]Liu Wei, Anguelov Dragomir, Erhan Dumitru, et al. SSD:Single Shot MultiBox Detector [C]// European Conference on Computer Vision, Springer, 2016: 21-37

