胱抑素C与缺血性脑小血管病的相关性分析
,佡,
脑小血管病(cerebral small vessel disease,CSVD)是指由于各种原因导致脑内小血管病变后产生的一系列临床、影像、病理综合征,影像学上主要表现为新发小的皮质下梗死,可能为血管起源的腔隙(Lacune)、白质高信号(white matter hyperintensity,WMH)、血管周围间隙(perivascular space,PVS)、脑微出血等[1]。该病病因复杂,诊断主要依靠影像学。由于临床症状多变且隐匿,远期可出现认知功能下降或帕金森样症状,严重影响病人生活质量,缩短生存期,对其早期发现并积极干预尤为重要。目前脑小血管病公认的危险因素是年龄、高血压,但缺乏特异的血清学标志物,近期有研究发现血浆胱抑素C(Cystatin C,CysC)与CSVD相关,可为CSVD的筛查提供依据。
Lacune、WMH、PVS是三种常见的缺血性CSVD,作为CSVD的磁共振成像(MRI)标记物,三者可单独或同时存在,后两者可静止存在或演变为腔隙[2-3]。本研究分析CysC与Lacune、WMH、PVS的相关性。现报道如下。
1 资料与方法
1.2 诊断标准 ①WMH:指可能为血管起源的脑白质改变,主要分布在侧脑室旁,形状大小不等,在T2或FLAIR序列上呈高信号,T1呈等信号或低信号,信号不同于脑脊液,其内无空腔。②Lacune:指可能为血管起源的腔隙,主要分布于皮质下、基底节区,形态为圆形或卵圆形,直径为3 mm~15 mm,在FLAIR表现为中心脑脊液样低信号,周边绕以高信号环。也可以表现为FLAIR高信号,但在T1、T2等序列显示为脑脊液样信号。③PVS:是环绕在小血管周围、沿着血
管走行的脑外液体间隙,自脑表面穿入脑实质而形成。可穿过半球白质向心性走行,在基底节下部最为明显,可呈线型、圆形或卵圆形,直径通常小于3 mm。少数可显著扩大至10 mm~20 mm,可有占位效应。在所有序列上的信号与脑脊液相同[4-5]。
1.3 排除标准 ①有穿支动脉的父动脉和供血动脉粥样硬化性狭窄或闭塞(大、中动脉>30%的狭窄)证据的病人;②有心源性栓塞证据的病人;③有多发性硬化,血管炎,一氧化碳中毒及农药中毒性脱髓鞘,遗传性白质脑病,代谢性白质脑病,化疗,放疗相关性脑白质病证据的病人;④有动脉夹层、肌纤维营养不良、烟雾病等大血管病变证据的病人;⑤反复脑出血史以及恶性肿瘤病史;⑥急性起病者。
1.4 方法 所有入选对象经Philips Achieva3.0T MRI扫描,进行常规T1加权成像(T1 weighted imaging,T1WI)、T2加权成像(T2 weighted imaging,T2WI)、液体衰减反转恢复成像(fluid attenuated inversion recovery,FLAIR)、弥散加权成像(diffusion- weighted imaging,DWI)。根据头MRI表现,搜集拥有WMH、Lacune、PVS影像学特征的病例并分组,兼具两种以上改变者剔除。收集CSVD组及对照组一般资料,包括性别、年龄、吸烟史、饮酒史、高血压病史、糖尿病病史,测定入选对象空腹CysC、同型半胱氨酸(Hcy)、血尿酸(UA)、三酰甘油(TG)、总胆固醇(TC)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)。CysC 测定采用乳胶颗粒增强比浊法。
1.5 统计学处理 采用SPSS19.0软件对CSVD组及WMH、Lacune、PVS各亚组进行全因子二元Logistic分析,以P< 0.05为差异有统计学意义。
民国元年(1912年),袁世凯就任民国大总统,下帖请李瑞东赴京担任其拱卫军武术总教长一职。同年,李瑞东与盟兄弟李存义、张兆东等人创中华武士会,李瑞东发挥了他小孟尝的本色,出资不少,并在武士会成立后担任名誉总教习。
2 结 果
2.1 各组一般资料比较 CSVD组共纳入CSVD病例258例,年龄29岁~92岁(62.45岁±11.97岁);男86例,女172例;其中WMH 86例,Lacune 86例,PVS 86例。对照组76名,年龄30岁~72岁(53.38岁±10.35岁),男20名,女56名。各组一般资料详见表1。

表1 各组一般资料比较
2.2 各组全因子二元Logistic回归结果(见表2) 高龄在CSVD组及各亚组中均为危险因素,男性更易患WMH,吸烟史、高CysC为CSVD、Lacune、PVS的危险因素,高Hcy则为CSVD、WMH、PVS的危险因素。CysC与CSVD相关[OR=15.35,95%CI(2.31,101.81),P< 0.05],尤其与Lacune及PVS明显相关[OR=27.17,95%CI(1.92,383.55),P< 0.05;OR=26.29,95%CI(2.07,333.80),P< 0.05]。
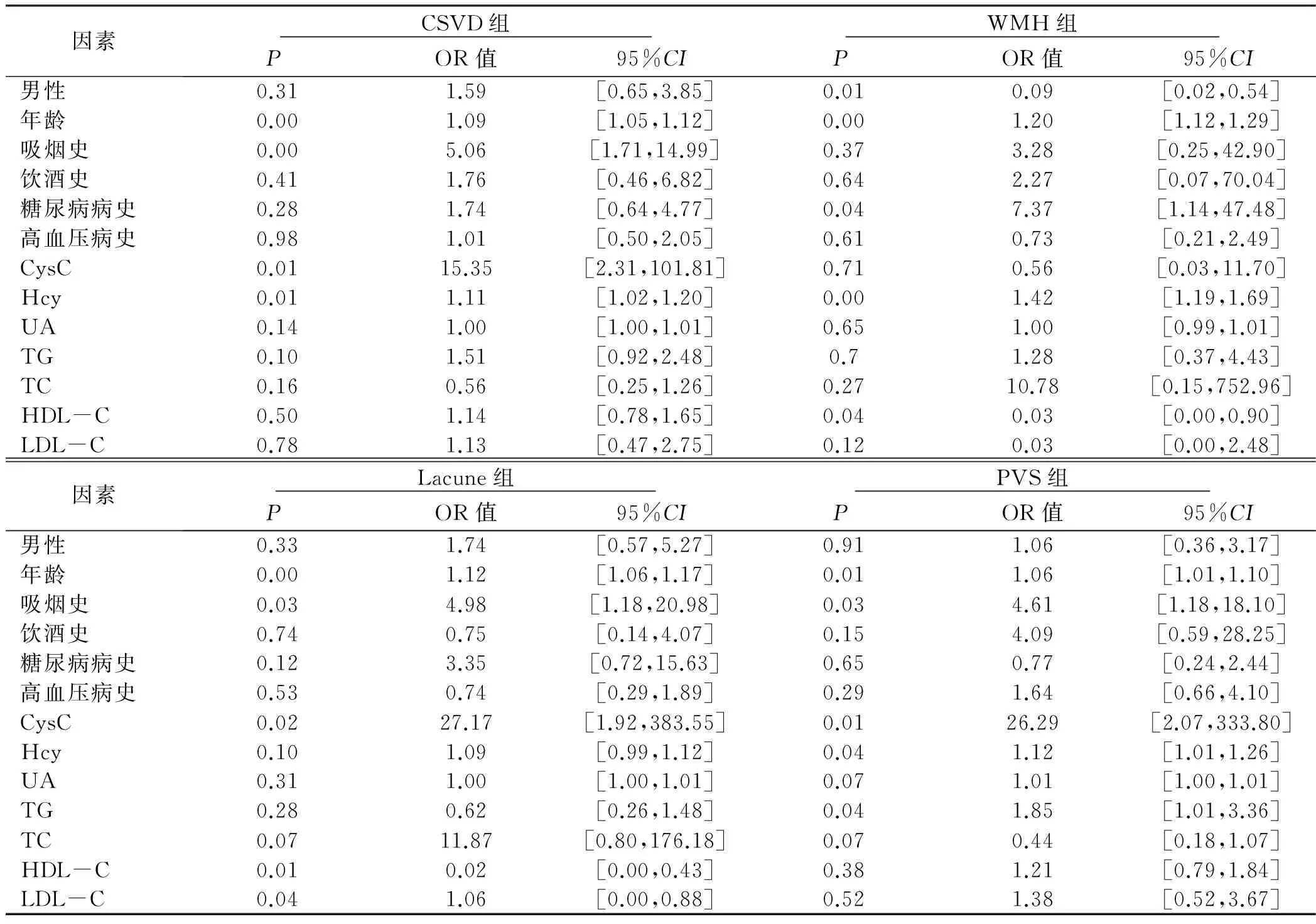
表2 各组全因子二元Logistic回归分析结果
3 讨 论
脑小血管主要起源于蛛网膜下腔的软脑膜血管网,可于脑凸面穿通至基底节。目前CSVD发病机制尚不完全明确,推测可能由于脑内慢性进行性亚临床缺血,血管通透性增加导致血管内物质外渗,血脑屏障破坏,造成局部炎性反应等因素引起血管及血管周围组织损伤[6]。目前临床中CSVD以散发型为多见,最常见的危险因素是年龄、糖尿病以及高血压,病理学改变包括动脉硬化,脑淀粉样血管病,少部分可与遗传和自身免疫等相关[7]。本研究剔除了存在中重度大动脉粥样硬化的病人,常见的动脉粥样硬化危险因素,如饮酒史、高血压病史、糖尿病病史、TC,并未在本研究所选人群中体现出显著差异,推测这与CSVD的血管病变机制较动脉粥样硬化更复杂有关。
脑小血管除了能运输血液、调节血流之外,还参与构成血脑屏障,与神经元及胶质细胞构成的神经血管单元,对大脑的功能和构成都起了重要的作用[8]。有研究发现,脑小血管床与在肾脏滤过及回吸收中参与主要作用的肾小球,具有类似解剖学和血流动力学基础,亚临床的肾小血管损伤可能与CSVD拥有共同的病理基础,因此肾脏损伤标志物水平的改变和脑微出血的存在可能是高血压等原因继发导致靶器官损伤的共同表现[9]。
应用磁共振成像对SCVD进行早期筛查成本高,耗费时间长,现阶段尚无某一血清学指标可以对CSVD进行早期监测及诊断。CysC是一种蛋白酶抑制剂,由体内大多数的有核细胞产生,在人体组织中分泌比较稳定,变异性比肌酐小,其血浆水平基本只受肾小球滤过率的影响。它对组织蛋白酶具有强烈抑制作用,而两者相互作用能够使动脉内膜下细胞的外基质沉积与降解保持动态平衡,以降低因失衡导致的动脉粥样硬化,参与了血管系统诸多的病理、生理过程。目前认为CysC和脑血管病之间存在密切关系,首先动脉粥样硬化实质上就是血管重构,血管平滑肌细胞在各种损伤性刺激下分泌组织蛋白酶,使这类具有促弹性组织离解特性的半胱氨酸蛋白酶在动脉损伤处过度表达,如果具有抗衡组织蛋白酶作用的CysC分泌失衡,则动脉粥样硬化加速[10]。其次高水平CysC对血管壁有直接的毒性损伤作用,包括血管平滑肌细胞结构破坏,纤维胶原减少,淀粉样物质等在血管壁上的沉积,造成血管脆性增加,形成微动脉瘤等最终出现脑出血[11-12]。在CSVD方面,目前发现高CysC 与急性脑卒中病人脑微出血有相关性[13]。Wada等[14]研究发现,高水平CsyC人群颅内有更多的Lacune以及高级别的脑白质病变,它对亚临床CSVD的提示意义高于肾小球滤过率(GFR)。推测可能由于CysC 参与了炎性反应过程,而炎性因素是脑叶及脑深部脑微出血存在的相对独立的危险因素[15],并且CysC水平与动脉硬化性疾病密切相关,CysC 水平也可能通过影响动脉硬化的过程和严重程度,间接地反映脑微出血的存在[15-16]。有学者认为,CysC可能是肾病标志物中预测微出血最敏感的指标[17]。本研究显示,CysC与CSVD相关,尤其是与Lacune及PVS密切相关,推测由于这两者影像学病灶直径较小,其受累血管病变范围相对较小,CsyC可能更敏感地反映早期血管损伤;而WMH病灶相对较大,影响因素更多,CsyC在其发病机制中所起的作用不显著,同时可能与研究对象的选择及样本量较小有一定关系。
本研究显示,高龄在CSVD组及各亚组中均为危险因素,男性更易患WMH,与目前部分研究结论相符[18],考虑与男性在生活习惯、性激素水平方面与女性不同有关。吸烟史、高CysC为CSVD、Lacune、PVS的危险因素,高Hcy则为CSVD、WMH、PVS的危险因素,这几种因素目前均有研究得出与CSVD有关,考虑与样本的选择、样本量偏小、发病机制复杂等原因有关。TG与PVS,HDL-C与WMH、Lacune,LDL-C与Lacune有关,血脂与CSVD的相关性已有研究[19],但目前无大规模实验证据支持此结论。
目前CsyC与颅内微出血(CMB)的研究相对较多,而与CSVD,如WMH、Lacune、PVS的研究较少。由于CSVD临床表现没有特异性,诊断主要依靠影像学检查以及脑小血管结构和功能检查。如果CsyC能成为CSVD早期诊断与监测的血清学指标,将对该病的早期发现及防治有重要意义。然而CysC与CSVD的关系还需要更深入地研究,以进一步明确其作用的确切机制。
参考文献:
[1] Wardlaw JM,Smith C,Dichgans M.Mechanisms of sporadic cerebral small vessel disease:insights from neuro imaging[J].Lancet Neurol,2013,12:483-497.
[2] Moran C,Phan TG,Srikanth VK.Cerebral small vessel disease:a review of clinical,radiological and histopathological phenotypes[J].Int J Stroke,2012,7:36-46.
[3] Pollock H,Hutchings M,Weller RO,et al.Perivascular spaces in the basal ganglia of the human brain:their relationship to lacunes[J].Anatomy,1997,191:337-346.
[4] 中华医学会神经病学分会,中华医学会神经病学分会脑血管病学组.中国脑小血管病诊治共识[J].中华神经科杂志,2015,48(10):838-844.
[5] Wardlaw JM.Neuroimaging standards for research into small vessel disease and its contribution to ageing and neurodegeneration[J].Lancet Neurology,2013,12(13):822-838.
[6] Wardlaw JM,Smith C,Dichgans M.Mechanisms of sporadic cerebral small vessel disease:insights from neuroimaging[J],2013,12(5):483-497.
[7] 张在强.脑小血管病的血管病理学改变及其结局[J].中国卒中杂志,2013,8(61):469-476.
[8] Gorelick PB,Scutefi A,Black SE,et al.Vascular contributions to cognitive impairment and dementia:a statement for healthcare professionals from the American Heart Association/American Stroke Association[J].Stroke,2011,42:2672-2713.
[9] Morgenstem LB,Hemphill JC,Anderson C,et al.Guidelines for the management of spontaneous intracerebral hemorrhage:a guideline for healthcare professionals from the American Heart Association/American Stroke Association[J].Stroke,2010,41(9):2108-2129.
[10] Shi GP.Cystatin C deficiency in human atherosclerosis and aortic aneurysms[J].J Clin Invest,1999,104(9):1191-1197.
[11] Tian J.Relationships in Alzheimer’s disease between the extent of Abeta deposition in cerebral blood vessel walls,as cerebral amyloid angiopathy,and the amount of cerebrovascular smooth muscle cells and collagen[J].Neuropathol Appl Neurobiol,2006,32(3):332-340.
[12] Ni L.Cystatin C,associated with hemorrhagic and ischemic stroke,is a strong predictor of the risk of cardiovascular events and death in Chinese[J].Stroke,2007,38(12):3287-3288.
[13] Zhang JB,Jv XH,Wang J,et al.Serum cystatin C and cerebral microbleeds in patients with acute cerebral stroke[J].J Clin Neurosci,2014,21(2):268-273.
[14] Wada M,Nagasawa H,Kawanami T,et al.Cystatin C as an index of cerebral small vessel disease:results of a cross-sectional study in community-based Japanese elderly[J].Eur J Neurol 2010,17(3):383-390.
[15] Kaorim K,Makiko T,Shuhei O,et al.Relations of blood inflammatory marker levels with cerebral microbleeds[J].Stroke,2011,42(11):3202-3206.
[16] Grazina U,Ping SG,Sigitas U,et al.Higher cystatin C level predicts long-term mortality in patients with peripheral arterial disease[J].Atherosclerosis,2011,216(2):440-445.
[17] Mi YO,Hyon L,Joon SK.Cystatin C,a novel indicator of renal function,reflects severity of cerebral microbleeds[J].BMC Neurology,2014,14:127.
[18] 史艳,郭力,解庆凡,等.缺血性脑小血管病的相关危险因素性别差异的研究[J].中风与神经疾病杂志,2015,32(8):695-698.
[19] Sabrina S,Christophe T,Carole D,et al.Plasma lipids and cerebral small vessel disease[J].Neurology,2014,83(20):1844-1852.

