不同炮制方法对蒙药塔日奴化学成分及其抗氧化作用的影响*
许 良,塞击拉呼,王曦烨,于佳琦,徐 宁,刘景林
(天然产物化学及功能分子合成内蒙古自治区重点实验室,内蒙古民族大学化学化工学院 通辽 028000)
蒙药塔日奴为大戟科植物月腺大戟(Enphorbia ebracteolata Hayata)的干燥根[1],是蒙医临床上常用的药材之一。塔日奴分布中国大陆,主产于河南、山东、江苏、安徽、湖北等省。具有下泻、消肿、消“奇哈”、杀虫、燥“协日乌素”等功效。蒙医临床上用于结喉,发症、“粘”病,黄水疮,水肿,痛风,游痛症,“协日乌素”病等[2]。近年来有关蒙药塔日奴的研究报道逐渐增多,其主要原因是蒙药塔日奴含有大量生物活性成分。其中萜类和苯乙酮类的特有成分如狼毒甲素、狼毒乙素和三帖酸具有抑制结核杆菌生长的作用[3]。临床证实,蒙药塔日奴乙醇提取物对浸润型肺结核有很好的疗效。中药优福宁(Euphomia)[4]系塔日奴(狼毒)浓缩而成的碱性糖浆膏。塔日奴中化合物Prostratin具有抗HIV病毒活性[5]。杨洪武等[6]实验证明,塔日奴能够抑制多种癌细胞。以塔日奴开发的E.F.胶囊具有明显的抗肿瘤作用[7]。塔日奴对外周血白细胞和腹水肿瘤细胞的恶性增殖有较强的抑制作用,能够促进肿瘤细胞凋亡[8]。塔日奴中某些化合物表现出非常高的细胞毒,在较高剂量下有致突变作用[5]。此外,塔日奴的免疫调节作用已被实验证实[8]。
蒙药炮制方法是历代蒙医学家经过临床用药实践中形成的一项制药技术,通过炮制蒙药,达到增效减毒之目的。蒙药塔日奴中含有的活性成分一般都有毒性。因此,处于用药安全考虑,在临床上用蒙药塔日奴之前必须进行炮制,即蒙医临床上用的是塔日奴的炮制品。诸多相关研究结果显示,抗氧化是能够达到预防衰老目的的有效途径之一,原因在于氧化剂自由基能够使得组织和细胞分解,通过对代谢功能的影响,进一步影响人体健康。假如某种药物能够消除体内产生的过多的氧化自由基,那么它对体内自由基引发的关节炎、白内障、动脉硬化、心血管病、糖尿病、老年痴呆、癌症等人体衰老相关疾病有预防作用。因此,近年来药物抗氧化活性方面的研究报道日益增多[9-14]。蒙药塔日奴的传统功效之一的治“协日乌素”病和其一种药效物质—多糖成分的治疗和预防关节炎作用相一致。为进一步阐明各种炮制方法的科学原理,同时对蒙药塔日奴的临床应用提供理论指导,本实验对蒙药塔日奴不同炮制品的化学成分以及抗氧化作用进行比较研究。
1 仪器与材料
高速离心机(上海安亭科学仪器厂,TDL-5)、透析袋(北京鼎国昌盛生物科技有限责任公司,进口分装,36 DM)、层析柱(600 mm×16 mm)、UV-240型分光光度计(日本岛津公司)、722s型可见分光光度计(上海精密科学仪器有限公司)。
DEAE-Cellulose、Sephdex G-100、硫代巴比妥酸(生化试剂,sigma公司)、氯化硝基四氮唑兰NBT(生化试剂,sigma公司)、三羟甲基氨基甲烷(生化试剂,sigma公司)、番红花红T(生化试剂)、对照品苯甲酸、甘露醇和VC(抗坏血酸)分别购自上海汕头光华化学试剂有限公司,均为分析纯。其他试剂均为分析纯,实验用水为重蒸水。塔日奴药材购自内蒙古通辽市北方药材市场,由内蒙古民族大学蒙医药学院布和巴特尔教授鉴定。
2 实验方法
2.1 蒙药塔日奴药材及其不同炮制方法
把塔日奴药材用蒸馏水冲洗2-3次之后用超纯水冲洗3-4次,晾干,置于温度为80℃的烘干箱内烘干,分别用以下炮制法炮制。
塔日奴白酒炮制:用60度白酒(由内蒙古赤峰套马杆酒业有限公司生产)浸泡6 h后置于水浴上煎煮,至白酒完全被吸收。固液比为:1:3。
塔日奴牛奶炮制:用牛奶(由内蒙古蒙牛乳业股份有限公司生产)把药材浸泡6 h,60℃的水浴上煮至牛奶全部被吸收。固液比为:1:4。
塔日奴诃子汤炮制:60℃的水浴上煮诃子汤完全被吸收。固液比:1:3。
塔日奴米醋炮制:用米醋(由镇江恒丰酱醋有限公司生产)把药材浸泡12 h,(米醋)焖润至醋被吸收,温火炒干。固液比:1:4。
塔日奴酸奶炮制:60℃的水浴上煮至酸奶全部被吸收。固液比:1:4。
2.2 塔日奴及其炮制品的提取及供试品溶液的制备
本实验选用河北省安国产地塔日奴药材。分别取塔日奴生品及其不同炮制品粉末5.0 g,置圆底烧瓶中,随后加入40 mL无水乙醇和10 mL去离子水,在95℃温度下水浴加热回流3 h。每次3 h,合并滤液,减压浓缩至15-20 mL,放置室温,加浓缩液体积的2倍无水乙醇,醇沉静置24 h、抽滤、用乙醇、丙酮、乙醚各洗2次、干燥。用蒸馏水溶解,转入50 mL容量瓶中,加蒸馏水至刻度,摇匀,得到浓度均为100 mg·mL-1的塔日奴生品以及塔日奴不同炮制品粗提物溶液。分别稀释以上6种溶液,得到抗氧化试验所需的浓度分别为0.1、0.2、0.3、0.4、0.5、0.6 mg·mL-1的塔日奴生品以及塔日奴不同炮制品粗提物溶液。
2.3 对照品溶液的制备
分别精确称取狼毒乙素、岩大戟内酯B对照品2.0 mg,定容至2.00 mL容量瓶中,得1.0 mg·mL-1对照品溶液。将2种对照品溶液按不同比例混合,得到2种对照品的混合溶液,备用。
2.4 液相色谱与大气压化学电离质谱的分析条件
2695HPLC-UV型高效液相色谱仪(waters,USA),检测条件:Agilent ZORBAX SB-C18色谱柱(250×4.6 mm,5 μm),柱温30℃,二元线性梯度洗脱:流动相:(A)乙腈、(B)水.流动相梯度组成:0-30 min,10%-55%流动相A;30-60 min,55%-95%流动相A.流速0.8 mL·min-1;样品进样量10 μL。
质谱分析条件:LCQTM大气压化学电离离子阱质谱仪(Thermo,USA):采用正离子模式,扫描范围:m/z 100-400,离子阱条件:源加热温度300℃,鞘气20 arb,辅助气5 arb,金属加热毛细管温度275℃,毛细管电压15 V。
2.5 塔日奴不同炮制品提取液的清除羟自由基活性分析
2.5.1 试剂溶液的配制
2.5.1.1 0.2 mol·L-1的PBS溶液(pH=7.4)配制0.2 mol·L-1Na2HPO4溶液:称取 35.8010 g Na2HPO4·12H2O,溶于500 mL水中;
0.2 mol·L-1KH2PO4溶液:称取 3.1120 g KH2PO4·2H2O,溶于100 mL水中;
取405 mL 0.2 mol·L-1Na2HPO4溶液与95 mL 0.2 mol·L-1KH2PO4溶液混合,即为0.2 mol·L-1的PBS溶液(pH=7.4)。
2.5.1.2 2.0 mmol·L-1的EDTANa2-Fe(II)溶液配制
EDTA溶液(4.0 mmol·L-1):称取乙二胺四乙酸二钠0.3720 g溶于250 mL水中;
硫酸亚铁胺溶液(4.0 mmol·L-1):称取硫酸亚铁胺0.3920 g溶于250 mL水中;
将以上两种溶液按1:1的体积比进行混合,即为配成2.0 mmol·L-1的EDTANa2-Fe(II)溶液。
2.5.1.3 浓度为0.52 mg·mL-1的番红花红T溶液配制
称取番红花红T 0.0520 g置于100 mL的容量瓶中,用超纯水溶解,定容,备用。
2.5.1.4 浓度为6%的H2O2溶液
量取30%的H2O210 mL定容至50 mL的容量瓶中备用。
2.5.2 清除羟自由基活性测试方法
测试方法原理如同文献[16]。精密量取1.5 mL浓度为0.2 mol·L-1的PBS(pH=7.4)缓冲溶液,分别加入浓度为 2.0 mmol·L-1的 EDTANa2-Fe(II)0.7 mL,浓度为0.52 mg·mL-1的番红花红T溶液0.2 mL,分别加入不同浓度的供试品溶液1.0 mL,分别加6%的H2O2溶液0.4 mL,用超纯水定容至5.0 mL,混匀。将以上反应体系的溶液置于37℃的恒温水浴中反应30 min,在520 nm处分别测定样品吸光度值A。空白样品用1.0 mL的超纯水代替供试品溶液。记录各样品的吸光度值,并按下式计算清除羟自由基的清除率E(%):
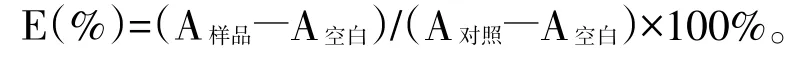
2.6 蒙药塔日奴不同炮制品提取液的清除亚硝酸根作用的分析方法
2.6.1 试剂溶液的配制
2.6.1.1 50 mol.L-1NaNO2溶液
准确称取345.0 g NaNO2,加蒸馏水定容至100 mL;
2.6.1.2 pH=3.0的柠檬酸钠-柠檬酸缓冲溶液
(1)0.1 mol·L-1的柠檬酸溶液:准确称取柠檬酸2.101 g,加蒸馏水定容至100 mL;
(2)0.10 mol·L-1柠檬酸钠溶液:准确称取柠檬酸钠2.941 g,加蒸馏水定容至100 mL;
分别取(1)号溶液18.6 mL,(2)号溶液1.4 mL,混合,即可。
2.6.1.3 0.4%对氨基苯磺酸
称取0.40 g对氨基苯磺酸,溶于100 mL 20%的盐酸中,避光保存。
2.6.1.4 0.2%N-1-奈基乙二胺盐酸
称取0.2gN-1-奈基乙二胺盐酸,溶于100 mL水中,避光保存。
2.6.2 清除亚硝酸根作用的分析方法
方法原理见文献[16]。精密取50 mol.L-1的NaNO2溶液2.00 mL置于10 mL容量瓶中,加入2.00 mL供试品溶液,依次加蒸馏水2.00 mL、pH=3.00的柠檬酸缓冲液5.00 mL,定容到10.00 mL,37℃水浴中放置1 h。冷却到室温后移取1.0 mL置于10 mL容量瓶中,加0.40%对氨基苯磺酸2.00 mL,放置5 min,随后加0.20%N-1-萘基乙二胺盐酸盐1.00 mL,定容至10 mL,混合均匀后放置15 min,在538 nm处测定反应体系的吸光度值。按下列公式计算清除能力:

2.7 蒙药塔日奴及其不同炮制品提取液清除超氧阴离子自由基作用的分析
方法原理见文献[10]。取0.1 mol.L-1PH为8.2的Tris-HCl缓冲溶液2.50 mL置于试管中,在25℃水浴上预热10 min,随后分别加入不同浓度的供试样品溶液0.20 mL,0.98 mmol·L-1的NBT 0.6 mL,10 mmol·L-1的邻苯三酚0.30 mL,混匀,在25℃水浴中反应4 min,加入8 mol.L-1的HCl 0.2 mL终止反应,并在530 nm处测定吸光度A值。用蒸馏水代替供试品溶液作空白。反应总体积3.8 mL。清除率按以下式进行计算:

A空白— —重蒸馏水代替样品时超氧阴离子自由基体系的吸光度值;
A样品— —加入拱式样品时超氧阴离子自由基体系的吸光度值。
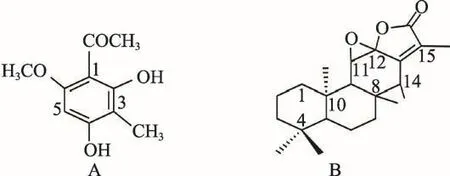
图1 塔日奴中两种成分的化学结构式:(A)狼毒乙素(2,4-dihydroxy-6-methoxy-3-methylacetophenone);(B)岩大戟内酯B(Jolkinolide B)
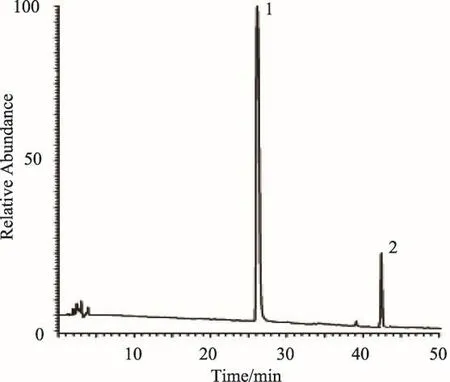
图2 对照品狼毒乙素和岩大戟内酯B溶液的HPLC谱图
3 实验结果
3.1 塔日奴生品及炮制品中指标成分含量的HPLC分析
塔日奴中两种主要成分狼毒乙素(2,4-dihydroxy-6-methoxy-3-methylacetophenone)、岩大戟内酯 B(Jolkinolide B)的结构式列于图1。
狼毒乙素和岩大戟内酯B对照品溶液的HPLC谱图见图2,塔日奴生品及炮制品的HPLC谱图见图3。
主要活性成分的含量测定结果见表1。精密吸取不同梯度浓度的岩大戟内酯B、狼毒乙素对照品溶液,依次进样20 μL,以相应的色谱峰面积Y为纵坐标,对照品进样量X(μg)为横坐标进行回归,得到的回归方程及线性范围分别为:狼毒乙素:Y=5.786 7×104X-1.763 35×105,r=0.99 96,线性范围为20-100 μg;岩大戟内酯B:Y=1.338 6×104X-3.311 7×104,r=0.999 8,线性范围为10-100 μg。狼毒乙素和岩大戟内酯B加样回收率试验结果见表1。
本实验得到的标准曲线在线性范围内线性关系良好。塔日奴的醋蒸、酒蒸、蜜蒸、清蒸炮制品中2种有效成分狼毒乙素和岩大戟内酯B的含量测定结果见表2。从表2得知,相对于生品不同炮制品中狼毒乙素和岩大戟内酯B的含量均明显减少,只有酸奶炮制品中2种指标成分的含量相对于生品明显增加。
3.2 塔日奴生品及炮制品的大气压化学电离质谱分析
塔日奴生品及炮制品的大气压化学电离质谱图(APCI-MS)见图4,在正离子模式下的一级质谱中,各类有效成分以质子化的准分子离子形式存在。从谱图可知,塔日奴未炮制品(A)、酸奶蒸品(B)、白酒蒸品(C)、清蒸品(D)、醋蒸品(E)、蜜蒸品(F)提取液APCIMS一级谱中主要分子离子峰分别为m/z 197、m/z 235、m/z 317和m/z 331,提示塔日奴炮制过程中其化学组成基本不变。
对塔日奴及其不同炮制品乙醇提取物中保留时间26.3 min的m/z 197峰以及保留时间为42.5 min的m/z 331峰进行串联质谱分析,其多级质谱图分别见图5和图6。根据色谱保留时间、结构信息、对照品及参考文献比对,鉴定质荷比为197的化合物为狼毒乙素,质合比为331的化合物为岩大戟内酯B,该两种化合物在塔日奴及其不同炮制品乙醇提取物中均存在,即塔日奴炮制过程中两种指标成分的分子结构不发生变化。
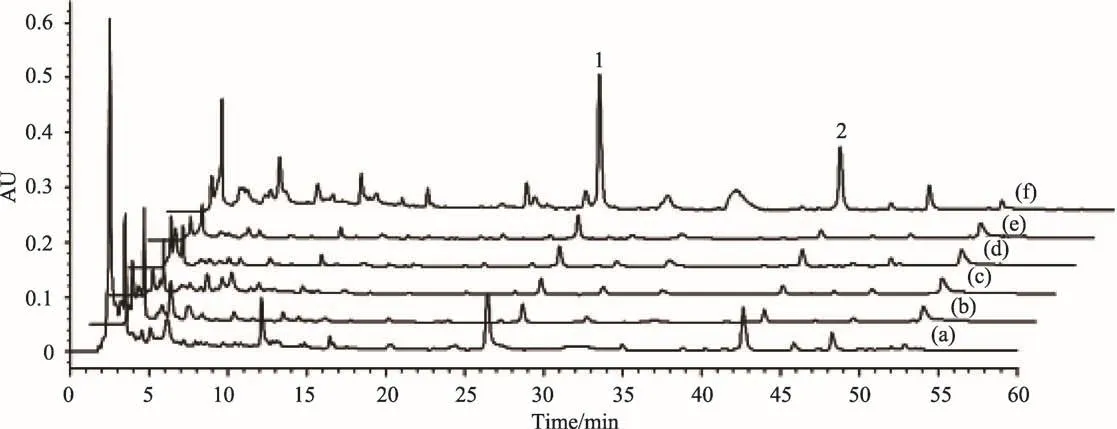
图3 塔日奴及其不同炮制品的HPLC谱图
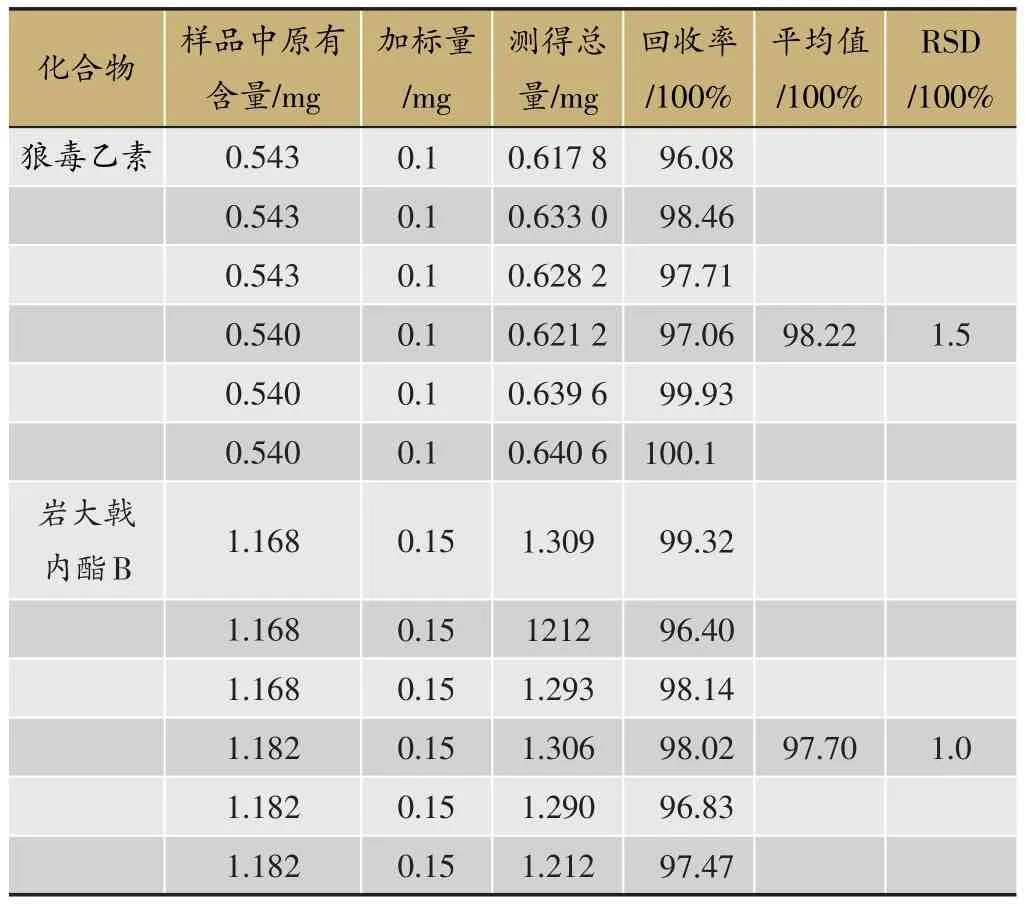
表1 狼毒乙素和岩大戟内酯B加样回收率试验结果(n=6)
根据以上分析结果,对两种化合物可能的裂解机理见图7和图8。
3.3 抗氧化作用分析结果
3.3.1 清除羟自由基活性分析
分析结果见图9。图9显示,以甘露醇为阳性对照,所测定的塔日奴及其不同炮制品提取液对·OH的清除能力有所不同,其清除羟自由基能力由弱到强的顺序为:米醋炮制品(EC50=1.600 mg·mL-1)<诃子汤炮制品(EC50=0.638 mg·mL-1)<白酒炮制品(EC50=0.600 mg·mL-1)<酸奶炮制品(EC50=0.539 mg·mL-1)<塔日奴生品(EC50=0.378 mg·mL-1)<牛奶炮制品(EC50=0.330 mg·mL-1)<甘露醇(EC50=0.277 mg·mL-1)。
3.3.2 清除亚硝酸根作用的分析
以抗血酸为阳性对照,分别测定塔日奴及其五种炮制品的清除亚硝酸根自由基能力,分析结果见图10。图10表明,其对亚硝酸根自由基抗氧化作用由弱到强顺序为:酸奶炮制品(EC50=0.037 mg·mL-1)<白酒炮制品(EC50=0.0.036 mg·mL-1)<米醋炮制品(EC50=0.034 mg·mL-1)<抗血酸(EC50=0.031 mg·mL-1)<塔日奴生品(EC50=0.031 mg·mL-1)<诃子汤炮制品(EC50=0.028 mg·mL-1)<牛奶炮制品(EC50=0.021 mg·mL-1)。其中有3种炮制品(牛奶炮制法>诃子汤炮制法>米醋炮制法)的清除亚硝酸根自由基能力较强,它们的EC50值比对照品抗血酸的EC50值小。
3.3.3 清除超氧阴离子自由基作用的分析结果
以甘露醇为阳性对照,测试塔日奴生品及其五种炮制品的清除超氧自由基能力,结果见图11。图11表明,对超氧自由基的抗氧化作用由弱到强顺序为:白酒炮制品(EC50=13.399 mg·mL-1)<米醋炮制品(EC50=9.763 mg·mL-1)<塔日奴生品(EC50=7.715 mg·mL-1)<牛奶炮制品(EC50=5.565 mg·mL-1)<诃子汤炮制品(EC50=4.901 mg·mL-1)<甘露醇(EC50=3.896 mg·mL-1)<酸奶炮制品(EC50=3.808 mg·mL-1)。结果表明,酸奶炮制品的清除超氧自由基能力比对照品甘露醇的清除能力强。
4 讨论
4.1 塔日奴药理作用现代研究
塔日奴药理作用现代研究表明,岩大戟内酯B的抗肿瘤作用较强,而狼毒乙素的抗结核作用明显。说明狼毒乙素、岩大戟内酯B为蒙药塔日奴主要的活性成分之一。因此,以两种成分为指标,考察不同炮制方法对它们含量的影响,对阐明蒙药塔日奴的炮制原理的进一步阐明具有一定的现实意义。APCI-MS-MS分析结果表明,蒙药塔日奴经不同方法炮制后其指标成分狼毒乙素、岩大戟内酯B的分子结构未发生变化;用HPLC技术对蒙药不同炮制品的分析结果表明,炮制后蒙药塔日奴中以两种化合物为代表的的各有效成分含量有了一定变化。塔日奴的醋蒸、酒蒸、清蒸、蜜蒸炮制品中上述两种有效成分的含量均较低,而本实验首次采用的炮制法—酸奶炮制法得到的炮制品中两种指标成分含量较高。本实验结果提示,在临床用药时蒙药塔日奴的炮制方法应首选酸奶炮制法,以便达到塔日奴有效成分的充分利用之目的。
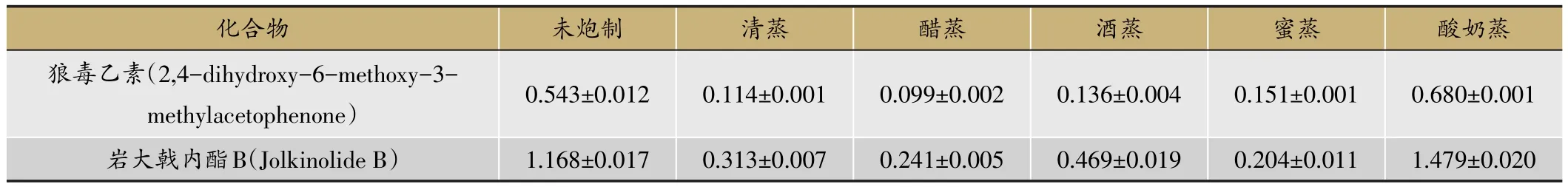
表2 塔日奴不同炮制品中2个有效成分的含量(mg.g-1,n=5)
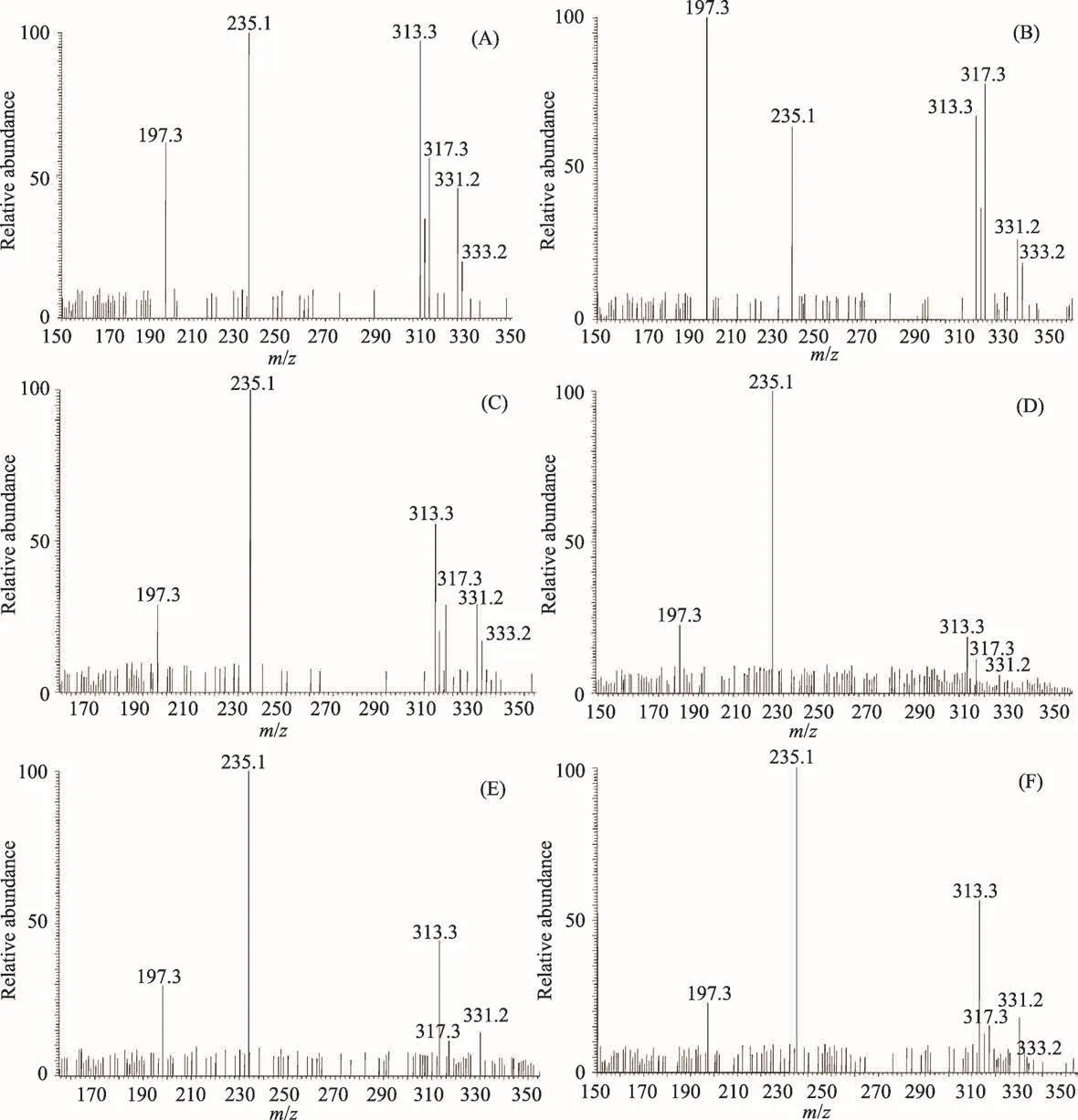
图4 塔日奴及其不同炮制品的大气压化学电离质谱图
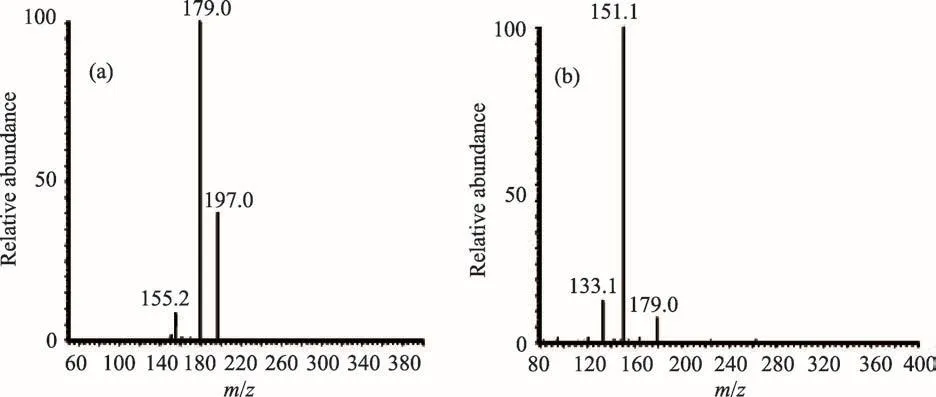
图5 质荷比197离子的二级(a)、三级质谱图(b)
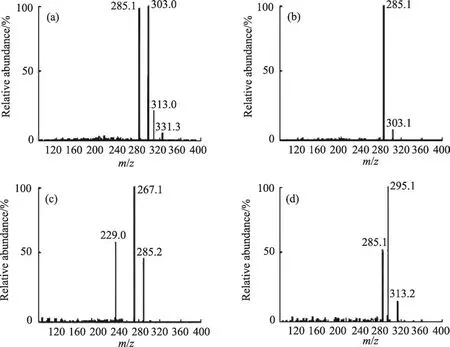
图6 质荷比331离子的二级(a)、三级(b、c、d)质谱图

图7 狼毒乙素(2,4-dihydroxy-6-methoxy-3-methylacetophenone)可能的裂解机理
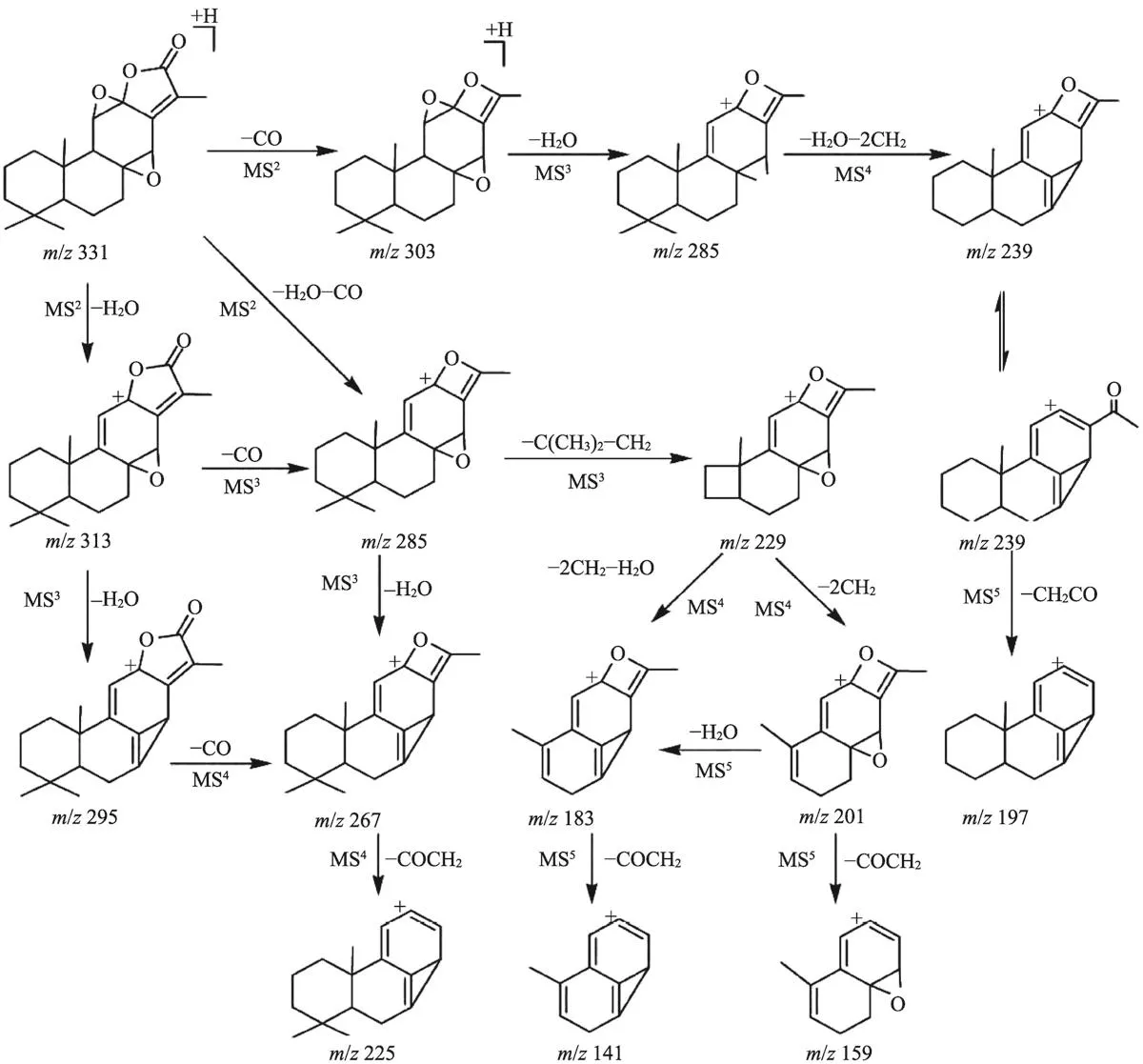
图8 岩大戟内酯B(Jolkinolide B)可能的裂解机理
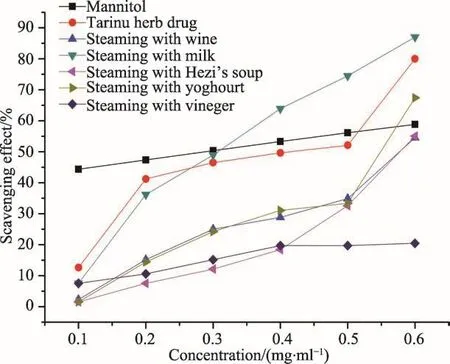
图9 塔日奴及其5种炮制品提取液清除羟自由基比较
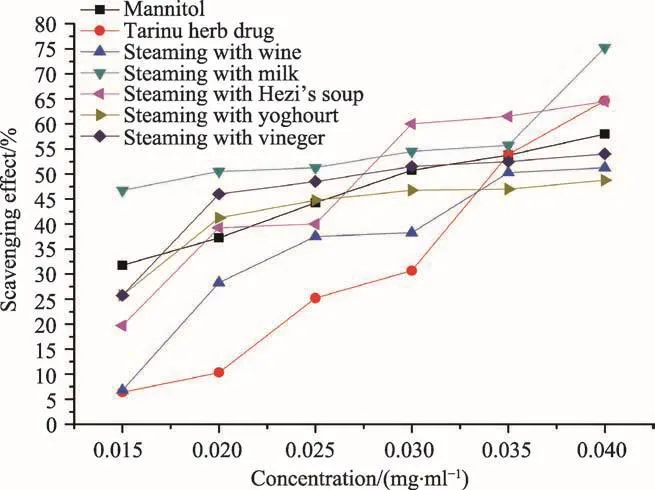
图10 塔日奴及其5种炮制品提取液清除亚硝酸根自由基的比较
4.2 塔日奴生品及其五种炮制品的抗氧化作用研究
对塔日奴生品及其五种炮制品的抗氧化作用考察实验结果表明:羟自由基抗氧化作用强弱顺序为:塔日奴>酸奶炮制品>白酒炮制品>诃子汤炮制品>牛奶炮制品>米醋炮制品;亚硝酸根抗氧化作用强弱顺序为:牛奶炮制品>诃子汤炮制品>米醋炮制品>塔日奴>白酒炮制品>酸奶炮制品;超氧自由基抗氧化作用强弱顺序为:酸奶炮制品>诃子汤炮制品>牛奶炮制品>塔日奴>米醋炮制品>白酒炮制品,即蒙药塔日奴不同炮制品抗氧化作用有所区别。以上实验结果显示,蒙药塔日奴酸奶炮制炮制品的羟自由基和超氧自由基抗氧化作用均为突出。在蒙医临床上治疗一些体内自由基导致的关节炎、动脉硬化、老年痴呆、糖尿病、癌症等人体衰老相关疾病时建议用塔日奴酸奶炮制品。

图11 塔日奴及其5种炮制品提取液对O2-的清除作用比较
蒙药塔日奴为毒性药物,炮制塔日奴的目的为达到减毒增效之目的。课题组用斑马鱼初期胚胎作为实验模型,考察塔日奴及其不同炮制品毒性的实验正在进行中。
1 国家中医药管理局中华本草编委会.中华本草.上海:上海科技出版社,1999:4780
2 内蒙古自治区卫生厅编.内蒙古蒙药材标准.赤峰:内蒙古科学技术出版社,1984:467
3 浮光苗,余伯阳,朱丹妮.月腺大戟化学成分的研究.中国药科大学学报,2003,34(4):377-379
4 胡树德,谈光新,张涵庆,等.中药优福宁的毒性及体内外抗结核菌活性的实验研究.中国中医药科技,1998,5(1):12-13
5 吴起成,尤奋强,丁安伟,等.白狼毒化学成分和生物活性研究进展.药学与临床研究,2009,17(2):125-131
6 杨洪武,王峥,郑学敏.狼毒大戟活性成分体外抑瘤研究.辽宁中医杂志,2002,29(1):53-54
7 王峥.E.f中抗瘤有效部位的研究与开发.沈阳:辽宁中医学院硕士学位论文,2002
8 陈鸣岳.月腺大戟抗淋巴细胞性白血病机理的研究.济南:山东大学硕士学位论文,2005
9 Shen S,Cheng H,Li X,et al.Effects of extraction methods on antioxidant activities of polysaccharides from camellia seed cake,Eur.Food Res Technol,2014,238(6):1015-1021.
10 Pan S,Wu S.Cellulase-assisted extraction and antioxidant activity of the polysaccharides from garlic.Carbohydr.Polym.2014,111(1):606-609.
11 Ye C L,Hu W L,Dai D H.Extraction of polysaccharides and the antioxidant activity from the seeds of Plantago asiatica L.Int J Biol Macromol,2011,49(9):466-470.
12 Chen H,Zhang M,Qu Z,et al.Antioxidant activities of different fractions of polysaccharide conjugates from green tea(Camellia Sinensis).Food Chem,2008,106(2):559-563.
13 Jia X,Dong L,Yang Y,et al.Preliminary structural characterization and antioxidant activities of polysaccharides extracted from Hawk tea(Litsea coreana var.lanuginosa).Carbohydr Polym,2013,95(1):195-199.
14 Wang C,Wang C,Quan Y.Extraction of polysaccharides from Phellinus nigricans mycelia and their antioxidant activities in vitro.Carbohydr Polym,2014,99(99):110-115.
15 Zhao Z Y,Xu X J,Ye Q G.Ultrasound extraction optimization of Acanthopanax senticosus polysaccharides and its antioxidant activity.Int J Biol Macromol,2013,59(4):290-294.
16 Wu C,Yu Y C,Wang L P.Study on the Inhibition of Nitroso Reaction by Microemulsion of Quercetin.Nat Prod Res Dev,2008,20:12-15

