一株异养型细菌对无机硫化物的降解特性和培养条件优化
庄荣玉,赵洋甬,沈青青,何小蝶,任雨婷,李美燕,娄永江,严小军
1宁波大学海洋学院 浙江省动物蛋白食品精深加工重点实验室 应用海洋生物技术教育部重点实验室,浙江 宁波 —315211
2浙江易测环境科技有限公司,浙江 宁波 315194
3香飘飘食品股份有限公司,浙江 湖州 313000
4中国水稻研究所,浙江 杭州 311400
大气污染、恶臭、噪声、水质污染、振动、土壤污染、地基下沉是七大典型公害,恶臭物质居于第二,它包括挥发性无机物 (Volatile inorganic compounds,VIC)和有机物 (Volatile organic compounds,VOC)[1]。目前,以人类的嗅觉能够感知的恶臭物质有4000多种,其中有50多种对人类的危害较大,主要是硫化氢[2]、氨、硫醇类[3]、二甲基硫醚[4]、三甲胺、醛类、苯类和酚类等[5]。硫化氢是硫系恶臭成分中最常见的恶臭气体,主要来自于污水处理设施、石油炼制、堆肥、畜禽屠宰、鱼粉饲料加工、制革和造纸等工农业生产排放的废气[5-9],其臭阈值很低,约为0.00143 mg/m3[10],微量浓度的H2S就具有强烈的恶臭气味。H2S气体无色,对人体有剧毒,低浓度中毒对眼睛和呼吸系统有强烈的刺激和腐蚀作用,重度中毒造成中枢神经系统、心脏、肺细胞损害,出现呼吸、心跳骤停,发生闪电型死亡[2]。它会引起金属和设备腐蚀,在空气中容易被氧化成SO2,对生态环境产生酸雨和致毒效应。
恶臭污染物治理难度较大,物理法、化学法对于此种污染的处理存在效率低、能耗高的缺点,废气达标排放较难。目前在国内外生物法脱臭已成为主流方法,具有除臭率高、无二次污染、所需设备简单、运转成本低及废气经过处理可以达标排放等优点[1,11-12]。其原理是利用微生物的生理代谢活动来降解恶臭物质,将其转化为无异味、对环境无害的产物,从而达到除臭目的。
无机硫和其化合物在自然界中分布范围很广,能以30多种不同的离子或分子形式存在,仅有5种无机硫化物在室温和一个大气压下在溶液中具有稳定性,它们是 SO42–、HSO4–、S0、H2S、HS–。其他形式的硫例如多硫化合物、硫代硫酸盐和连多硫酸盐则是不稳定的。自然界中能氧化无机硫化物的细菌种类很多,大部分是光合硫细菌和化能自养型细菌[2],目前工业上用于脱除硫化氢的微生物主要是自养型硫杆菌属细菌Thiobacillussp.[13-15],此类细菌对硫化氢的转化途径较简单,普遍是利用还原态的硫化物作为能源,将硫转化为单质硫、硫酸或者硫酸盐等物质,其催化的硫素转化途径为:S2–→S0→SO32–→SO42–。王帆等[16]在有臭味的污泥中筛选到一株氧化亚铁硫杆菌,降解硫化物的最大量为1290.3 mg/L。伍永钢等以自养菌[17]应用到生物滴滤床净化H2S气体,去除率稳定在95%以上。钱东升等[10]用板式生物滴滤塔净化硫化氢的研究表明净化也主要由自养菌完成。然而自养型硫氧化细菌进行硫化物的去除存在一些缺点:1)有些菌种在氧化硫化物的同时产生硫酸,会抑制菌体活性,大量产酸还会导致菌体自溶,降低除硫速率;2)有些需要加入碱进行中和,增加了处理成本。
本研究团队承担了鱼粉饲料加工、畜禽屠宰加工恶臭废气生物法处理工程的科研项目,鱼粉加工废气除含有硫化氢、氨气无机污染物,还含有高浓度三甲胺[18]、甲硫醇、甲硫醚、二甲二硫等有机恶臭污染物。屠宰加工废气除含有硫化氢、氨气,还含有反复回用融化食品级脱毛石蜡和松香的高温挥发有机成分,自养菌难以在含有机成分混合废气的环境中生长。此外,将废气与车间中的空气引入工业生物滴滤塔的离心机风量高达4×104m3/h,反应器内需要使用好氧的异养型微生物,因此筛选具有脱除硫化氢气体功能的异养菌具有重要意义。
目前国内外关于能够高效去除无机硫化物的异养型脱硫微生物的降解特性基础研究鲜有报道。本团队在前期工作中已经筛选出一株具有高效脱硫功能的异养型真核微生物热带假丝酵母菌ZJY-7[19]。为实现以异养型细菌脱除硫化氢气体之目的,本研究又选育出一株比较容易培养、在自然环境下能够高效脱硫的异养型细菌蜡状芽胞杆菌,对其降解硫化物的生理特性进行了考察,并采用响应面法优化菌株的脱硫工艺参数,为今后将该细菌应用到工业生物滴滤塔反应器脱除H2S废气奠定小试研究基础。
1 材料与方法
1.1 出发菌株
本实验室保存的脱硫菌Bacillus cereusXJ-2菌株,分离自宁波市某鱼粉加工厂污水沉淀池的污泥,脱硫率达87.1%[20]。
1.2 培养基
营养肉汤培养基:蛋白胨10.0 g,牛肉浸出粉3.0 g,氯化钠5.0 g(杭州微生物试剂有限公司),加热溶于1000 mL蒸馏水,根据不同需要调pH后,121℃灭菌20 min。
分离筛选培养基:营养琼脂培养基 (杭州微生物试剂有限公司)。
1.3 诱变试剂
将脱硫XJ-2菌株在新鲜斜面上活化,30℃培养24 h,共活化2次。将菌苔转移到装有玻璃珠的磷酸缓冲溶液 (pH 7.0)三角瓶中,置于30℃、180 r/min下摇瓶30 min,制成菌悬液,细胞浓度约 1.2×108–1.5×108CFU/mL。取 10 mL 菌悬液于培养皿中,将皿盖打开,在超净台紫外灯下照射20 s,30℃恒温避光培养48 h,然后涂布在营养琼脂固体平板上,在30℃培养48 h,挑取生长的单菌落进行平板划线、分离,纯化后的15个菌株,编号分别为ZJNB-B1,ZJNB-B2,……,ZJNB-B15,保藏在斜面培养基上。
1.4 高效脱硫菌株筛选
1.4.1 初筛
取上述15个菌株,分别接种到初始pH 7.0、100 mL营养肉汤锥形瓶中,置于30℃、150 r/min下培养18 h的种子液。在850 mL容量的气体研究用密封瓶 (以下简称反应瓶)中加入初始pH 7.0、小于150 mL的营养肉汤,灭菌后先加入浓Na2S水溶液使得初始S2–浓度为200 mg/L,加5%种子液使反应初始的液体总体积为150 mL,瓶口用橡胶塞密封,在30℃、150 r/min下培养48 h,每种处理做4个重复试验。检测48 h各瓶中硫酸盐的浓度,以评定菌株对S2–的氧化脱除能力,最终确定4株生成硫酸盐浓度较高的菌株为脱硫能力比较好的初筛菌株。
1.4.2 复筛
取上述初筛4株菌株,按照初筛方法进行复筛,每种处理做4个重复试验。检测48 h残余S2–浓度和硫酸盐浓度,选择出累积硫酸盐浓度最高的、同时脱硫率较高的复筛菌株,即为高效脱硫菌株。
1.5 菌株鉴定
形态学鉴定:采用光学显微镜 (日本Olympus,BX51)和扫描电子显微镜 (日本Hitachi,SU-70)。生理生化鉴定:采用API 50 CHB试剂条,购自上海梅里埃生物工程有限公司。分子生物学鉴定:采用生工生物工程 (上海)股份有限公司的Ezup柱式SK8255细菌基因组DNA抽提试剂盒进行DNA提取和纯化,对菌株的16S rRNA基因进行PCR扩增,细菌通用引物序列为 27F:5′-AGTTTGATCCTGGCTCAG-3′,1492R:5′-GGTTACCTTGTTACGACTT-3′。PCR扩增反应参数如下:94℃预变性4 min;循环数35次 (95℃变性45 s,55 ℃退火45 s,72 ℃延伸60 s);72℃终延伸10 min,4℃保温10 min以上。取PCR产物进行1%琼脂糖凝胶电泳检测,用SanPrep SK8131 DNA凝胶回收试剂盒回收,产物由生工生物工程 (上海)股份有限公司进行测序 (ABI 3730-XL,Applied Biosystems,USA)。测序结果与NCBI的GenBank中的已知序列进行同源性比较分析,选取1500 bp左右长度进行比对,采用邻位连接法 (Neighbor-joining)进行系统发育分析 (MEGA 6.06),以确定菌株的属名和种名。
1.6 菌株生长曲线测定
将脱硫菌株接种于种子培养基,在30℃、150 r/min下培养18 h,接种5%到400 mL的营养肉汤中,在30℃、150 r/min下培养,测定该菌株的生长曲线。
1.7 单因素对菌株降解硫化物效果的影响
调反应瓶内培养液初始pH为7.0,灭菌后加入初始 S2–浓度分别为 100、200、250、300、400 mg/L,最后加5%种子液使反应初始的液体总体积为150 mL,置于30℃、150 r/min下培养48 h,每隔12 h取液体分析硫化物、硫酸盐含量、pH值、OD变化,测定出菌株氧化无机硫化物的最适初始S2–浓度。然后,在最适初始S2–浓度下考察菌株将S2–氧化产生硫酸盐的最适初始pH值、最适培养温度的生理代谢条件。上述每种处理都设置3个平行样,并做空白对照。
1.8 多因素降解硫化物效果的优化
运用响应面法考察初始S2–浓度、初始pH值和接种量3个环境因素在最适培养温度下对菌株降解硫化物的影响。响应面参数设计见表1。

表1 Box-Behnken响应面实验设计因素及水平Table 1 Factors and levels of the Box-Behnken experimental design
1.9 检测和分析方法
细胞数量表征采用吸光值 (OD)法,使用分光光度计在600 nm处进行直接分析 (UV-1800,美析 (中国)仪器公司,上海)。采用戴安公司(DIONEX)ICS 2000离子色谱仪检测液体中的S2–、SO42–浓度。
2 结果与分析
2.1 高效脱硫异养型细菌的筛选
初筛:王惠祥等报道根瘤菌属[21]异养菌氧化无机硫化物的转化途径与引言中所述的自养菌基本相同。微生物将S2–氧化成最稳定的氧化物形式是硫酸盐,其无异味、对环境无害,从而能达到降毒除臭目的。因此,本研究通过检测反应结束硫酸盐的浓度高低,来评定菌株对无机S2–的氧化脱除能力的大小。每一种处理做4个重复试验,最终确定ZJNB-B2、ZJNB-B3、ZJNB-B5、ZJNB-B8共4株在48 h生成硫酸盐浓度较高的菌株为氧化脱硫效果比较好的初筛菌株,结果见图1各处理左柱所示。
复筛:对初筛出的4株菌株进行复筛,检测初始0 h S2–浓度和48 h S2–的浓度,以计算脱硫率,结果如图1各处理的右柱所示;并检测48 h各处理的硫酸盐浓度,其结果均与初筛平均值相同,因此在图1中不重复表示。由图1结果可以得出ZJNB-B3菌株累积硫酸盐浓度最高,同时其脱硫率也为最高,达97.2%。将其接种于斜面上,在30℃下培养24 h,置于4℃冰箱中保存。
2.2 菌株鉴定
2.2.1 形态学研究
光学显微镜观察到ZJNB-B3菌体为革兰氏阳性杆菌,产中生芽胞,具有运动性。扫描电镜(SEM)观察到的菌株形态见图2,菌体细胞大小为 (1.0−1.2)µm×(3.0−5.0)µm。

图1 四个菌株生成硫酸盐的能力和脱硫率Fig.1 The sulfate generation and removal efficiency of sulfide of four strains.

图2 扫描电镜观察到的ZJNB-B3菌株形态Fig.2 Morphology of ZJNB-B3 examined under a scanning electron microscope.
2.2.2 生理生化鉴定
碳源利用试验:采用法国bioMérieux公司生产的API 50CHB试剂条,这是一种用于研究芽胞杆菌对49种糖发酵作用的快速测定试剂条。将结果 (表2)输入API芽胞杆菌鉴定数据库中进行对比。补充生理生化试验:菌株的氧化酶试验阴性;接触酶试验阳性;精氨酸双水解酶阴性。鉴定结果表明,ZJNB-B3为芽胞杆菌属的蜡状芽胞杆菌Bacillus cereus。
2.2.3 分子生物学鉴定
采用16SrRNA基因通用引物,对细菌的16SrRNA基因进行PCR扩增,并进行DNA测序,将得到的序列与The National Center for Biotechnology Information(NCBI)的GenBank中公开的已知序列通过Blastn软件进行比对,目标菌株与已知的Bacillus cereusLN890259.1相似性达到了100%。菌株与Bacillussp.中其他相近的模式菌株比对的结果见图3系统发育树。根据分子生物学鉴定结果,将菌株命名为B.cereusZJNB-B3(蜡状芽胞杆菌ZJNB-B3)。此菌株于2016年6月22日保藏于中国典型培养物保藏中心,保藏号:CCTCC No.M 2016337。2017年8月将菌株的基因序列提交GenBank,申请登录号为MF679650。

表2 API 50CHB的试验项目及结果Table 2 Results of API 50CHB test

图3 菌株ZJNB-B3与Bacillus sp.中模式菌株的系统发育树Fig.3 The phylogenetic tree of the strain ZJNB-B3 with other strains of Bacillus sp..
2.3 菌株生长曲线测定
测30℃培养菌液在波长600 nm处的吸光值(OD600),该波长下细胞数量与OD值呈正比,可用OD值变化表征细菌数量的变化,以未接种液体培养基作为空白,绘制生长曲线。由图4可见,菌液在0−2 h吸光值较小,小于0.5,这是细菌生长的延迟期,是菌体对所处环境的适应期;在2−22 h时,菌液的吸光值呈直线快速上升,这是细菌生长对数期,细菌在适宜的环境条件下不断吸收营养物质细胞繁殖速度最快;在22−85 h时,吸光值的变化幅度较小,基本上保持稳定,为细菌生长的稳定期,此阶段,细胞代谢产物的积累速度达到高峰,显微镜还观察到此阶段菌体开始形成芽胞;在85−100 h时,吸光值明显呈现下降趋势,为细菌生长的衰亡期。
2.4 单因素下菌株降解硫化物生理特性研究
由图4可知菌株在不含S2–环境下在48−72 h都处于菌体生长的稳定期。向营养肉汤中加入200 mg/L初始S2–底物,然后接种5%种子液,每隔12 h检测0−72 h各瓶中硫酸盐浓度,发现反应48 h后累计的硫酸盐浓度变化不大,在72 h瓶中硫酸盐的浓度很接近在48 h硫酸盐的值,因此之后在含有S2–环境因素下的菌株生理特性研究都在48 h结束。
2.4.1 菌株最高耐受有毒硫化物的浓度
硫化物对好氧生物是一种高度有毒的物质[22],毒性作用主要包括有氧呼吸毒性和神经毒性。硫化物特别是H2S渗透进入生物体内的能力很强,如在较小型底栖生物组织中其扩散系数约为5×10–6cm2/s[23]。硫化物很容易穿过生物体的体表,进而对其生理代谢产生毒性效应。因此,硫化物对微生物细胞也具有一定的毒性。
肉汤初始pH值为7、初始S2–为100−400 mg/L,接种5%的种子液,置于30℃、150 r/min下培养48 h硫酸盐的含量变化见图5,反应期间的pH值、OD变化分别见图6、7。由图5可知,当初始S2–浓度从100、200 mg/L不断上升到250 mg/L时,由于添加的Na2S水溶液碱性很强,反应初始0 h的pH从8.09不断增大到8.66(图6),但是48 h的代谢产物硫酸盐的浓度不断增长,分别为22.2、47.7、57.5 mg/L,柱子上面的字母a、b、c、d表示结果有显著差异 (P<0.05)。
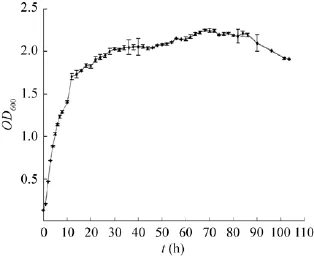
图4 菌株ZJNB-B3的生长曲线Fig.4 The growth curve of ZJNB-B3 strain.
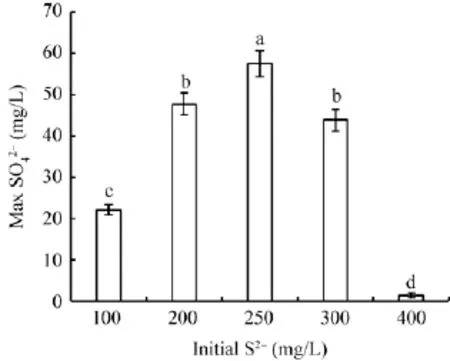
图5 菌株在不同初始S2–浓度下累计硫酸盐浓度Fig.5 The maximum accumulation of concentration of sulfate subjected to different initial sulfide treatments P<0.05.

图6 菌株在不同初始S2–浓度时的pH值变化Fig.6 pH value at different initial S2–concentrations of the strain.

图7 菌株在不同初始S2–浓度时的OD变化Fig.7 OD value at different initial S2–concentrations of the strain.
当添加S2–为 300 mg/L时,0 h的 pH值为8.90,48 h的硫酸盐浓度略微下降到43.9 mg/L,其对硫化物的脱除能力仍然显著。而当初始S2–浓度为400 mg/L时,反应初始0 h的pH值高达9.14,12 h的OD值比0 h的OD值下降,说明反应开始阶段处于强碱性条件下,接种的细菌被部分杀死而且生长受到抑制,培养24 h后pH值才下降到7.53,OD值增大到1.34,菌体开始繁殖,48 h时pH值降为7.17,但产生的硫酸盐仅为1.90 mg/L,细菌的脱硫效果显著变差。从上述的结果和分析可知,菌株对有毒的硫化物有较高耐受性,耐受上限高达300 mg/L,菌株氧化无机硫化物的最适初始S2–浓度是250 mg/L,此条件下氧化S2–产生的硫酸盐浓度最大,达57.5 mg/L。
2.4.2 菌株氧化S2–产生硫酸盐的最适初始pH值
在预备试验中,将营养肉汤初始pH值先调到5、6、7、8、9,然后添加浓Na2S水溶液,S2–浓度为15000 mg/L(pH值为13.6),培养液摇匀使初始S2–浓度为250 mg/L。在肉汤初始pH值为8和9的处理组,加入S2–为250 mg/L后,再测定培养液的pH值,都大于9.2,由图6、7的研究结果已知0 h的pH大于9.14的溶液如果接种后,菌株细胞难以生长,因此最适初始pH值的研究,肉汤初始pH值定为5、6、7。加入最适初始S2–为250 mg/L,接种5%种子液,置于30℃下培养,考察0–48 h的硫酸盐浓度,由图8可知,菌株氧化S2–产生硫酸盐的最适初始pH值为7。
2.4.3 菌株氧化S2–产生硫酸盐的最适培养温度
调肉汤最适初始pH值为7、加入250 mg/L S2–和5%种子液,置于25℃、30℃、35℃下培养,检测0–48 h硫酸盐浓度。由图9可知菌株氧化S2–产生硫酸盐的最适培养温度为30℃。

图8 菌株产生硫酸盐的最适初始pH值Fig.8 The optimal initial pH value for sulfate generation of the strain.
2.5 响应面法优化菌株降解硫化物的工艺参数
响应面法 (Response surface methodology,RSM)是利用合理的试验设计,采用多元二次回归方程拟合因素与响应值之间的函数关系,解决多变量问题的一种统计方法。它可以在整个响应面区域内寻求最优实验点,是降低成本、优化加工条件的一种有效方法,在食品[24-25]、生物技术[26-27]、环境生物技术[28-30]等研究领域有广泛的应用。
本研究通过响应面法考察3个环境因素对菌株降解无机硫化物效率的影响。利用Design-expert软件,以初始S2–浓度、初始pH值、接种量%作为变量A、B、C,以48 h时的硫酸盐浓度作为响应值,按照表1的Box-Behnken响应面实验设计进行试验。各因素试验结果和模型预测值如表3所示。
对表3中的硫酸盐浓度的试验数据进行多元回归,得到回归方程式(1):

式中:A为初始S2–浓度 (mg/L),B为初始pH值,C为接种量 (%)。
对本试验所拟合的回归方程模型进行方差分析,结果见表4,模型的显著系数P<0.0001,说明回归方程极显著;模型的相关系数R2=0.9952,说明该模型能较准确地预测响应值的变化。

图9 菌株产生硫酸盐的最适培养温度Fig.9 The optimal temperature for sulfate generation of the strain.

表3 响应面法试验的实际值与预测值Table 3 Actual and predicted values of RSM test

表4 响应面试验菌株产生硫酸盐结果的方差分析Table 4 Analysis of variance for response of sulfate concentration
用该多元回归方程式得到各个因素对响应值的响应曲面图,投影在X轴的等高线可以直观地看出两个因素之间的相互影响作用,等高线形状越接近于椭圆则表示两个因素之间交互作用越强,越圆表示这两个因素的交互作用不显著。从图10可知,初始底物S2–浓度和初始pH值对菌株的氧化脱硫效果有显著的影响。
经过Design-expert软件的分析,对得到的回归方程式求一阶偏导,令其等于0后,可以得到菌株最优的降解硫化物条件,即ZJNB-B3菌株在最适初始底物S2–浓度为211.8 mg/L、初始pH值为6.72、接种量为5.04%时,菌株的氧化脱硫效果最显著,此时的硫酸盐浓度应为64.4 mg/L。
2.6 最优降解硫化物工艺参数的验证
为验证响应面法得到的模型的准确性,对菌株在上述最优的降解硫化物工艺参数下进行了3次验证试验,测定了 0−48 h的 S2–和 SO42–的浓度变化(图11),以及pH值和OD变化 (图12)。这3次试验平均实际测得菌株在48 h能够将液体中S2–浓度降为6.32 mg/L,脱硫率达97.0%,脱硫产生的SO42–的浓度为63.8 mg/L,与预测值64.4 mg/L较为接近,预测值与实际测定值两者的相对误差为0.94%,可见响应面法所拟合的多元回归方程能够比较准确地预测不同环境因素下菌株氧化降解S2–产生的稳定氧化物 SO42–的值。
对比不含有毒物S2–时菌株的生长曲线 (图4),由含有毒物S2–时图12中的OD值变化曲线可知,细菌的生长延迟期明显比图4中的0–2 h变长到0–12 h左右,12–30 h的对数生长期的增长速率也比图4变慢,不含有毒物S2–时细菌在22 h后已经达到稳定期,而含有毒物S2–时在30 h后才出现稳定期,证明211.8 mg/L的高浓度有毒物S2–的存在,对菌体的生理代谢产生了不利的影响,使蜡状芽胞杆菌ZJNB-B3细胞的生长繁殖速度变慢。
邱丽娜等从污泥中筛选出一种革兰氏阴性硫氧化菌 (是自养型SOB,但未鉴定是什么菌属),将其接种到不含碳源、加有硫粉的无机盐培养基中,调节起始pH为6置于30℃下培养,到第3天pH下降到1左右,培养到第7天pH可下降到0.6,推断该菌能氧化硫粉生成硫酸[31],可以作为生物浸出法的菌种用于浸矿或去除污泥中的重金属。

图10 环境因素对菌株产生硫酸盐影响的响应面Fig.10 Three-dimensionalsurfacefigureofthe influence of environmental factors on sulfate concentration of the strain.

图11 菌株在最适条件下硫化物和硫酸盐浓度变化Fig.11 The concentrations of sulfide and sulfate at the optimal desulfurization condition of the strain.

图12 菌株在最适脱硫条件下pH值和OD的变化Fig.12 The pH and OD values at the optimal desulfurization condition of the strain.
在我们的研究中,图12中ZJNB-B3菌株在0–48 h的pH值变化范围是8.20–7.04,在图6中,当初始 S2–浓度为 100–300 mg/L 时,菌株在 0–48 h的pH值变化范围也均在8.90–7.10,各处理组在反应结束累积硫酸盐达最高时pH值均从碱性降到中性,证明了ZJNB-B3菌株在氧化硫化物时不会产生硫酸抑制菌体的生长,此菌株可以在pH值温和的环境条件下脱硫。其在小试研究脱硫过程中表现出pH值的稳定,表明该菌有较高的工业应用价值,可以将此菌应用于禽畜屠宰加工、鱼粉饲料加工等工业生产排放的恶臭硫化氢气体的脱除处理,使用此异养菌的工业反应器如生物滴滤塔,将具有以下优点:其循环营养液不需要加入碱进行中和,降低了处理的成本;脱硫过程中pH值的稳定,可以使反应器保持稳定的脱除效率,容易操作管理,对于反应器的稳定运行具有重要的意义。本课题组正在进行此菌应用于生物滴滤塔处理禽畜屠宰加工污水处理站生产的硫化氢恶臭废气的研究,相关研究结果将另文发表。
3 结论
通过对出发菌株诱变得到一株生长快速且脱硫率高达97%的异养型脱硫细菌,基于形态学研究、生理生化鉴定、16S rRNA基因序列分析,鉴定菌株为蜡状芽胞杆菌,命名为Bacillus cereusZJNB-B3,GenBank登录号为MF679650。运用响应面法优化环境因素对菌株降解无机硫化物效率的影响,得到在最适培养温度30℃下,初始S2–浓度为211.8 mg/L、初始pH为6.72、接种量为5.04%时,菌株氧化脱硫效果最显著,实验测定硫酸盐浓度为63.8 mg/L。
脱硫菌蜡状芽胞杆菌ZJNB-B3在氧化硫化物时不会产生硫酸抑制菌体的生长,可以在pH值温和的环境条件下实现高效脱硫效果,相较于一些在氧化硫化物时会产生硫酸抑制菌体活性的自养型细菌,该菌在硫化氢气体脱除方面有更高的工业应用价值。
[1]Rappert S,Müller R.Microbial degradation of selected odorous substances.Waste Manag,2005,25(9):940–954.
[2]Syed M,Soreanu G,Falletta P,et al.Removal of hydrogen sulfide from gas streams using biological processes–A review.Can Biosyst Eng,2006,48:2.1–2.14.
[3]Chen DZ,Sun YM,Han LM,et al.A newly isolatedPseudomonas putidaS-1 strain for batch-mode-propanethiol degradation and continuous treatment of propanethiolcontainingwastegas.J HazardMater,2016,302:232–240.
[4]Chen DZ,Zhao XY,Miao XP,et al.A solid composite microbial inoculant for the simultaneous removal of volatile organic sulfide compounds: preparation,characterization, and its bioaugmentation of a biotrickling filter.J Hazard Mater,2018,342:589–596.
[5]Yin J.Biological removal of odorous gases by biofilter and microbiological mechanism[D]. Hangzhou:Zhejiang University,2004(in Chinese).殷峻.生物滤塔处理恶臭气体及微生物学机理[D].杭州:浙江大学,2004.
[6]Talaiekhozani A,Bagheri M,Goli A,et al.An overview of principles of odor production,emission,and control methods in wastewater collection and treatment systems.J Environ Manage,2016,170:186–206.
[7]Henshaw PF,Medlar D,McEwen J.Selection of a support medium for a fixed-film green sulphur bacteria reactor.Water Res,1999,33(14):3107–3110.
[8]Rappert S,Müller R.Odor compounds in waste gas emissions from agricultural operations and food industries.Waste Manag,2005,25(9):887–907.
[9]Chen JY.Influence of slaughtering and meat product processing industry on the environmentand the countermeasures to pollution.J Meteor Environ,2006,22(5):59–61(in Chinese).陈金宇.肉类屠宰加工行业对环境的主要影响及污染防治对策.气象与环境学报,2006,22(5):59–61.
[10]Qian DS,Fang JY,Chen DZ,et al.Removal of hydrogen sulfide by plate type-biotrickling filter.Environ Sci,2011,32(9):2786–2793(in Chinese).钱东升,房俊逸,陈东之,等.板式生物滴滤塔高效净化硫化氢废气的研究.环境科学,2011,32(9):2786–2793.
[11]Burgess JE,Parsons SA,Stuetz RM.Developments in odour control and waste gas treatment biotechnology:a review.BiotechnolAdv,2001,19(1):35–63.
[12]Hu HP,Luo G,Liu J,et al.Study of biological techniques to the deodorization of odor.Energ Environ Prot,2006,20(5):1–4(in Chinese).胡和平,罗刚,刘军,等.生物技术在恶臭气体处理中的应用研究.能源环境保护,2006,20(5):1–4.
[13]Chung YC,Huang C,Tseng CP.Operation optimization ofThiobacillus thioparusCH11 biofilter for hydrogen sulfide removal.J Biotechnol,1996,52(1):31–38.
[14]Lee EY,Cho KS,Ryu HW.Simultaneous removal of H2S and NH3in biofilter inoculated withAcidithiobacillus thiooxidansTAS.J Biosci Bioeng,2005,99(6):611–615.
[15]Yao CZ,Zhang KQ,Ji M,et al.Use ofThiobacillus thioparusfor enhanced treatment of sulfur containing wastewater.China Water Wastewater,2004,20(2):57–59(in Chinese).姚传忠,张克强,季明,等.排硫硫杆菌生物强化处理含硫废水.中国给水排水,2004,20(2):57–59.
[16]Wang F,Li SQ,Xu JG.Cultivation of desulfurizingbacteria and the study of degrading capability of sulfide.J NortheastAgric Univ,2004,35(1):21–24(in Chinese).王帆,李淑芹,许景钢.脱硫菌的培养驯化与降解硫化物性能的研究.东北农业大学学报,2004,35(1):21–24.
[17]Wu YG,Ren HQ,Ding LL,et al.Study on the start-up of an innovative polyethylene carrier biotrickling filter treating waste gas containing hydrogen sulphide.Environ Sci,2006,27(12):2396–2400(in Chinese).伍永钢,任洪强,丁丽丽,等.新型聚乙烯填料生物滴滤床净化硫化氢气体的启动研究.环境科学,2006,27(12):2396–2400.
[18]Yang X,Lou YJ,Yan XJ.Study on the malodorous gas in fish meal processing removal by DBD technique.J Nucl Agric Sci,2016,30(11):2180–2188(in Chinese).杨贤,娄永江,严小军.DBD技术处理鱼粉厂恶臭气体的研究.核农学报,2016,30(11):2180–2188.
[19]Zhuang RY,Lou YJ,Qiu XT,et al.Identification of a yeast strain able to oxidize and remove sulfide high efficiently.Appl Microbiol Biotechnol,2017,101(1):391–400.
[20]Sun PX,Lou YJ,Zhuang RY,et al.Isolation and identification of a bacteria strain for desulfurization of hydrogen sulfide from feed-fishmeal processing.Chin J Environ Eng,2015,9(9):4465–4470(in Chinese).孙佩璇,娄永江,庄荣玉,等.一株鱼粉加工硫化氢恶臭气体脱除菌株的分离与鉴定.环境工程学报,2015,9(9):4465–4470.
[21]Wang HX,Jiang LY,Wu XW,etal.Isolation,identification and degradation characteristics of a sulfideoxidizing bacterium.Chin J Appl Environ Biol,2011,17(5):706–710(in Chinese).王惠祥,姜理英,吴晓薇,等.硫氧化细菌的分离鉴定及降解特性.应用与环境生物学报,2011,17(5):706–710.
[22]Wang SF.The oxidative detoxification and metabolic adaptation ofUrechis unicinctusto sulfide[D].Qingdao:Ocean University of China,2006(in Chinese).王思锋.单环刺螠(Urechis unicinctus)对硫化物的氧化解毒及代谢适应[D].青岛:中国海洋大学,2006.
[23]Powell E.Oxygen,sulfide and diffusion:why thiobiotic meiofauna must be sulfide-insensitive first-order respirers.J Mar Res,1989,47(4):887–932.
[24]Yang WX,Gao YX.Response surface methodology&its application in food industry.China Food Addit,2005(2):68–71(in Chinese).杨文雄,高彦祥.响应面法及其在食品工业中的应用.中国食品添加剂,2005(2):68–71.
[25]Sun LJ,Liang JZ.Optimization of chelation of soybean peptides with calcium using response surface method.J Chin Cereals OilsAssoc,2010,25(1):22–27(in Chinese).孙莉洁,梁金钟.响应面法优化大豆肽与钙离子螯合的研究.中国粮油学报,2010,25(1):22–27.
[26]LiuHB,ZhangW,ChenYT,etal.Technology optimization ofMedicago sativaleaf protein separation with foam fractionation.Trans Chin Soc Agric Eng,2016,32(9):271–276.刘海彬,张炜,陈元涛,等.泡沫法分离苜蓿叶蛋白工艺优化(英文).农业工程学报,2016,32(9):271–276.
[27]Zheng J,Guo J,Wang YJ,et al.Isolation of a methaneutilizingKlebsiellasp.strain and its application for detecting methane.Chin J Biotech,2009,25(5):695–700(in Chinese).郑军,郭珺,王玉军,等.一株可利用甲烷的克雷伯氏菌的分离及其在甲烷检测中的应用.生物工程学报,2009,25(5):695–700.
[28]Cheng ZW,Chen JM,Yu JM,etal.Structural characterization and property analysis of surface-active substance accumulated during biodegradation of hydrophobic α-pinene byPseudomonasfluorescens.WaterAir Soil Pollut,2013,224:1457.
[29]Cheng ZW,Gu XN,Jiang YF,et al.Isolation and identification of an alpha-pinene-degrading bacterium and its degradation characteristics.Chin Environ Sci,2011,31(4):622–630(in Chinese).成卓韦,顾信娜,蒋轶锋,等.一株α-蒎烯降解菌的分离鉴定及降解特性研究.中国环境科学,2011,31(4):622–630.
[30]Yan L,Liu Q,Zhang S,et al.Response surface optimization for hydrogen sulfide removal using fermentation broth produced byAcidithiobacillus ferrooxidans.Biotechnology,2012,22(6):86–88(inChinese).晏磊,刘权,张爽,等.响应面法对Acidithiobacillus ferrooxidans发酵液脱除H2S的优化研究.生物技术,2012,22(6):86–88.
[31]Qiu LN,LiYY,GongAJ,etal.Isolation and characterization of a sulfur-oxidizing bacterium.J Univ Sci Tech Beijing,2007,29(S2):212–215(in Chinese).邱丽娜,李圆原,弓爱君,等.一株硫氧化菌的筛选与表征.北京科技大学学报,2007,29(增刊2):212–215.

