体外培养鸽嗉囊组织形态学、酶活力及基因表达动态变化规律
万雪萍,谢 鹏,卜 柱,汤青萍,邹晓庭*
(1.浙江大学动物科学学院,浙江省饲料与动物营养重点实验室,农业部(华东)动物营养与饲料重点实验室,浙江大学动物分子营养学教育部重点实验室,浙江杭州 310058;2.中国农业科学院家禽研究所,江苏扬州 225125;3.淮阴师范学院生命科学学院,江苏淮安 223001)
嗉囊是鸟类储存和软化食物的重要场所,同时也是抵御病原体入侵的功能性屏障,在鸟类先天免疫系统调节中扮演重要角色[1]。不同于其他家禽,鸽嗉囊还具有类似于哺乳动物乳腺的“泌乳”功能。在育雏期,嗉囊受催乳素作用,上皮细胞积聚营养物质并发生角质化,最终脱落形成“鸽乳”[2]。作为理想的实验靶器官,近十年来鸽嗉囊已在流行病学、组织生理学及禽类营养与分子育种等领域得到广泛研究,然而大多数研究主要集中于体内试验,体外试验鲜有报道[3-4]。与动物体内试验相比,体外试验具有试验周期短、成本低、环境因子可控等优点[5],其中,组织培养技术可以较好地模拟体内的环境状态和营养物质交换情况,有利于从整体水平评估外界因素对靶器官的影响[6]。研究人员已成功运用组织体外培养技术完成对犊牛睾丸、鸽小肠等组织的体外培养,并且通过检测体外培养组织形态学和酶活指标的变化探索出最佳的体外给药时间[7-8]。目前,国内外关于鸽嗉囊组织体外培养尚未见报道,其在离体培养条件下的动态变化规律有待于揭示。鉴于此,本研究采集鸽嗉囊组织进行体外培养,检测体外培养0~7 d鸽嗉囊组织形态学、Caspase-3酶、琥珀酸脱氢酶、Na+-K+-ATP酶、Ca2+- Mg2+-ATP酶和总ATP酶活力及Bcl-2、Bak1和角蛋白19(CK-19)基因表达的变化,旨在揭示体外培养环境下鸽嗉囊组织活性变化规律,并探索其体外培养的适宜时间,为今后开展以鸽嗉囊为载体的营养学、生理学及病理学等体外试验研究奠定基础。
1 材料与方法
1.1 试验材料
1.1.1 样本来源 60周龄健康哺育期美国王鸽,采集嗉囊组织。试验动物购自江阴市威特凯鸽业有限公司。
1.1.2 主要试剂 胎牛血清、DMEM/F-12和青链霉素均购自美国Gibco公司,牛胰岛素、皮质醇和表皮生长因子均购自美国Sigma公司,PBS缓冲液、4%多聚甲醛、无水乙醇、95%乙醇、伊红、苏木紫、中性树脂、二甲苯均购自中国北京索莱宝科技有限公司,Caspase-3酶、琥珀酸脱氢酶(SDH)及ATP酶(Na+-K+-ATP酶、Ca2+-Mg2+-ATP酶以及总ATP酶)活性测定试剂盒均购自南京建成生物工程研究所,琼脂糖和Trizol裂解液购自美国Invitrogen公司,ReverTra Ace®反转录试剂盒购自日本TOYOBO公司,SYBR Premix Ex TaqTMⅡ购自中国大连宝生物工程有限公司。
1.1.3 仪器与设备 Galaxy 系列二氧化碳培养箱(英国RS Biotech 公司),SW-CJ-1FD型超净工作台(苏州安泰空气技术有限公司),高压灭菌锅(ZDX-35BI型,座式自动电热压力蒸汽灭菌器),一次性培养瓶(Costar,美国),切片机(Leica,德国),光学显微镜(尼康,日本),Mx3000P荧光定量PCR仪,分光光度计(UV-2000,Unico,Instruments,上海,中国),Champ GelTM 5000 型凝胶成像系统(Vilber,法国),ND-1000核酸/蛋白浓度测定仪(Wilmington,美国)。
1.2 试验方法
1.2.1 嗉囊组织分离培养 取60周龄哺育期美国王鸽4只,采集嗉囊组织,PBS冲洗,放入组织清洗液(500 mL PBS+5 mL 100 U/mL青链霉素)低温带入无菌操作室。在超净工作台中用组织清洗液冲刷嗉囊样本3遍,随后放入组织浸泡液(40 mL PBS+2 mL 100 U/mL青链霉素)中浸泡20 min,浸泡完毕后,移入组织清洗液中冲洗3遍。剥离脂肪、结缔组织及表皮组织,将剩余组织剪成2~3 mm3大小,均匀接种于培养瓶中,加入5 mL培养液(DMEM/F12+5%胎牛血清+100 U/mL青链霉素+0.5 μg/mL皮质醇+10 ng/mL表皮生长因子+5 μg/mL牛胰岛素),于37℃、5%CO2细胞培养箱中连续培养7 d,间隔24 h更换1次培养液。于培养第0、1、2、3、4、5、6、7天收集组织块进行形态学、酶活力及基因表达检测。
1.2.2 组织形态学观察 取嗉囊组织放置4%多聚甲醛中固定24 h后,采用常规方法脱水、透明、浸蜡、包埋、切片、苏木精-伊红染色、透明、封片、光学显微镜观察并采集图像。
1.2.3 组织酶活力测定 采用酶活测定试剂盒检测组织Caspase-3、琥珀酸脱氢酶(SDH)及ATP酶(Na+-K+-ATP酶、Ca2+-Mg2+-ATP 酶以及总ATP酶)活力。试剂配制和试验操作遵照公司说明书进行。本试验通过计算试验组OD405nm/阴性对照组OD405nm来确定Caspase-3的活化程度。
1.2.4 荧光定量PCR反应检测Bcl-2、Bak 1和CK-19基因表达 用Trizol法抽提各时间点组织块总RNA并检测其浓度、纯度以及完整性。取2 μg RNA反转录制备cDNA模板,构建荧光定量PCR体系(20 μL)。反应条件:95℃变性30 s,95℃退火10 s,60℃延伸30 s,共40个循环。参照GenBank数据库中鸽基因序列,利用Primer Premier 5.0和Oligo 6.0软件设计荧光定量PCR引物,引物信息见表1。以β-actin基因为内参,并以 2-ΔΔCt法进行数据分析。
1.3 统计分析 本试验中所有数据均采用SPSS 20.0 软件的One-Way ANOVA进行统计分析,结果以平均值±标准误表示。P<0.05表示为差异有统计学意义。
2 结 果
2.1 鸽嗉囊组织体外培养0~7 d形态学观察 如图1所示,体外培养第0~4天,鸽嗉囊组织层次结构清晰,上皮基层和棘层细胞胞质增多,细胞核染色逐渐变浅,细胞排列紧密,上皮浅层结构完整(图1a~e)。体外培养5 d后,嗉囊组织层次结构逐渐模糊,上皮基层和棘层细胞排列逐渐松散,上皮浅层出现凋落。体外培养7 d,嗉囊上皮基层和棘层细胞呈零散分布,嗉囊组织正常形态结构基本消失(图1f~h)。

表1 荧光定量PCR反应引物序列
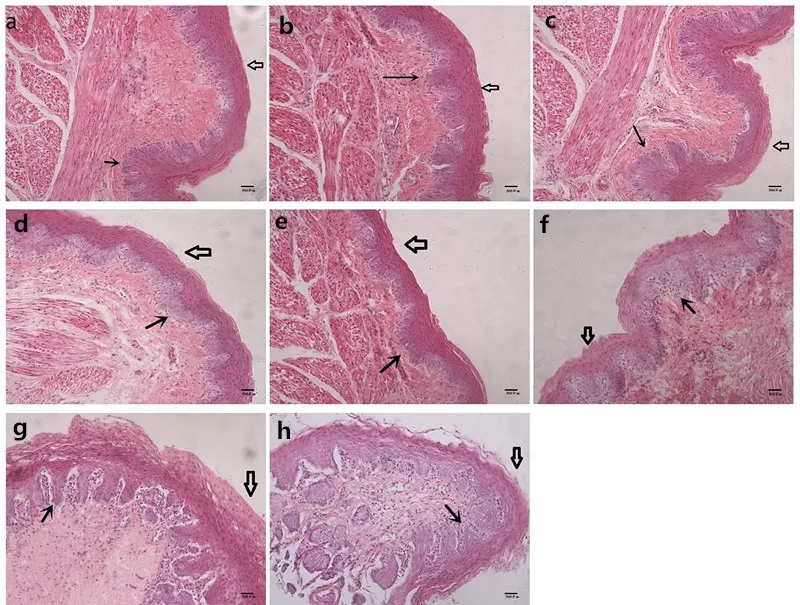
图1 鸽嗉囊组织体外培养0~7 d形态学观察(20×,标尺为 500 μm)
2.2 鸽嗉囊组织体外培养0~7 d酶活力检测 如表2所示,鸽嗉囊组织Caspase-3酶活性于培养第1天显著升高至峰值(P<0.05),随后于培养第2~4天维持稳定水平,体外培养5 d后其活性显著升高(P<0.05)。SDH酶、Na+-K+-ATP酶、Ca2+-Mg2+-ATP酶及总ATP酶活性均于体外培养第1天显著降低随后显著提高(P<0.05)。SDH酶活力于培养第2~4天显著高于培养第5~7天(P<0.05)。Na+-K+-ATP 酶以及 Ca2+-Mg2+-ATP酶均于体外培养第2~4天维持较高活性,随后于体外培养第7天降至最低水平(P<0.05)。总ATP酶活性于体外培养第3天显著升高至峰值,于培养第5~7天活性显著受抑制(P<0.05)。
2.3 鸽嗉囊组织体外培养0~7 dBcl-2、Bak1和CK-19基因表达变化 由表3可知,鸽嗉囊组织Bcl-2和CK-19基因表达均于体外培养第1 天显著下调(P<0.05)。随后,Bcl-2基因表达于体外培养第2~4天显著升高(P<0.05),于体外培养5 d后显著降低(P<0.05)。CK-19基因表达于体外培养第4天升高至峰值,随后于体外培养第6~7天显著降低(P<0.05)。鸽嗉囊组织Bak1基因于体外培养第1天表达显著上调(P<0.05),随后稳定至体外培养第5天(P>0.05),并于培养第6~7天其表达再次显著上调(P<0.05)。
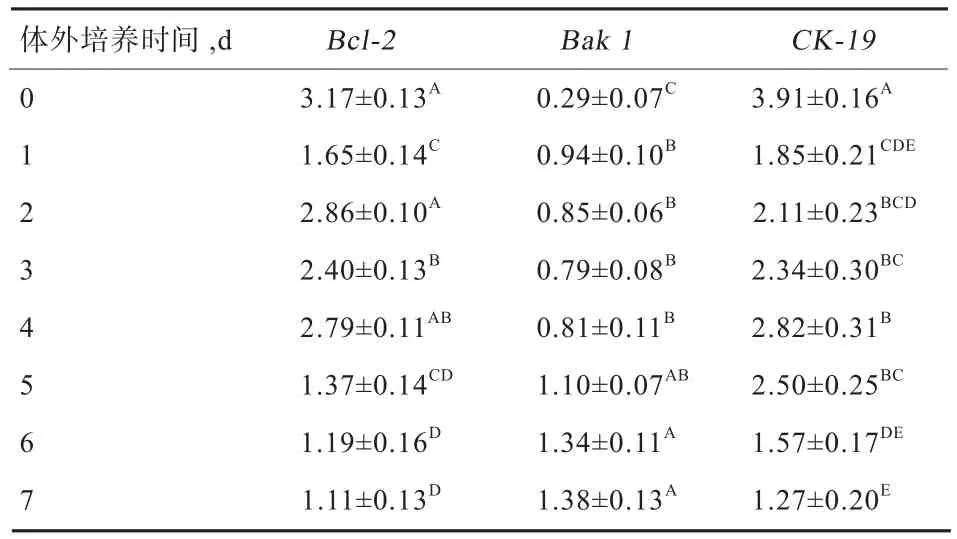
表 3 体外培养0~7 d鸽嗉囊组织基因表达变化(n=3)
3 讨 论
组织体外培养能够在原生基质中维持细胞的活性,并保留细胞与细胞及细胞与基质间的相互作用,从而为观察组织在外界刺激下的形态学变化、内环境因子调控过程等创造了良好的试验技术手段[9]。本研究以体外培养鸽嗉囊组织为基础,动态检测了离体条件下组织的形态学、酶活力及基因表达变化。与前人报道的体内试验结果类似[10],本试验中,体外培养前期(体外培养1~4 d)鸽嗉囊组织上皮层结构完整且细胞胞质逐渐增多,表明鸽嗉囊组织细胞在离体培养条件下仍维持细胞增殖的活性,且具有合成胞内物质的能力。体外培养5 d后鸽嗉囊组织结构迅速崩解,可能是由于部分细胞死亡导致。
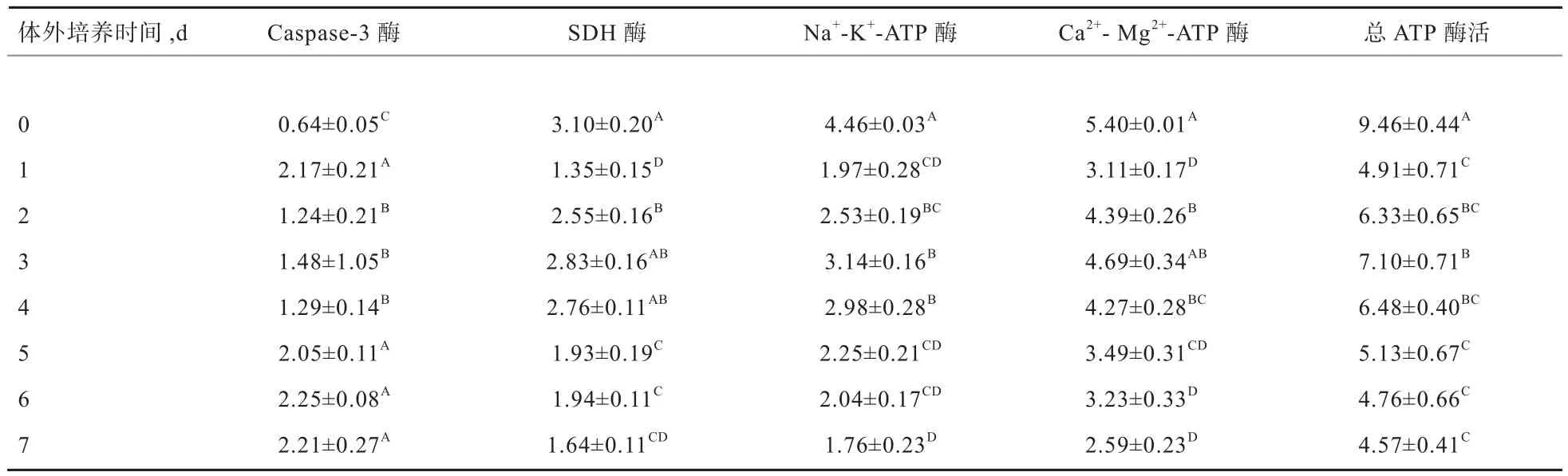
表2 体外培养0~7 d鸽嗉囊组织酶活力变化(n=3) U/mg pro
Caspase-3是调控细胞凋亡的关键酶,在各种因素启动的凋亡程序中起着枢纽作用。体外培养细胞促凋亡试验过程中,Caspase-3酶活力显著增加[11]。本试验中,Caspase-3酶活力于培养第1天显著升高至峰值,于体外培养5 d后酶活再次显著升高,由此推测鸽嗉囊组织进入体外培养系统时可能经历了一段时间的适应过程,并且组织于体外培养后期可能处于细胞凋亡活跃阶段。SDH为线粒体电子传递系统的一种三羧酸循环酶,是反映线粒体功能的标志酶之一。在动物受损组织中,SDH活力显著受抑制[12]。本研究中,鸽嗉囊组织SDH活力于体外培养第5~7天显著低于培养第2~4天,推测体外培养的鸽嗉囊组织代谢活动于4 d后显著受抑制。ATP酶是衡量细胞生理状况的重要指标,其主要功能是水解ATP、释放能量、离子运输等。机体的ATP酶主要分为Na+-K+-ATP酶和Ca2+-Mg2+-ATP酶2种。Na+-K+-ATP酶维持着细胞膜两侧的膜电位,调节细胞渗透压,为营养物质的吸收提供动力;Ca2+-Mg2+-ATP酶活性变化影响细胞的分泌与增殖。钙离子平衡失调的体外培养系统中,Na+-K+-ATP酶和Ca2+-Mg2+-ATP酶均显著下调[13]。本试验中,Na+-K+-ATP酶、Ca2+-Mg2+-ATP酶及总ATP酶活力在体外培养第1天均显著降低,随后均于培养2~4 d维持于高酶活水平,并于体外培养5~7 d再次显著下降,笔者推测,体外培养鸽嗉囊组织在进入体外环境时其细胞膜经历了离子转运稳态的失调,随后恢复较好的稳态并维持至培养第4天,培养5 d后内环境稳态再次失衡。本试验中,离体培养鸽嗉囊组织ATP酶活力变化与其形态学改变趋势相吻合,这可能是由于ATP酶活力的变化影响了细胞能量代谢及细胞膜内外离子平衡过程,导致细胞的形态结构和生理功能的改变。
Bcl-2家族通过维持线粒体膜的稳定性来影响细胞内源性凋亡,其家族成员根据功能一般可分为抗凋亡(如Bcl-2、Bcl-xl)和促凋亡(如 Bax、Bak)2类[14]。本试验中体外培养鸽嗉囊组织Bcl-2基因表达于培养第1、5、6、7天显著低于其他时间,Bak1基因表达随培养时间呈上调趋势,结合形态学及Caspase-3酶活变化规律,研究结果进一步表明体外培养4 d后鸽嗉囊组织细胞凋亡过程显著加快。细胞角蛋白(CKs)是上皮类细胞重要的标志,角蛋白在鸽嗉囊角质化产乳过程中具有重要作用[15]。本试验中,CK-19基因于体外培养第2~4天显著上调,随后于体外培养6~7 d显著下调,这可能与嗉囊上皮细胞增殖及角质化过程有关[2]。
4 结 论
体外培养鸽嗉囊组织的形态学、Caspase-3酶、琥珀酸脱氢酶、Na+-K+-ATP酶、Ca2+-Mg2+- ATP酶和总ATP酶活力及Bcl-2、Bak1和CK-19基因表达随培养时间延长呈现规律性变化。本试验条件下,鸽嗉囊组织体外培养活性的最佳时间为4 d。
参考文献:
[1] Kierończyk B, Rawski M, Długosz J,et al. Avian crop function-a review[J]. Ann Anim Sci, 2016, 16(3): 653-678.
[2] 梁勇, 姜庆林, 陈益填, 等. 鸽乳成分及其分泌机制研究进展[J]. 中国家禽, 2016, 38(20): 47-51.
[3] Rosario I, Soro G, Deniz S,et al. Presence of C. albidus, C.laurentii and C. uniguttulatus in crop and droppings of pigeon lofts (Columba livia)[J]. Mycopathologia, 2010, 169(4): 315-319.
[4] 张晓昀, 董信阳, 卜星晨, 等. 2~10 日龄鸽乳中活性成分变化的规律研究[J]. 中国畜牧杂志, 2016, 52(11): 39-42.
[5] 贾琦珍, 岳耀锋, 陈根元, 等. 和田羊大脑皮质神经细胞体外培养及鉴定[J]. 中国畜牧杂志, 2016, 52(17): 33-36.
[6] Hahn J, Wickham S F J, Shih W M,et al. Addressing the instability of DNA nanostructures in tissue culture[J]. Acs Nano, 2014, 8(9): 8765-8775.
[7] 郑鹏, 于磊, 田亚光, 等. 犊牛睾丸组织培养及 PGP 9.5 基因的检测[J]. 中国畜牧杂志, 2010, 46(15): 22-24.
[8] Xie P, Zhang A T, Wang C,et al. Molecular cloning,characterization, and expression analysis of fatty acid translocase (FAT/CD36) in the pigeon (Columba liviadomestica)[J]. Poult Sci, 2012, 91(7): 1670-1679.
[9] Seol D, Yu Y, Choe H,et al.Effect of short-term enzymatic treatment on cell migration and cartilage regeneration: in vitro organ culture of bovine articular cartilage[J]. Tissue Eng Part A,2014, 20(13-14): 1807-1814.
[10] Gillespie M J, Haring V R, McColl K A,et al. Histological and global gene expression analysis of the'lactating'pigeon crop[J].BMC Genomics, 2011, 12(1): 452.
[11] Liu J, Mao J, Jiang Y,et al. AGEs induce apoptosis in rat osteoblast cells by activating the caspase-3 signaling pathway under a high-glucose environment in vitro[J]. Appl Biochem Biotech, 2016, 178(5): 1015-1027.
[12] Zhuang Y, Liu P, Wang L,et al. Mitochondrial oxidative stressinduced hepatocyte apoptosis reflects increased molybdenum intake in caprine[J]. Biol Trace Elem Res, 2016, 170(1): 106-114.
[13] 袁燕, 江辰阳, 孙娅,等. 镉对体外培养大鼠大脑皮质神经元钙稳态的影响[J]. 中国兽医学报, 2013, 33(3): 450-453.
[14] 尹智勇, 杨俊元, 祁宏. Bcl-2蛋白质家族调控细胞凋亡机制的研究进展[J]. 信阳师范学院学报: 自然科学版, 2017,30(2): 340-344.
[15] Gillespie M J, Crowley T M, Haring V R,et al. Transcriptome analysis of pigeon milk production–role of cornification and triglyceride synthesis genes[J]. BMC Genomics, 2013, 14(1):169.

