初情期启动过程中小尾寒羊下丘脑GnRH基因甲基化状态及表达量关系研究
丁 赫 ,宫永胜,王 军,吕文发
(吉林农业大学动物科技学院,吉林省反刍动物繁育生物技术与健康养殖工程实验室,吉林长春 130118)
初情期是指雌性动物初次发情并排出卵子的过程,是动物获得繁殖能力的标志,其启动时间的早晚影响着养羊业的经济效益[1-2]。下丘脑-垂体-性腺(Hypothalamic-Pituitary-Gonadal,HPG)轴在初情期启动过程中具有重要的作用,下丘脑促性腺激素释放激素(Gonadotropin-releasing Hormone,GnRH)脉冲式释放,调节垂体促卵泡素和促黄体素的分泌,最终实现初情期的启动[3-4]。初情期启动的机制复杂,主要与环境、表观遗传机制等密切相关。DNA甲基化是目前研究较多的一种表观遗传修饰方式,多发生在富含CpG岛和CpG位点区域,启动子区甲基化状态影响着基因的转录[5-7]。有研究表明,DNA甲基化升高可抑制基因的表达[8-9],在初情期启动过程中DNA甲基化改变可能影响下丘脑中的特定基因的表达,从而调节初情期的启动[10-11]。本实验利用亚硫酸氢盐测序(Bisulfite Sequencing PCR,BSP)技术研究了GnRH启动子区富含CpG岛和CpG位点的1 000 bp区域的甲基化状态,通过实时荧光定量PCR(qRT-PCR)技术研究了GnRHmRNA表达量,并分析初情期启动过程中小尾寒羊下丘脑GnRH基因表达与其启动子区甲基化状态的关系。
1 材料与方法
1.1 样品采集与保存 采集初情期前(90日龄)、临近初情期(120日龄)、初情期(130日龄)小尾寒羊的下丘脑组织,每个阶段选取小尾寒羊3只,采集的下丘脑样本为前端止于视交叉,后端止于乳头体,样品采集做好标记后,放入液氮中保存,待取样结束全部置入-80℃冰箱中保存。
1.2 BSP测序 取组织样品,利用DNA提取试剂盒(天根生化科技有限公司,中国)按说明书操作进行基因组DNA提取,1.0%琼脂糖凝胶电泳检测,用NAS-99测定样品中DNA浓度。随后根据样品浓度,抽取500 μg DNA进行DNA亚硫酸氢盐修饰,根据试剂盒EZ DNA Methylation-Gold Kit(ZYMO公司catlog D5006)进行具体操作。在Ensembl(http://asia.ensembl.org/index.html)上查找并下载GnRH启动子序列,将序列在在线引物设计软件methprimer(http://www.urogene.org/cgi-bin/methprimer/methprimer.cgi) 中转化为亚硫酸氢盐修饰后的序列,利用软件Primer5设计GnRH启动子甲基化位点扩增引物,引物序列送至北京优博兰基因技术有限公司进行合成,引物信息见表1。PCR扩增体系半巢式第1轮:1 μL修饰后DNA模板,1 μLGnRH-F(10 μmol/L),1 μLGnRH-OR(10 μmol/L),0.5 μL dNTP(10 mmol/L),1 μL Mg2+(50 mmol/L),2.5 μL 10×PCR Buffer,0.1 μL Taq酶,ddH2O至25 μL。半巢式第2轮:1 μL 第 1 轮 PCR 产物,1 μLGnRH-F(10 μmol/L),1 μLGnRH-R(10 μmol/L),0.5 μL dNTP(10 mmol/L),1 μL Mg2+(50 mmol/L),2.5 μL 10×PCR Buffer,0.1 μL Taq酶,ddH2O至25 μL,使用Taq酶Platinum®Taq DNA Polymerase, High Fidelity(Thermocatlog11304-029)进行扩增。半巢式第1轮扩增程序:94℃ 2 min,94℃ 30 s、57℃ 30 s、72℃ 40 s、30个 循 环,72℃延伸5 min。半巢式第2轮扩增程序为:94℃ 2 min,94℃ 30 s、60℃ 降 到 53℃( 每 个 循 环 降 1℃)30 s、72℃ 30 s、7 个循环,94℃ 30 s、50℃ 30 s、72℃ 30 s、33个循环,72℃延伸5 min。PCR产物经2%琼脂糖检测后,切胶,使用DNA纯化回收试剂盒(天根生化科技有限公司,DP209-03)纯化产物。利用P-Easy T1 Cloning载体连接试剂盒(北京全式金生物技术有限公司CT101-02)进行连接转化。利用试剂盒(Omega bio-tek,美国)提取质粒,将质粒每段序列至少选择10个,送至北京优博兰基因技术有限公司进行测序,利用BiQ Analyzer对测序结果进行整理并分析甲基化状态,每个基因甲基化程度以所测得的CpG位点的甲基化数占所测的甲基化位点总数的百分率表示。
1.3 实时荧光定量PCR检测 采用Trizol法提取下丘脑组织的总RNA,取冷冻保存的下丘脑,提取脑组织总RNA进行反转录为cDNA,用于实时荧光定量PCR实验, 根据TaKaRa的反转录试剂盒要求,利用RNA的OD值计算反转20 μL的cDNA所需的RNA量。本实验所需的GnRH基因引物序列见表2。引物序列利用Prime 5.0自行设计,由上海生工生物技术有限公司合成,并利用PCR仪进行引物验证,摸索引物的最适反应条件。利用荧光定量PCR仪对初情期前、临近初情期和初情期母羊下丘脑中GnRH基因进行定量分析,反应体系:SYBR Premix Ex Taq Ⅱ 10 μL、Forward primer 0.8 μL、Reverse primer 0.8 μL、ROX reference DyeⅡ 0.4 μL、cDNA 2 μL、ddH2O 至 20 μL。反应条件:95℃ 预变性 30 s;95℃ 变性 5 s,40 个循环;57℃ 退火34 s,扩增40个循环;95℃ 变性15 s,57℃ 退火60 s,95℃ 变性 15 s。
1.4 统计分析 采用SPSS17.5 软件进行χ2检验比较组间差异性,数据用平均值±标准差表示,P<0.05表示差异具有统计学意义。
2 结果与分析
2.1 初情期启动过程中甲基化状态 利用BiQ Analyzer对测序结果进行整理分析,得到GnRH启动子区靠近第1外显子1 000 bp内4个CpG位点甲基化状态结果,将得到的结果绘制成空点图(图1-A)和柱状图(图1-B)。结果表明,在初情期前到临近初情期,甲基化状态变化不明显(P>0.05);当到达初情期时,GnRH启动子所检测区域总体甲基化水平呈降低趋势,初情期甲基化水平达33.33%,与初情期前差异极显著(P<0.01)。随着初情期的到来,在GnRH启动子区-570位点,甲基化程度显著降低(P<0.01)。这些结果表明,初情期启动过程中GnRH启动子区特定位点的甲基化水平显著降低。

表1 甲基化位点扩增引物序列

表2 基因引物合成情况
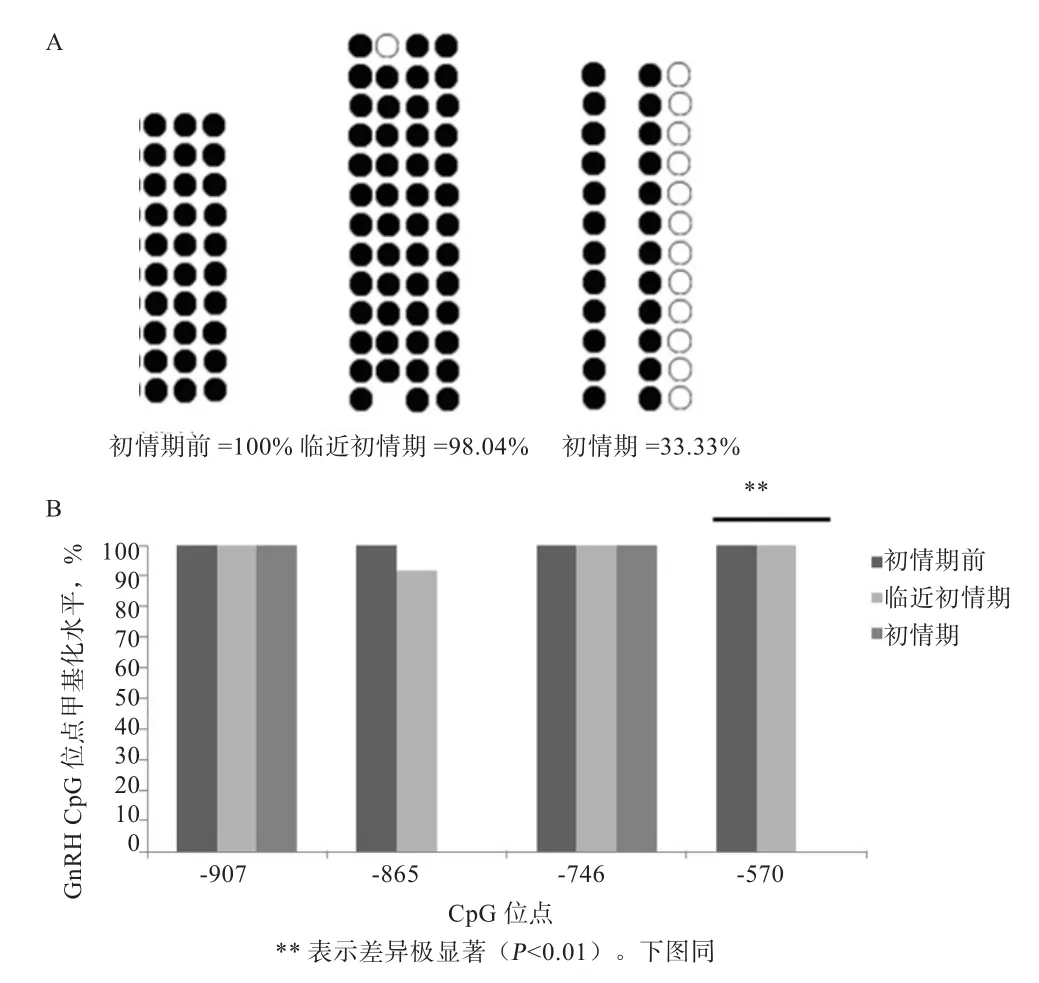
图 1 GnRH 基因启动子区域甲基化状态
2.2 初情期启动过程GnRH基因表达量 如图2所示,熔解曲线呈单一峰值,且峰尖而窄,未出现杂峰,说明扩增较好。由图3可知,随着初情期的启动,GnRHmRNA表达量在下丘脑中呈上升趋势,GnRH在初情期的 mRNA表达量与其余2个时期差异极显著(P<0.01)。结合GnRH甲基化结果发现,随着初情期的到来,GnRH甲基化呈降低趋势,并伴随着GnRHmRNA表达量升高。

图2 GnRH的熔解曲线
3 讨 论

图3 GnRH的mRNA表达量
近年来,研究甲基化与基因表达量关系的报道越来越多。启动子区CpG位点甲基化可抑制转录因子与启动子的结合,从而抑制基因的表达。CpG位点可以通过改变甲基化状态调节基因转录[7,12-13]。Lomniczi等[14]向雌性小鼠注射DNA甲基化酶抑制剂(5-AZA),发现实验组阴道口开启的时间较对照组显著延迟,同时延迟了卵巢的成熟,说明向雌性小鼠体内注射5-AZA抑制甲基化时,初情期启动受到抑制。而Terasawa等[15]研究猕猴GnRH神经元细胞成熟过程中表观遗传学的变化,发现mRNA表达量上升的同时GnRH基因5'端CpG岛甲基化呈降低趋势。同样,Kurian等[16]通过体外培养GnRH神经元发现,在体外成熟的过程中GnRHmRNA表达量显著上升,同时GnRH5'端14个CpG位点中有8个位点甲基化水平显著下降。GnRH甲基化状态与mRNA表达量变化趋势与本研究结果一致。通过利用免疫荧光双标记技术研究发现,甲基化CpG结合蛋白(MeCP2)和GnRH在母羊下丘脑视前区和弓状核中存在共表达,且共表达阳性细胞数在初情期显著高于初情期前和临近初情期,说明DNA甲基化对GnRH表达可能存在一定的影响[17]。最近宫永胜研究发现,DNA甲基转移酶 1(Dnmt 1)和GnRH在下丘脑视前区和弓状核均有表达,同样呈现共表达模式(未发表数据)。这些研究进一步说明了GnRH甲基化程度可能会影响着GnRHmRNA表达量,最终影响母羊初情期的启动。
本研究对初情期启动过程中小尾寒羊下丘脑GnRH表达量变化与其启动子区甲基化状态相关性进行了初步研究,其对初情期启动的作用机制尚需进一步研究。
母羊初情期启动过程中GnRH表达调控机制目前尚不清楚,DNA甲基化作为一种重要的基因表达调控方式,可能通过影响GnRH表达来调控母羊初情期的启动。本研究结果显示,随着小尾寒羊初情期的启动,GnRH基因mRNA表达量呈上升趋势,同时GnRH启动子区甲基化水平降低,由此可知小尾寒羊下丘脑中GnRH甲基化状态与其基因表达量及初情期启动有一定的关系。
参考文献:
[1] 田园, 宋敏, 方富贵. 动物初情期表观遗传调控的研究进展[J]. 家畜生态学报, 2015(4): 6-9.
[2] 邢凤, 廖秋萍. 哺乳动物初情期启动相关基因研究进展[J].家畜生态学报, 2017(7): 1-4.
[3] Zeydabadi Nejad S, Ramezani Tehrani F, Zadeh-Vakili A. The role of kisspeptin in female reproduction[J]. Int J Endocrinol Metab, 2017, 15(3): e44337.
[4] Thompson I R, Kaiser U B. GnRH pulse frequency-dependent differential regulation of LH and FSH gene expression[J]. Mol Cell Endocrinol, 2014, 385(1-2): 28-35.
[5] 李晓雨, 刘秋月, 胡文萍, 等. DNA甲基化调控动物季节性行为和繁殖的研究进展[J]. 家畜生态学报, 2016(12): 1-5,12.
[6] Bird A. DNA methylation patterns and epigenetic memory[J].Genes Dev, 2002, 16(1): 6-21.
[7] Nabel C S, Kohli R M. Molecular biology. Demystifying DNA demethylation[J]. Science, 2011, 333(6047): 1229-1230.
[8] Chen Z, Luo J, Zhang C,et al. Mechanism of prolactin inhibition of miR-135b via methylation in goat mammary epithelial cells[J]. J Cell Physiol, 2018, 233(1): 651-662.
[9] Qiang M, Denny A, Chen J,et al. The site specific demethylation in the 5'-regulatory area of NMDA receptor 2B subunit gene associated with CIE-induced up-regulation of transcription[J]. PLoS One, 2010, 5(1): e8798.
[10] Lomniczi A, Wright H, Ojeda S R. Epigenetic regulation of female puberty[J]. Front Neuroendocrinol, 2015, 36: 90-107.
[11] Yang C, Ye J, Li X,et al. DNA methylation patterns in the hypothalamus of female pubertal goats[J]. PLoS One, 2016,11(10): e0165327.
[12] Ito S, Shen L, Dai Q,et al. Tet proteins can convert 5-methylcytosine to 5-formylcytosine and 5-carboxylcytosine[J]. Science,2011, 333(6047): 1300-1303.
[13] Nagaaju G P, El-Rayes B F. SPARC and DNA methylation:possible diagnostic and therapeutic implications in gastrointestinal cancers[J]. Cancer Lett, 2013, 328(1): 10-17.
[14] Lomniczi A, Loche A, Castellano J M,et al. Epigenetic control of female puberty[J]. Nat Neurosci, 2013, 16(3): 281-289.
[15] Terasawa E, Kurian J R, Guerriero K A,et al. Recent discoveries on the control of gonadotrophin-releasing hormone neurones in nonhuman primates[J]. J Neuroendocrinol, 2010,22(7): 630-638.
[16] Kurian J R, Keen K L, Terasawa E. Epigenetic changes coincide with in vitro primate GnRH neuronal maturation[J].Endocrinology, 2010, 151(11): 5359-5368.
[17] 宫永胜, 苑志宇, 张涛, 等. 初情期启动过程中MeCP2和GnRH在母羊下丘脑的分布定位[J]. 中国畜牧杂志, 2017,53(12): 53-55.

