柑橘果胶低聚糖抑菌活性的研究
,,,
(1.浙江工业大学 生物工程学院,浙江 杭州 310014;2.金华市食品药品检验检测研究院,浙江 金华 321000)
果胶低聚糖(POS),又称低聚半乳糖醛酸,由2~20 个半乳糖醛酸通过α-1,4-糖苷键连接而成,是一类新型的益生元[1],研究表明其具有抗菌[2]、促双歧杆菌生长[3-4]以及抗肿瘤[5]、抗氧化[6]、提高机体的免疫调节能力等[7]生理活性,具有较大的研究价值和应用前景.目前,POS可以通过酸水解[8]和热液处理等化学法得到,也可以通过特定原料的解聚或酶水解果胶纯品[9-11]制备得到.聚半乳糖醛酸酶(PG)是常用的果胶酶[12-13],可作用于两个非酯化半乳糖醛酸间的糖苷键,从而使果胶达到降解的效果.
果胶低聚糖自发现以来,国外研究者着重于其对植物的生理活性研究,作为植物抗病防病的诱导剂,但对其抑菌活性关注甚少.虽然目前利用果胶酶水解获得的果胶低聚糖的抑菌活性研究为数不多,但现有研究成果表明果胶分解物对常见的食品污染细菌有明显的抑制作用[14].因此,相比化学防腐剂的毒性,果胶低聚糖无疑是一种极具开发价值的新型天然食品防腐剂.此外,我国的果胶资源丰富[15],柑橘皮渣、苹果皮渣、向日葵盘和甜菜渣等含有大量的天然果胶,均可以用于制备价格低廉、功效独特的果胶低聚糖产品.
1 材料与方法
1.1 菌 种
食品常见细菌:大肠杆菌(Escherichiacoli)、金黄色葡萄球菌(Staphylococcuseureus)、枯草芽孢杆菌(Bacillussubltillus).以上菌种均由浙江工业大学微生物实验室提供.
1.2 实验材料
聚半乳糖醛酸酶(PG)购于广州利华有限公司;普通果胶(DE 65.8%)由衢州果胶有限公司提供;乳酸链球菌素(QB2394-98)购于浙江银象生物工程有限公司;山梨酸钾、苯甲酸钠均为市场食品防腐剂,购于上海阿拉丁生化科技有限公司;D-半乳糖醛酸、七聚半乳糖醛酸(纯度均为98%)和低聚木糖(食品级市售低聚糖,聚合度2~9)购于上海百灵威化工有限公司;麦芽糖、半乳糖和D-木糖和鼠李糖等药品购于中国医药上海化学试剂有限公司,纯度均为95%.
1.3 培养基
细菌培养基(牛肉膏蛋白胨培养基):牛肉膏3 g/L,蛋白胨10 g/L,氯化钠5 g/L,琼脂15~20 g/L,pH 7.0~7.2.
真菌培养基(马玲薯培养基,PDA):马玲薯200 g/L,蔗糖20 g/L,琼脂15~20 g/L,pH自然.
1.4 酶活力的测定
聚半乳糖醛酸酶(PG)活力的测定:3,5-二硝基水杨酸(DNS)比色法测定还原糖[16].酶活单位(U):每分钟产生1 μg半乳糖醛酸所需的酶量为1 个单位聚半乳糖醛酸酶(PG)酶活.
1.5 饱和果胶低聚糖的制备
取2 g酯化度为65.8%的果胶溶于100 mL的pH为4.2的柠檬酸-磷酸氢二钠缓冲液,加入0.4 g果胶PG酶(178.03 U/mL),45 ℃下酶解4 h.每隔0.5 h取一次样,离心处理,保存备用.
纯化处理:果胶低聚糖初样中接入2%活化好的酵母,于30 ℃发酵12~48 h,得到除去单糖的果胶低聚糖酵母发酵液.离心除去酵母菌体后的上清液用孔径为5 000 Da滤膜超滤,获得果胶低聚糖超滤液.
1.6 果胶低聚糖水解度、聚合度和分子量的测定
1.6.1 果胶低聚糖的水解度测定
利用DNS测糖法[16]测定果胶水解度.
1.6.2 高效液相色谱法测定低聚糖聚合度
色谱条件:Waters 1525泵、Waters 2414示差检测器和Waters 2487紫外检测器.Adsorbsphere NH2色谱柱,进样量10 μL,流动相:V(乙腈)∶V(水)=85∶15,流动相流速1.0 mL/min,柱温40 ℃,检测波长245 nm.
对照品:1%的鼠李糖溶液,0.5%的半乳糖溶液(纯度98%),0.5%的D-木糖,0.5%的半乳糖醛酸溶液,0.5%的麦芽糖溶液,0.1%的七聚半乳糖醛酸溶液(纯度98%),0.5%的聚合度为2~9的木糖低聚糖溶液.鼠李糖的保留时间为5.415 min,半乳糖保留时间8.082 min,D-木糖保留时间为6.465 min.半乳糖醛酸保留时间为9.382 min.麦芽糖的保留时间为15.698 min.七聚半乳糖醛酸的保留时间为24.132 min.
1.7 果胶低聚糖与食品防腐剂的抑菌活性比较
采用杯碟法[17]测定果胶低聚糖与食品防腐剂对大肠杆菌、金黄色葡萄球菌和枯草芽孢杆菌的抑菌直径.
最低抑菌浓度(MIC)[18]:将待测抑菌试剂进行倍数稀释,各取1.0 mL加入到含2.0 mL培养基的无菌试管中,接入1.0 mL菌悬液,充分振荡均匀,使各管中含菌量约为107~108cfu/mL,培养1~2 d.培养完成后观察试管内溶液是否清亮,分别取500 μL涂布于平板培养基上,培养1~2 d,观察有无菌落生长.以无菌生长的试剂最低浓度为MIC.另设含等体积不添加试剂的缓冲液作阴性对照,以及添加无菌水和药物的培养基为空白对照,每种处理设3 个平行.
防腐实验:供试桔子若干,用榨汁机鲜榨果汁,适当稀释处理.取若干试管,每管注入10 mL桔子汁,经巴氏灭菌后,注入一定浓度的防腐试剂1 mL,取两支试管,将未经防腐药物处理的供试样品直接装入试管中,分别注入1 mL pH为4.2的缓冲液作为对照.37 ℃下培养,观察防腐效果.
2 结果与讨论
2.1 不同酶解时间制备的果胶低聚糖对抑菌活性的影响
聚半乳糖醛酸酶降解果胶的过程中,先降解成多聚寡糖,再解聚为低聚寡糖和单糖.因此,水解液中还原糖含量的高低可以表征果胶的水解度.由图1可知:当水解时间达到180 min时,果胶水解液的吸光值达到最大,之后随时间的延长,基本维持不变,表明果胶在180 min已基本水解完成.
不同水解时间获得的果胶低聚糖的抑菌活性不同.将间隔30 min获得的果胶低聚糖超滤离心后,高压灭菌10 min,利用杯碟法检测果胶低聚糖对大肠杆菌、金黄色葡萄球菌、枯草芽孢杆菌的抑菌效果.图2表明:只有水解到一定程度的果胶低聚糖才能表现出很好的抑菌活性,且不同菌种对不同聚合度低聚糖的敏感程度不同.当水解时间大于90 min,果胶低聚糖对金黄色葡萄球菌显示很好的抑菌活性,其抑菌圈直径大于2 cm.而对于芽孢杆菌,当水解时间大于180 min,其抑菌活性明显上升,表明只有聚合度低的糖类物质才对其有较强的抑菌作用.相对于上述两种菌,大肠杆菌对果胶低聚糖的敏感度较低,随水解时间的延长,抑菌直径无显著增大.
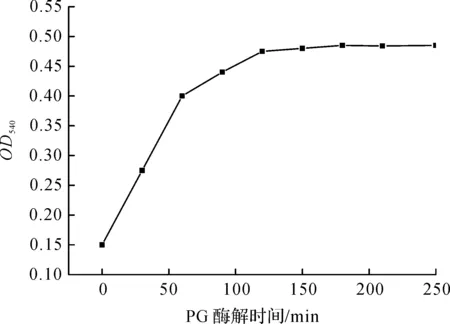
图1 不同酶解时间制备的果胶低聚糖Fig.1 The absorbency of pectic oligosaccharides along with different enzymatic hydrolysis time
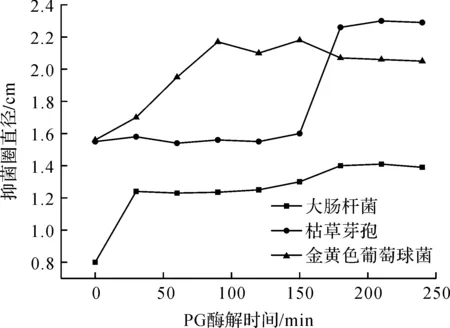
图2 不同酶解时间制备的果胶低聚糖对抑菌活性的影响Fig.2 The effect on bacteriostatic activity of the pectic oligosaccharides along with different enzymatic hydrolysis time
2.2 不同初始pH下酶解制备的果胶低聚糖对抑菌活性的影响
选取敏感度高的金黄色葡萄球菌为参考菌,分别比较pH 3.0,4.2,5.4,6.8条件下酶解制备的果胶低聚糖的抑菌效果,结果如图3所示.由图3可知:在pH 4.2条件下,聚半乳糖醛酸酶水解果胶低聚糖效果最佳,此时不仅水解物中还原糖半乳糖醛酸末端含量最高,水解率达到最大,而且该水解条件下制得的饱和低聚糖的抑菌活性最高.
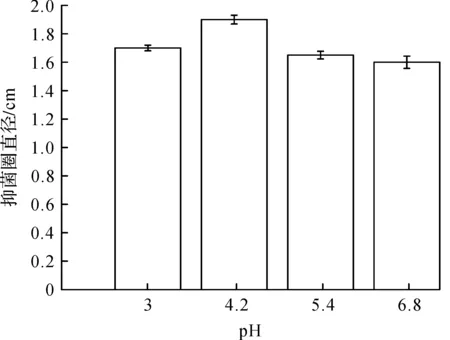
图3 不同初始pH下酶解制备的果胶低聚糖对抑菌活性的影响Fig.3 The effect on bacteriostatic activity of pectic oligosaccharides along with different original pH value of enzymatic hydrolysis
2.3 饱和果胶低聚糖的检测分析
利用聚半乳糖醛酸酶可以获得一系列聚合度的果胶低聚糖:已知在相同液相条件下七聚糖的保留时间为24.132 min,对照图4中各峰的保留时间可知果胶低聚糖液中已含有一定量的聚合度小于7的低聚糖,而聚合度7以上的果胶低聚糖占80%以上.
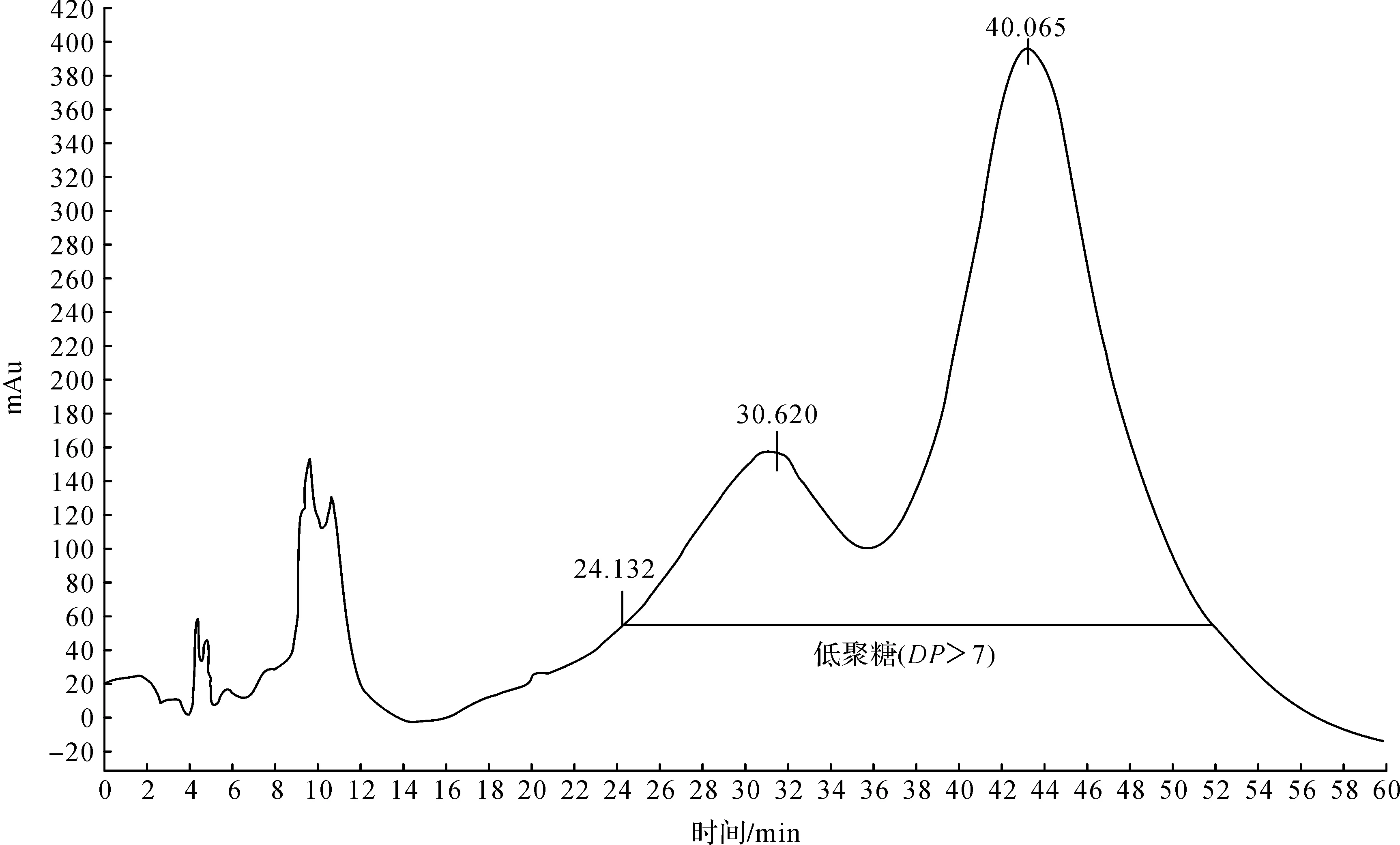
图4 果胶低聚糖液的高效液相色谱分析Fig.4 HPLC analysis of pectic oligosaccharides
2.4 果胶低聚糖与食品防腐剂的抑菌活性比较
2.4.1 抑菌圈的比较
由表1可知:同一质量浓度的果胶低聚糖对金黄色葡萄球菌的抑菌效果最佳,其次为大肠杆菌和枯草芽孢杆菌.当果胶低聚糖质量浓度为0.84 g/L时,其对金黄色葡萄球菌的抑制效果比苯甲酸钠、山梨酸钾和乳酸链球菌素好;当果胶低聚糖质量浓度为1.68 g/L时,其对三种菌的抑菌作用可以与各个食品防腐剂媲美;而当果胶低聚糖质量浓度为2.52 g/L时,其抑菌效果已经超过了几种食品防腐剂.果胶低聚糖作为一种天然的具有生物活性的低聚糖有着其他食品防腐剂不可比拟的优势,因此有望成为一种新型的防腐添加剂应用于食品和化妆品行业.
表1果胶低聚糖与食品防腐剂的抑菌活性比较
Table1Thecomparisonofantibacterialactivitybetweenpectinoligosaccharidesandfoodpreservatives
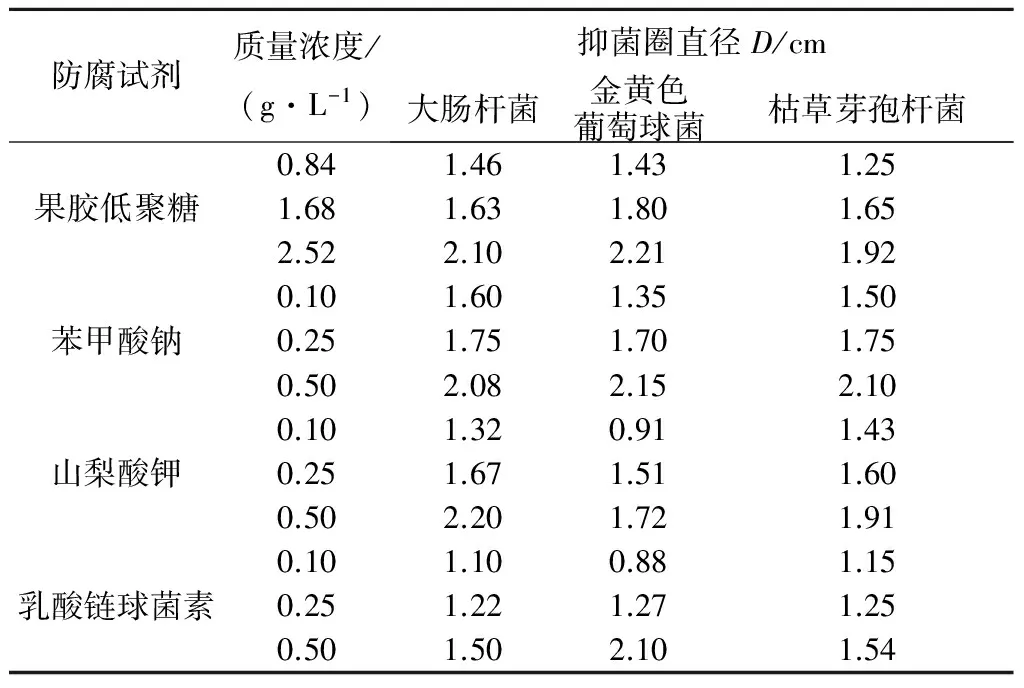
防腐试剂质量浓度/(g·L-1)抑菌圈直径D/cm大肠杆菌金黄色葡萄球菌枯草芽孢杆菌果胶低聚糖0.841.461.431.251.681.631.801.652.522.102.211.92苯甲酸钠0.101.601.351.500.251.751.701.750.502.082.152.10山梨酸钾0.101.320.911.430.251.671.511.600.502.201.721.91乳酸链球菌素0.101.100.881.150.251.221.271.250.501.502.101.54
2.4.2 最低抑菌浓度(MIC)比较
由表2可知:果胶低聚糖的最低抑菌浓度范围为0.11~0.21 g/L,不同菌种对浓度的敏感度有高低,结果表明果胶低聚糖对金黄色葡萄球菌、大肠杆菌、枯草芽孢杆菌的最低抑菌浓度(MIC)分别为0.12,0.16,0.18 g/L.
测得市售食品防腐剂的最低抑菌浓度,并与果胶低聚糖比较,结果如表2所示.虽然化学防腐剂中苯甲酸钠和山梨酸钾的抑菌效果相对较好,但其高毒性严重影响其在食品行业的应用.比较果胶低聚糖与生物防腐剂乳酸链球菌素(Nisin)发现,果胶低聚糖对三种菌株的最低抑菌浓度基本都低于Nisin.此外,观察抑菌圈直径发现Nisin对大肠杆菌、枯草芽孢杆菌和金黄色葡萄球菌的抑菌性能相对较低,而果胶低聚糖则有较好的抑制作用.因此,果胶低聚糖是食品行业中潜在的新兴的天然食品防腐剂,市场应用前景广阔.
表2食品防腐剂最低抑菌浓度(pH4.2)
Table2MICoffoodantiseptictowardsthreetestmicrobes
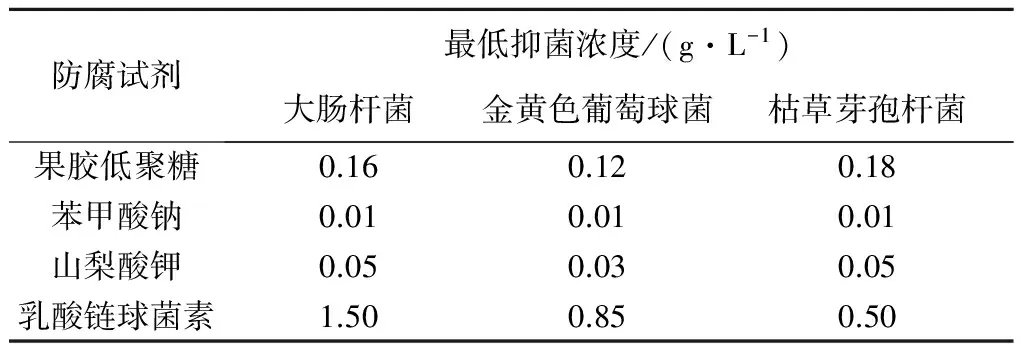
防腐试剂最低抑菌浓度/(g·L-1)大肠杆菌金黄色葡萄球菌枯草芽孢杆菌果胶低聚糖0.160.120.18苯甲酸钠0.010.010.01山梨酸钾0.050.030.05乳酸链球菌素1.500.850.50
2.4.3 对桔汁的防腐效果比较
选用不同质量浓度的果胶低聚糖和市售食品防腐剂对鲜榨桔子汁进行防腐实验.每隔24 h观察一次,共观察5 d.肉眼观察桔子汁的清亮度,结果如表3所示.果胶低聚糖对桔子汁的防腐效果良好,颜色基本清亮.加入低质量浓度的果胶低聚糖的2 个桔子汁样品直到第5天,才稍显混浊;化学防腐剂苯甲酸钠和山梨酸钾在质量浓度为2 g/L时才能维持抑菌功效;而乳酸链球菌素由于抗菌谱较窄的缺点,对桔子汁的防腐效果相对较差.结果证明:果胶低聚糖可以有效地抑制食品中污染细菌的生长,具有良好的食品防腐效果.
表3桔子汁的清亮度变化1)
Table3Changeoftheorangejuicebrightness
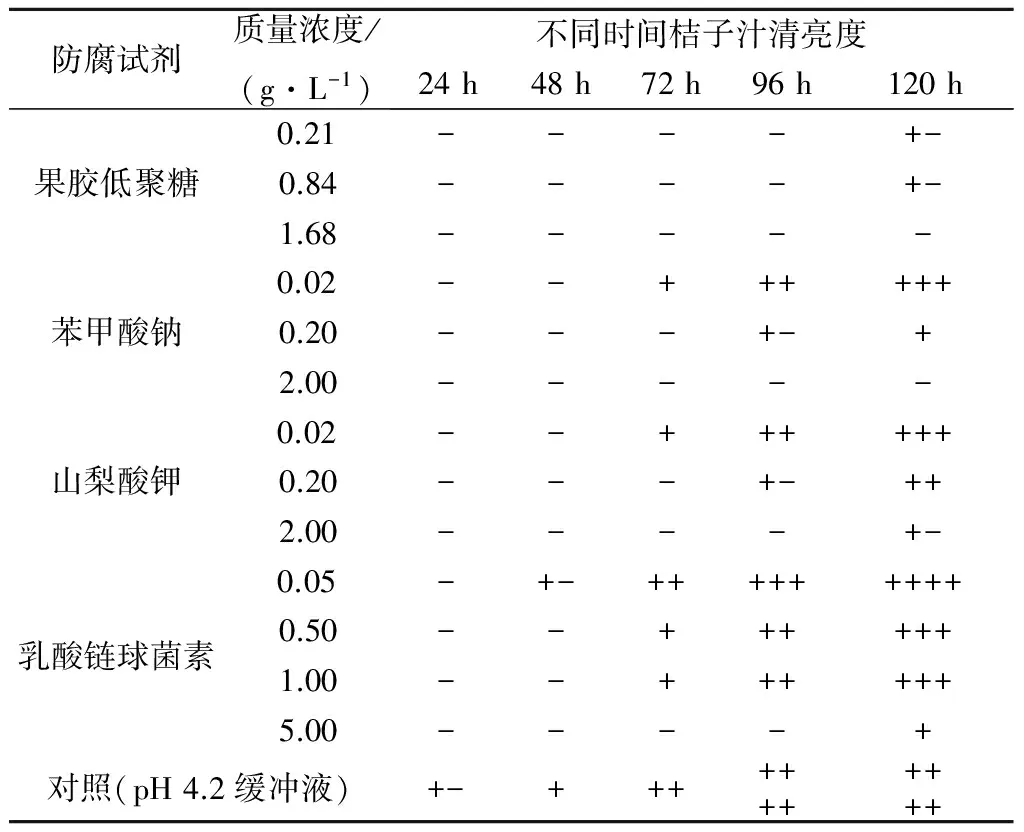
防腐试剂质量浓度/(g·L-1)不同时间桔子汁清亮度24h48h72h96h120h果胶低聚糖0.21----+-0.84----+-1.68-----苯甲酸钠0.02--++++++0.20---+-+2.00-----山梨酸钾0.02--++++++0.20---+-++2.00----+-乳酸链球菌素0.05-+-+++++++++0.50--++++++1.00--++++++5.00----+对照(pH4.2缓冲液)+-+++++++++++
注:1) “-”表示清亮透明;“+-”表示略微混浊;“+”表示混浊,且“+”越多,表示杂菌越多,试样越混浊.
3 结 论
45 ℃下水解果胶(质量浓度20 g/L),PG加酶量为4 g/L (178.03 U/mL),pH 4.2,水解180 min左右能够获得较好抑菌效果的饱和果胶低聚糖,高效液相分析其聚合度大于7.制备的果胶低聚糖对金黄色葡萄球菌和枯草芽孢杆菌具有良好的抑制活性.根据对桔子汁澄清度的观察,发现果胶低聚糖的防腐效果比市售防腐剂显著.因此,果胶低聚糖能够作为新型防腐剂应用于食品行业,市场前景广阔.
参考文献:
[1] OLANO-MARTIN, WILLIAMS M R, GIBSON G R, et a1. Pectins and pectic-oligosaccharides inhibitEscherichiacoliO157:H7 Shiga toxin aft directed towards the human colonic cell line HT29[J].FEMS microbiology letters, 2003, 218(1):101-105.
[2] SUHONG L I, TUOPING L I, RUGANG Z H U, et al. Antibacterial action of haw pecticoligosaccharides[J].International journal of food properties, 2013, 16(3):706-712.
[3] SUZUKI Y, TANAKA K, AMANO T, et al. Utilization by intestinal bacteria and digestibility of arabino-oligosaccharidesinvitro[J].Journal of the Japanese society for horticultural science, 2004, 73(6), 574-579.
[4] 丁长河,鲁慧芳,张建华,等.双歧因子果胶低聚糖的研究进展[J].现代食品科技,2005,21(4):80-82.
[5] JACKSON C L, DREADEN T M, THEOBALD L K, et al. Pectin induces apoptosis in human prostate cancer cells:correlation of apoptotic function with pectin structure[J].Glycobiology, 2007, 17(8):805-819.
[6] TUOPING L I, SUHONG L I, LIJUAN D U, et al. Effects of haw pectic oligosaccharide on lipid metabolism and oxidative stress in experimental hyperlipidemia mice induced by high-fat diet[J].Food chemistry, 2010, 121(4):1010-1013.
[7] VOS A P, VAN ESEH B C, Stahl B, et a1. Dietary supplementation with specific oligosaccharide mixtures decreases parameters of allergic asthma in mice[J].International immunopharmacology, 2007, 7(12):1582-1587.
[8] MANDERSON K, PINART M, TUOHY K M, et al.InVitrodetermination of prebiotic properties of oligosaccharides derived from an orange juice manufacturing by-product stream[J].Applied & environmental microbiology, 2005, 71(12):8383-8389.
[9] BABBAR N, DEJONGHE W, SFORZA S, et al. Enzymatic pectic oligosaccharides (POS) production from sugar beet pulp using response surface methodology[J].Journal of food science and technology, 2017, 54(11):3707-3715.
[10] 沈雪亮,张建勋,章银军,等.两种不同来源果胶低聚糖的抑菌性能研究[J].发酵科技通讯,2015,44(3):23-27.
[11] 王江浪,许增巍,马惠玲,等.由苹果渣制备果胶低聚糖工艺[J].农业工程学报,2009(s1):122-128.
[12] 疏秀林,施庆珊,欧阳友生,等.微生物发酵生产果胶酶的研究概述[J].发酵科技通讯,2010,39(1):25-27.
[13] 魏春,刘洋,周俊利,等.PaenibacilluspabuliWZ008的自絮凝及其种子培养基优化对碱性果胶酶发酵的影响[J].发酵科技通讯,2013,42(1):4-7.
[14] 李学红,张鑫.以苹果渣为原料制备天然食品防腐剂——果胶酶解物的工艺研究[J].食品工业科技,2004,25(2):122-123
[15] 张红燕,赵文娟,任平,等.果皮渣中提取果胶的实验研究[J].山西食品工业.2004(2):33-35.
[16] MILER G L. Use of dinitrosalicylic acid reagent for determination of reducing sugars[J].Analytical chemistry, 1959, 31(3):426-428.
[17] 陈绍铭,郑福寿,等.水生微生物学实验法[M].北京:海洋出版社,1985:249-251.
[18] 李汉浠,任赛赛,李勇,等.枫杨萘醌对常见菌的抗菌谱、最低抑菌浓度和最低杀菌浓度研究[J].时珍国医国药,2012,23(6):1422-1424.

